基于Illumina高通量测序的天津北大港湿地沉积物细菌群落特征和多样性分析
2021-10-22高志伟刘凡惠贾美清张国刚吴光红杨英花
高志伟,刘凡惠,贾美清,张国刚,黄 静,吴光红,杨英花
(1.天津师范大学 生命科学学院,天津300387;2.天津师范大学天津市水资源与水环境重点实验室,天津300387)
湿地是介于水体和陆地的过渡性生态系统,具有重要的经济、生态和社会服务功能.微生物是湿地生态系统的重要组成部分,参与湿地生态系统的物质循环和能量流动,在污染物降解和温室气体排放过程中发挥着重要作用,同时也是对环境质量变化最具敏感性的生物活性指标之一[1].细菌是湿地沉积物微生物中数量和种类最多的类群[2],对湿地的物质转化和降解起着关键的控制作用[3].
天津北大港湿地自然保护区位于天津市东南部(N38°36′~38°57′,E117°11′~117°37′),总面积442.40 km2,是天津市最大的湿地自然保护区[4],在调蓄洪水、调节气候和净化水质等方面具有重要的生态功能.该保护区是东亚—澳大利亚候鸟迁徙的必经之地[5],具有维护生态平衡和维持生物多样性的特殊功能[6].近年来,在气候变化、环境污染等自然和人为因素的影响下,湿地呈现严重的退化趋势[7].关于北大港湿地的研究较多,主要集中在动物多样性[4,8]、植物群落[9-11]、湿地的动态变化[7]、水质评价[12]和底泥养分[6]等方面,对湿地沉积物微生物方面的研究相对缺乏.本研究利用高通量测序技术分析北大港湿地沉积物细菌的组成、群落结构特征和多样性,以期为揭示湿地沉积物细菌的功能进而开发利用湿地微生物资源提供实验基础,也为修复和保护湿地生态环境提供科学依据.
1 材料与方法
1.1 研究区概况
实验区位于天津市北大港湿地的核心区北大港水库,水面面积为164 km2.属暖温带半湿润大陆性季风气候,年平均气温12℃,春季干旱多风,夏季湿热多雨,年均降水量522~663 mm[13],降雨集中在7—8月份[14].植物群落以芦苇(Phragmites australis)群落为主,香蒲(Typha latifolia)和碱蓬(Suaeda salsa)群落零星分布,植被结构单一.
1.2 样品采集
2019年9月,在北大港水库随机设置4个样点,样点间距离400 m以上,每个样点取3次重复.用有机玻璃采样器采集沉积物并根据颜色将其切割为3层,即0~8、8~22和22~28 cm,每个样点的重复间分层混匀.混匀后的每份样品分为2份,分别保存在聚乙烯自封袋中,低温4℃运回实验室.一份用于沉积物理化性质的测定,另一份-20℃保存备用.
1.3 沉积物理化性质的测定
沉积物含水量采用105℃烘干比重法测定.总氮含量采用元素分析仪(2 400-CHNS/O,美国Perkin Elmer公司)测定.总有机碳含量采用Multi N/C 3100分析仪(德国Analytik Jena AG公司)测定.
1.4 沉积物DNA的提取与PCR扩增
用E.Z.N.A.RSoil DNA Ki(t美国OmegaBio-tek公司)试剂盒提取沉积物的基因组DNA后,利用1%琼脂糖凝胶电泳检测提取的DNA,并用超微量分光光度计检测DNA浓度.利用引物515F(5′-GTGCCAGCMGCCGCGG-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′)对细菌16S rRNA基因V4-V5区进行PCR扩增.PCR采用TransGen AP221-02:TransStart FastPfu DNA Polymerase.PCR反应体系:4 μL 5×FastPfu Buffer,2 μL dNTPs,0.8 μL F Primer(5 μmol/L),0.8 μL R Primer(5 μmol/L),0.4 μL FastPfu Polymerase,10 ng Genomic DNA,用超纯水补足至20 μL.PCR扩增条件为:95℃3 min;95℃30 s,55℃30 s,72℃45 s,27个循环;72℃10 min.每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(美国Axygen公司)切胶回收PCR产物,经Tris-HCl洗脱后用2%琼脂糖凝胶电泳检测.
1.5 Miseq文库构建和测序
参照电泳初步定量结果,用Quanti-FluorTM-ST蓝色荧光定量系统(美国Promega公司)对PCR产物进行检测定量,之后按照每个样本的测序量要求进行相应比例的混合.连接“Y”字形接头,使用磁珠筛选去除接头自连片段,利用PCR扩增进行文库模板的富集,氢氧化钠变性,产生单链DNA片段.利用桥式PCR和可逆性末端终结技术,按照Illumina MiSeq平台的标准测试方法,由上海美吉生物医药科技有限公司进行高通量测序,最终得到模板DNA片段的序列.
1.6 数据的优化和统计分析
利用FLASH软件将成对的reads拼接(merge)成一条序列,同时利用FASTQC和Trimmomatic软件对reads的质量和拼接效果进行质控和过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列并校正序列方向.利用Usearch软件平台将相似性≥97%的序列归为一个OTU(operationaltaxonomicunits),按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列.为了得到每个OTU对应的物种分类信息,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析.利用Mothur软件计算菌群的丰富度指数Chao1、多样性指数Shannon以及测序深度指数Coverage.Chao1是表示样本中所含OTU数目的指数,在生态学中常用来估计物种总数.Shannon指数越大,说明菌群多样性越高.Coverage反映本次测序结果是否代表了样本中微生物的真实情况,数值越高,样本中序列被测出的概率越高.分类学比对后根据置信度阈值的筛选,会有某些分类谱系低于置信阈值,没有得到分类信息,在统计时以Unclassified作为没有分类信息的标记.
利用SPSS18.0进行单因素方差分析(One-way ANOVA),比较不同深度细菌群落的多样性指数和丰富度差异,利用Tukey HSD检验差异的统计学意义(P<0.05).利用Pearson相关分析研究各门细菌的相对丰度与沉积物理化性质间的相关关系.利用origin9.0和Sigmaplot 12.0软件绘图.
2 结果与分析
2.1 细菌的优化数据和多样性分析
利用MiSeq测序平台对北大港水库沉积物中细菌16S rRNA基因V4~V5区进行多样性分析,结果如表1所示.由表1可以看出,0~8 cm和8~22 cm层的优化序列数相近,大于22~28 cm层.8~22 cm层的细菌OUT最多,其次是0~8 cm层.各层沉积物中细菌的覆盖率分别为0.95%、0.95%和0.97%,表明取样合理[15].0~8 cm和8~22 cm沉积物层的含水量、总氮和总有机碳含量、细菌菌群的多样性指数和丰富度指数均显著高于22~28 cm层的数值.测序结果基本能够反映沉积物样本中细菌的群落特征.

表1 不同深度沉积物的理化因子及细菌多样性Tab.1 Sediment physicochemical factors and diversity of bacteria at different sediment depth
稀释性曲线能够说明测序的深度情况.北大港水库各层沉积物细菌的稀释曲线如图1所示.由图1可以看出,随着序列数的逐渐增加,细菌的稀释性曲线基本趋向平坦,但均未达到饱和.表明各层沉积物样品的测序数据量较合理,基本能够覆盖样品中的大部分细菌.
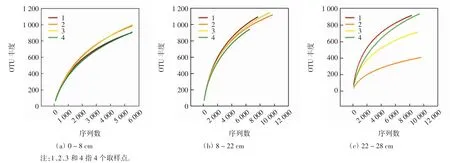
图1 不同沉积物层细菌的稀释曲线Fig.1 Dilution curve analysis of bacterial OTUs at different sediment depth
2.2 沉积物细菌的群落结构
在Silva数据库中对优化序列进行比对,用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,共获得2 025个OTU.明确分类地位的细菌有16个门42纲70个目116科187属.在门水平上,细菌相对丰度≥1%的有10个门,如图2所示.

图2 门水平细菌的相对丰度Fig.2 Bacterial relative abundance at phylum level
0~8 cm沉积物层中,变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)是细菌中的优势类群,其相对丰度分别为44.73%、16.84%和10.25%;其他已知类群的相对丰度分别为浮霉菌门(Planctomycetes)4.73%、芽单胞菌门(Gemmatimonadetes)2.61%、拟杆菌门(Bacteroidetes)2.32%、硝化螺旋菌门(Nitrospirae)2.10%、绿菌门(Chlorobi)1.73%、厚壁菌门(Firmicutes)1.59%和放线菌门(Actinobacteria)1.57%;未分类细菌和其他细菌的相对丰度分别为4.07%和7.46%.在8~22 cm沉积物层中,变形菌门、绿弯菌门和酸杆菌门仍然是优势类群,其相对丰度分别为37.24%、14.02%和11.27%;其次是厚壁菌门6.89%、浮霉菌门6.20%、芽单胞菌门5.21%、放线菌门3.12%、拟杆菌门2.88%、硝化螺旋菌门2.62%和绿菌门0.98%;未分类细菌和其他细菌的相对丰度分别为3.17%和6.38%.在22~28 cm沉积物层中,厚壁菌门、变形菌门和绿弯菌门是优势类群,其相对丰度分别为45.84%、21.95%和6.26%;其次为芽单胞菌门4.26%、酸杆菌门4.18%、硝化螺旋菌门3.49%、放线菌门3.2%、浮霉菌门2.55%、拟杆菌门1.02%、绿菌门0.43%;未分类细菌和其他细菌的相对丰度分别为3.40%和3.43%.
在纲水平上,细菌相对丰度≥1%的有12个纲,如表2所示.在0~8 cm沉积物层中,隶属于变形菌门的β-变形菌纲(Betaproteobacteria)、绿弯菌门的厌氧绳菌纲(Anaerolineae)和酸杆菌门的酸杆菌纲(Acidobacteria)相对丰度较高,分别为22.52%、11.66%和10.25%;在8~22 cm沉积物层中,隶属于变形菌门的α-变形菌纲(Alphaproteobacteria)、酸杆菌门的酸杆菌纲和绿弯菌门的厌氧绳菌纲的相对丰度较高,分别为12.46%、11.27%和10.05%;在22~28 cm沉积物层中,隶属于厚壁菌门的芽孢杆菌纲(Bacilli)、变形菌门的γ-变形菌纲(Gammaproteobacteria)和α-变形菌纲的相对丰度较高,分别为45.84%、9.52%和5.84%.

表2 不同深度沉积物细菌纲水平的组成及其相对丰度Tab.2 Bacterial composition and relative abundance at class level at different sediment depth %
在目水平上,0~8 cm沉积物层中相对丰度≥1%的有19个目,其中79%已确立分类地位:厌氧绳菌目(Anaerolineales)相对丰度最高,为15.99%;其次是嗜氢菌目(Hydrogenophilales),相对丰度为10.05%;再次是绿弯菌门Ardenticatenia纲的某目,相对丰度为4.88%.在8~22 cm沉积物层中相对丰度≥1%的有22个目,能够准确分类的占77.3%:厌氧绳菌目相对丰度最高,为8.70%;其次是红螺菌目(Rhodospirillales),为6.41%;再次是芽孢杆菌目(Bacillales),相对丰度为5.03%.22~28 cm沉积物层中相对丰度≥1%的有15个目,能够准确分类的占80%:乳酸杆菌目(Lactobacillales)相对丰度最高,为26.36%;其次是芽孢杆菌目,为19.47%;再次是厌氧绳菌目,为5.25%.
在科水平上,0~8 cm沉积物层中相对丰度≥1%的有17个科,其中70.6%已确立分类地位,在已确立分类地位的科中隶属于β-变形菌纲的Hydrogenophilaceae相对丰度最高,为17.34%;其次是厌氧绳菌科(Anaerolineaceae),为11.66%;再次是浮霉菌科(Planctomycetaceae),为3.54%.8~22 cm沉积物层中相对丰度≥1%的有21个科,其中61.9%已确立分类地位:厌氧绳菌科相对丰度最高,为10.05%;其次是Hydrogenophilaceae,为4.40%;再次是亚硝化单胞菌科(Nitrosomonadaceae),为4.36%.在22~28 cm沉积物中相对丰度≥1%的有15个科,66.67%已确立分类地位:链球菌科(Streptococcaceae)相对丰度最高,为25.43%;其次是芽胞杆菌科(Bacillaceae),为9.13%;再次是厚壁菌门芽孢杆菌纲芽孢杆菌目的Planococcaceae,为8.99%.
在属水平上,0~8 cm沉积物层中细菌相对丰度≥1%的属有14个:厌氧绳菌科的某属相对丰度最高,为8.95%;其次是绿弯菌门的Ardenticatenia,为2.40%;其他能够准确分类的有硝化螺旋菌属(Nitrospira)1.62%、浮霉状菌属(Planctomyces)1.69%、螺旋体属(Spirochaeta)1.19%.在8~22 cm沉积物层中细菌相对丰度≥1%的属有17个:厌氧绳菌科某属相对丰度最高,为8.31%;其次是绿弯菌门的Ardenticatenia,为2.99%;其他能够准确分类的有硝化螺旋菌属,为1.97%,浮霉状菌属2.09%.在22~28 cm沉积物层中细菌相对丰度≥1%的属有16个:厌氧绳菌科的某属相对丰度最高,为8.56%;其次是硝化螺旋菌属,为2.82%;再次是浮霉状菌属,为1.51%.
门水平上细菌相对丰度与沉积物理化因子的Pearson相关分析结果如表3所示.由表3可以看出,单芽孢菌门和放线菌门相对丰度与沉积物的含水量、总氮和总有机碳含量呈显著负相关关系(P<0.05).变形菌门和绿菌门相对丰度与沉积物含水量、总氮和总有机碳含量呈显著正相关关系(P<0.05).厚壁菌门、酸杆菌门、浮霉菌门、硝化螺旋菌门、绿弯菌门和拟杆菌门相对丰度与沉积物的含水量、总氮和总有机碳含量没有显著相关关系(P>0.05).
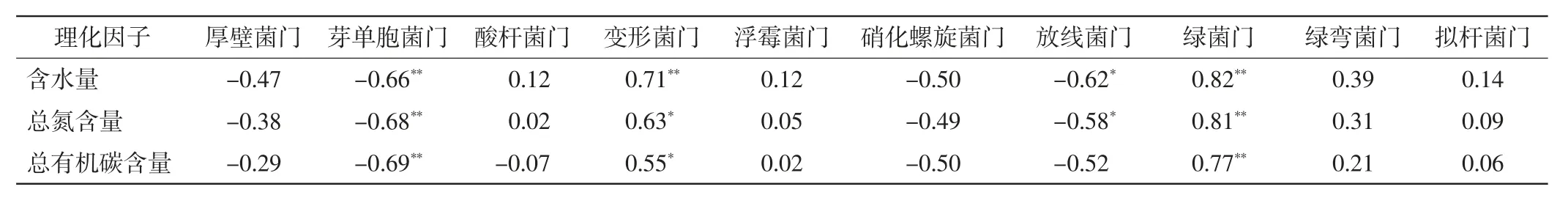
表3 门水平上细菌相对丰度与沉积物理化因子的相关关系Tab.3 Pearson correlation analysis between the relative abundance of bacteria at phylum level and physicochemical factors of sediment
3 讨论与结论
本研究应用高通量测序技术研究了天津北大港湿地核心区北大港水库0~28 cm沉积物中细菌的群落结构组成,结果表明,变形菌门、酸杆菌门、绿弯菌门、厚壁菌门、硝化螺旋菌门、放线菌门、拟杆菌门、浮霉菌门、绿菌门和芽单胞菌门是主要的细菌门类.细菌的分类单位越小,能明确其分类地位的细菌比例越小.在属水平上很大一部分细菌都不能明确其地位,表明天津北大港湿地沉积物蕴藏着较多潜在的新细菌物种尚待发掘.
变形菌门是本研究在0~22 cm沉积物层中鉴定到的细菌最丰富的类群,这与国内外关于水体、沉积物等各类环境中变形菌门相对丰度的研究[16-22]结果一致.Ravenschlag等[23]和Li等[24]分别对北极群岛海洋沉积物微生物群落结构和南海地区的表层沉积物细菌群落的研究表明,γ-变形菌纲和δ-变形菌纲在变形菌门类群中占主导地位.黄媛等[25]对杭州西溪湿地0~8 cm沉积物层细菌群落结构的研究结果也显示,β-变形菌纲、γ-变形菌纲及δ-变形菌纲是变形菌门中的优势菌群.本研究也得到了相似结论,即变形菌门的不同纲分别在不同深度的沉积物中占优势,其中,β-变形菌纲在0~8 cm沉积物中占优势,α-变形菌纲在8~22cm沉积物中占优势,γ-变形菌纲在22~28 cm沉积物中占优势.相对丰度较高的硝化细菌亚硝化单胞菌属(Nitrosomonas)、亚硝化单胞菌科的属(Nitrosomonadaceae_unclassified、Nitrosomonadaceae_uncultured)和硝化刺菌属(Nitrospina)均属于β-变形菌纲;相对丰度较高的硝化球菌属(Nitrococcus)和亚硝化球菌属(Nitrosococcus)属于γ-变形菌纲.本研究中检出的甲烷氧化菌甲基杆菌属(Methylobacter)、甲基球菌科的属(Methylococcaceae_unclassified)和甲基孢囊菌科的属(Methylobacteriaceae_uncultured)属于γ-变形菌纲[26].参与硫循环的硫氧化和硫还原细菌主要是变形菌门中的γ-变形菌纲和β-变形菌纲.本研究中硫氧化细菌中的硫碱螺旋菌属(Thioalkalispira)和硫杆菌属(Thiobacillus)、硫还原细菌中的Desulfuromonas、脱硫叶菌属(Desulfobulbus)、脱硫盒菌科的属(Desulfarculaceae_uncultured)、脱硫杆菌科的属(Desulfobacteraceae_unclassified和Desulfobacteraceae_uncultured)相对含量较高,这些菌群共同作用,在湿地生态系统碳、氮、硫等元素循环中发挥着重要功能.Fierer等[27]的研究结果表明变形菌门与碳的利用有关.本研究中变形菌门的相对丰度与土壤总有机碳和总氮含量呈显著正相关,进一步表明它在沉积物碳、氮循环中具有重要作用.
在0~22 cm沉积物层中酸杆菌门的相对丰度仅次于变形菌门,也是本研究中发现的优势类群,这与陈会海[28]对三江湿地土壤、余悦[29]对黄河三角洲土壤微生物多样性的研究结果一致.0~22 cm沉积物中绿弯菌门的相对丰度大于变形菌门和酸杆菌门的数值.绿弯菌门的细菌能通过光合作用产生能量,相关研究表明绿弯菌是活性污泥的组成之一[30],与COD的去除有显著正相关关系[31],且绿弯菌门中的Levilinea属对染料中的萘有去除作用[32].本研究中隶属于绿弯菌门厌氧绳菌目厌氧绳菌科的某属和绿弯菌门的Ardenticatenia属是0~22 cm沉积物的优势菌属.绿弯菌门的厌氧绳菌目细菌主要功能是分解腐殖酸、还原硫酸盐以及产甲烷等,以此来改变周围的地质环境.厌氧绳菌目细菌在泥炭土壤的深层、拟穴青蟹的养殖水池[33-34]和厌氧动态膜生物反应器[35]中的研究均有报道,本研究中该目细菌的具体功能有待进一步深入探究.在22~28 cm沉积物层中厚壁菌门细菌是优势类群,相对丰度最高,为45.84%,变形菌门和绿弯菌门次之.本研究中芽孢杆菌纲是厚壁菌门的主要组成部分.芽孢杆菌纲内的物种大多可形成抗逆性极强的芽孢,具有较强的环境适应性[36]和防病抗病作用[37],在降解原油[38]和土壤中的难溶化合物[39-40]、生产生防菌剂[36]和固定空气中的氮[41]等方面发挥着重要作用.隶属于硝化螺旋菌门的硝化螺旋菌属细菌在氮循环中可将亚硝酸盐氧化成硝酸盐,目前在污水处理中[42-43]已被广泛运用.本研究发现,在北大港湿地0~28 cm沉积物中硝化螺旋菌属细菌相对丰度>1%,表明该湿地的亚硝酸盐含量较高,存在一定程度的氮污染.
本研究采用Alpha多样性分析中的丰富度指数(Chao 1指数)和多样性指数(Shannon index)对湿地沉积物细菌菌群的丰富度和多样性进行了分析.其中0~22 cm沉积物层中细菌菌群的多样性和丰富度较高,而22~28 cm沉积物层中细菌菌群的多样性和丰富度相对较低.郑艳玲等[44]研究发现,丰富的有机营养可能会促进特定菌群的富集,限制其他种类细菌的生长,从而使多样性指数降低.本研究中0~8 cm沉积物层总氮和总有机碳的含量显著高于8~22 cm沉积物层的含量,细菌菌群的丰富度和多样性略低于后者,推测可能是表层丰富的营养物质促进了特定菌群的生长,限制了其他种类微生物的生长,从而导致细菌菌群的多样性和丰富度较低.微生物的生存和生长繁殖是多种生物因子和非生物因子共同作用的结果,综合各种因子的影响才能较全面地研究导致菌群丰富度和多样性差异的根本原因.
