SMURF2在前列腺癌细胞中调节STAT1的泛素化并促进EMT
2021-10-22董佳杰党燕梅
董佳杰,党燕梅,张 驰,蒋 顺,刘 平,卢 山
(南京师范大学生命科学学院,生物化学与生物制品研究所,江苏 南京 210023)
前列腺癌(prostate cancer,PCa)是老年男性的高危疾病,在世界范围内,前列腺癌发病率在男性恶性肿瘤中位居第2位[1]. 随着疾病的发展,多数前列腺癌将转变为转移性去势抵抗性前列腺癌,这是前列腺癌致死的重要原因,目前没有治愈的方法[2]. 因此针对前列腺癌相关分子机制的研究具有重要意义.
SMURF1(smad ubiquitination regulatory factor 1)和SMURF2是两个紧密相关的C2-WW-HECT结构域E3泛素连接酶,属于NEDD4(neural precursor cell-expressed developmentally downregulated gene 4)亚家族. 与其他NEDD4家族成员(共9个)相似,包含N端C2结构域,介导这些E3s与细胞内膜的结合;几个含有色氨酸的WW结构域,被认为介导E3s与它们的相互作用元件和底物之间的蛋白质-蛋白质相互作用;以及进化保守的HECT结构域,一些研究表明NEDD4家族的E3的HECT结构域也参与底物识别[3-5]. 在哺乳动物中,SMURF1和SMURF2分别由位于第7和17号染色体的两个不同基因编码. 人类SMURF1有3种异构体,它们是由选择性剪接产生的,而SMURF2只有单一蛋白产物. Smurfs有很高的序列同源性(>70%的氨基酸序列同源性),并具有相似的结构特征. 尽管它们的底物库有高度的相似性和一些冗余性,但这些蛋白质在某些方面会表现出相反的生物学功能[6].
研究表明SMURF2在不同类型癌症中发挥促癌或抑癌作用. 有研究报道SMURF2在几种癌症中显著上调,比如在结直肠癌中沉默SMURF2可减少结肠癌细胞的迁移和侵袭[7]. SMURF2还可以与EGFR(epidermal growth factor receptor)相互作用,使其以连接酶活性依赖的方式泛素化,这种相互作用会抵消RNF55(RING finger protein 55)对EGFR的泛素化降解从而增强EGFR信号通路[8]. SMURF2的敲低可显著降低乳腺癌和口腔癌细胞系中CNKSR2(connector enhancer of kinase suppressor of ras2)的蛋白水平[9]. 但是野生型和无催化活性的SMURF2都能稳定癌细胞中CNKSR2的水平[10]. 也有关于SMURF2抑制癌症的报道,SMURF2-/-小鼠早期相对正常,但随着年龄的增长,这些小鼠会在不同的组织和器官发展成各种肿瘤,包括肝、血、肺、垂体等[11],杂合子SMURF2小鼠也容易患自发性肿瘤[12].
有文献报道SMURF2在正常细胞和组织中主要是核定位,但在前列腺癌中SMURF2显示出明显增加的胞质螯合,与疾病进展相关[13]. 还有文献报道在前列腺癌细胞PC-3中,硼替佐米以剂量依赖的方式降低前列腺癌细胞系中SMURF2基因的转录和表达水平,从而抑制了前列腺癌细胞的增殖[14]. 泛素连接酶SMURF2基因的转录和表达水平升高可能参与前列腺癌的发生、发展和转移[15].
1 材料与方法
1.1 材料
TOP10感受态细胞购自上海唯地生物技术有限公司;表达载体pcDNA3.1(+)为本实验室保存;EcoRⅠ、EcoRⅤ购自NEB公司;DNA Marker购自上海捷瑞生物公司;蛋白质Marker购自Themo Fisher公司;T4 DNA ligase购自TaKaRa公司;DNA胶纯化试剂盒购自诺唯赞公司;质粒小提试剂盒购自天根生化科技有限公司;SMURF2、Slug抗体、琼脂糖珠购自Santa Cruz公司;STAT1、Vimentin、E-cadherin、N-cadherin抗体均购自Proteintech公司;β-actin抗体、绿色荧光二抗、红色荧光二抗均购自ABclonal公司;山羊抗小鼠IgG、MG132、RIPA裂解液均购自碧云天生物技术有限公司;RPMI 1640培养基购自维森特生物技术(南京)有限公司;胎牛血清购自美国Gibco公司;胰蛋白酶(trypsin)购自Biosharp生物科技公司;Lipofectamine®2000转染试剂购自美国Invitrogen公司.
1.2 实验方法
1.2.1 真核表达载体pcDNA3.1(+)-SMURF2的构建
根据人基因SMURF2核苷酸序列和载体pcDNA3.1多克隆位点,设计合成SMURF2-F和SMURF2-R两条引物. 引物序列如下(划线部分为酶切位点,上游为EcoRⅠ,下游为EcoRⅤ):
SMURF2-F:5′CCGG^AATTCATGTCTAACCCCGGAGGCCG 3′;
SMURF2-R:5′AGGAT^ATCTCATTCCACAGCAAATCCACATGTT 3′.
提取DU145细胞总RNA,反转录为cDNA,以其为模板PCR得到SMURF2基因PCR产物,双酶切pcDNA3.1质粒和SMURF2基因的PCR产物,经T4 DNA ligase连接后转化至TOP10. 转化液涂布到氨苄抗性的LB(Luria-Bertani)平板上,37 ℃倒置培养,待长出单菌落. 提取单菌落中的质粒进行测序,获得正确的重组质粒pcDNA3.1(+)-SMURF2.
1.2.2 细胞培养及细胞传代
本研究中所用的细胞株包括人正常前列腺基质细胞WPMY-1、前列腺增生细胞BPH1、前列腺癌细胞PC-3、DU145、CWR22RV1和LNCaP,均为本实验室保存. 细胞培养使用RPMI 1640完全培养基,放置于 37 ℃、5% CO2培养箱中培养. 用0.25%的胰蛋白酶消化传代,2 d~3 d传代一次.
1.2.3 细胞转染
转染前一天,胰酶消化细胞后计数种板,待细胞密度达到60%~70%时,即以质粒质量:lipofectmine体积=1:2的比例进行转染,用新鲜无血清培养基分别稀释Lipofectmine®2000试剂和质粒DNA,充分轻柔混匀,然后将Lipofectmine®2000试剂稀释液加入到质粒DNA稀释液中,充分混匀,室温静置15 min后,弃除旧培养基,然后在每孔中加入相应体积新鲜无血清培养基,将DNA-脂质体复合物加至细胞中孵育 4 h~6 h后更换为正常的完全培养基,继续培养48 h.
1.2.4 免疫印迹(Western blotting)分析
去除培养液,用1×PBS漂洗细胞2次. 加入120 μL/孔的RIPA细胞裂解液(加有预冷的PMSF);将细胞刮下并将细胞裂解液收集至1.5 mL的离心管中,置于冰上放置30 min,每隔10 min涡旋一次,使细胞裂解充分;12 000 r/min离心15 min,取上清. 以牛血清白蛋白(BSA)作为标准蛋白,用DC法对上清样品进行总蛋白定量后,取20 μg总蛋白样品进行SDS-PAGE电泳;电泳结束后,将蛋白质转移至PVDF膜上;用含5%脱脂奶粉的1×PBS室温封闭1 h;PBST清洗3次后,4 ℃孵育一抗过夜;第二天PBST清洗3次后,室温孵育二抗1 h;ECL进行化学发光显色、拍照,并对条带进行灰度分析.
1.2.5 免疫共沉淀(Co-IP)实验
收集不同转染处理的细胞(100 mm培养皿),预冷的1×PBS清洗细胞2次,每皿加入350 μL的RIPA细胞裂解液(加有预冷的PMSF),将细胞刮下并将细胞裂解液收集至1.5 mL的离心管中,置于冰上放置30 min,每隔10 min涡旋一次,使细胞裂解充分;12 000 r/min离心15 min,取上清. 以BSA作为标准蛋白,用DC法对上清样品进行总蛋白定量,将每一蛋白裂解液样品分为3份,Input 组、IgG 组和目的组;分别向IgG 组和目的组加入1 μg的IgG抗体和目的抗体,4 ℃缓慢晃动过夜;准备琼脂糖珠,用1×PBS润洗3遍后加入到孵育过夜的IgG管和目的抗体管中,4 ℃缓慢摇晃孵育4 h;免疫沉淀后,4 ℃,3 000 r/min离心 5 min,将琼脂糖珠离心到管底,小心吸去上清;最后加入2×Loading Buffer,轻轻混匀,95 ℃煮5 min,离心取上清液电泳,对照组和目的蛋白组上样体积要一致,Input组上样20 μg.
1.2.6 免疫荧光(Immunofluorescence)实验
将细胞种到12孔板中,1×105个/孔,24 h后,将细胞用1×PBS清洗3次;用4%的多聚甲醛固定 30 min,PBS清洗3次,每次5 min;0.1% Triton X-100室温通透25 min;1×PBS清洗3次,每次3 min;滴加3% BSA,室温封闭30 min;每孔滴加足够量稀释的一抗(1∶200),4 ℃孵育过夜;加荧光二抗,20 ℃~37 ℃避光孵育1 h;PBST清洗3次,每次3 min;滴加DAPI避光孵育3 min~5 min,对标本进行染核,用PBST清洗4次,每次5 min;荧光显微镜下观察拍照.
1.2.7 统计分析
使用Excel和GraphPad软件进行统计分析和作图,所有实验数据的结果统计均以Mean±标准误(SEM)表示. 使用t检验分析数据以确定不同组之间的显著差异.P<0.05被认为具有统计学意义.
2 结果与讨论
2.1 不同正常组织和肿瘤组织中SMURF2的表达水平
泛素-蛋白酶体系统(UPS)已成为蛋白质功能和稳定性的重要监督者. UPS在真核细胞过程中具有许多重要作用,包括细胞周期进程、应激反应、信号转导、DNA修复、调控转录因子活性和膜转运等[16]. 超过80%的蛋白质被UPS降解,UPS已经成为调节各种细胞过程的重要参与者[17]. UPS在许多人类疾病如癌症和神经退行性疾病的发病机制中起着关键作用[18]. SMURF2属于HECT家族E3泛素连接酶,拥有广泛的底物,参与多条信号通路. 首先利用PROTEINATLAS网站对TCGA(the cancer genome atlas)数据库中不同正常组织及肿瘤组织中SMURF2的蛋白水平进行分析,如图1A,B所示,结果显示SMURF2蛋白在前列腺正常组织和肿瘤组织中表达存在差异:在前列腺正常组织中未能检测到SMURF2蛋白的表达,但在部分前列腺肿瘤患者中却能够检测到SMURF2蛋白的表达.
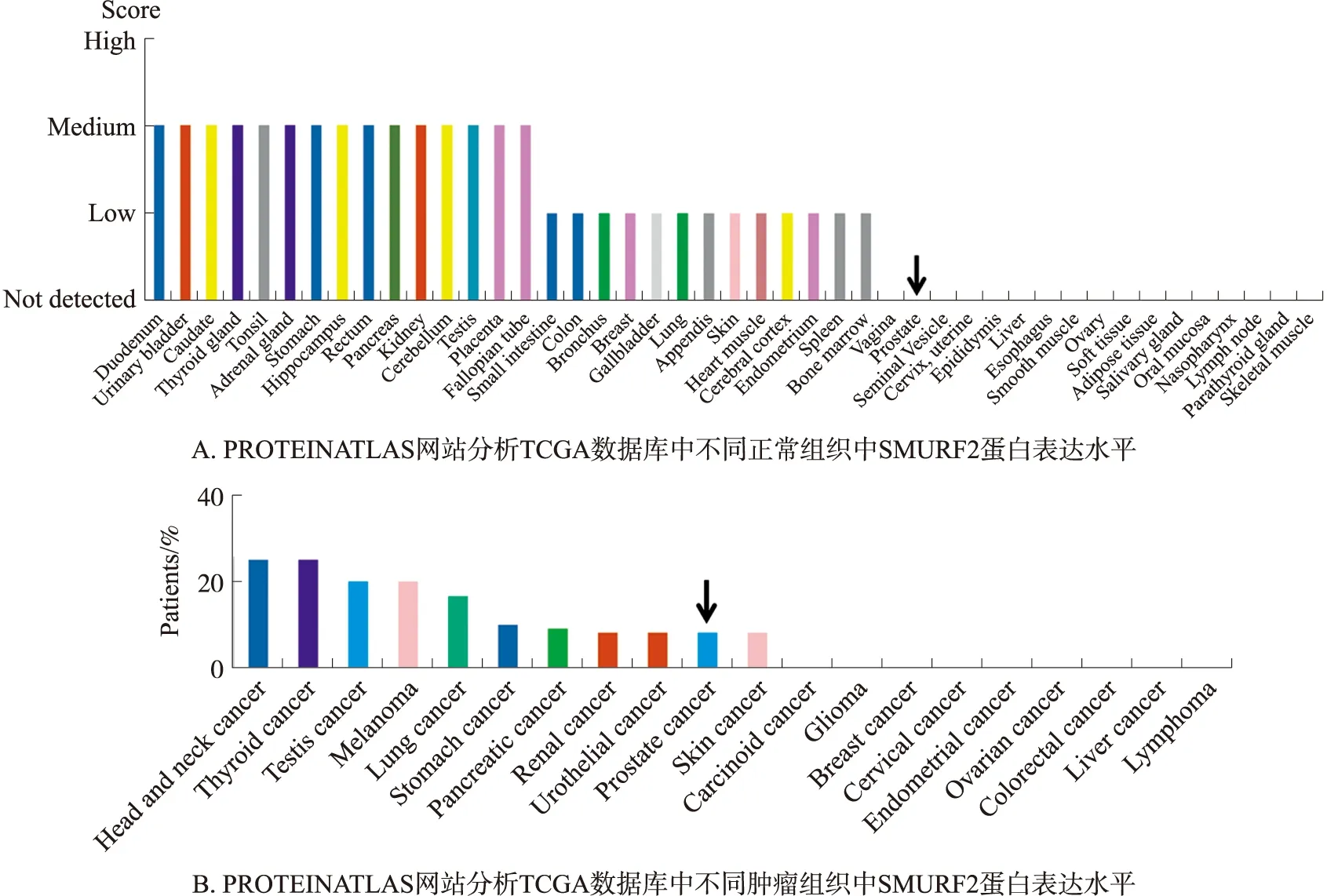
图1 不同正常组织和肿瘤组织中SMURF2表达水平Fig.1 The expression level of SMURF2 in different normal tissues and tumor tissues
2.2 SMURF2表达质粒的构建
提取DU145细胞总RNA,反转录为cDNA,以其为模板,加入设计好的SMURF2引物,PCR扩增后,经琼脂糖凝胶电泳鉴定,在2 000 bp~3 000 bp有一条目的条带,与理论值(约2 247 bp)相符,结果如图2A所示,序列分析显示为正确的SMURF2基因. 将目的基因片段与pcDNA3.1质粒载体进行双酶切连接后,连接产物转化大肠杆菌Top10感受态细胞,氨苄抗生素LB培养平板初筛阳性克隆,菌落PCR进一步鉴定阳性克隆(图2B). 将阳性克隆菌落进行小量扩大培养后,提取质粒,进行单双酶切验证,如图2C所示. 至此初步鉴定质粒构建成功,并命名为pcDNA3.1(+)-SMURF2(图2D).
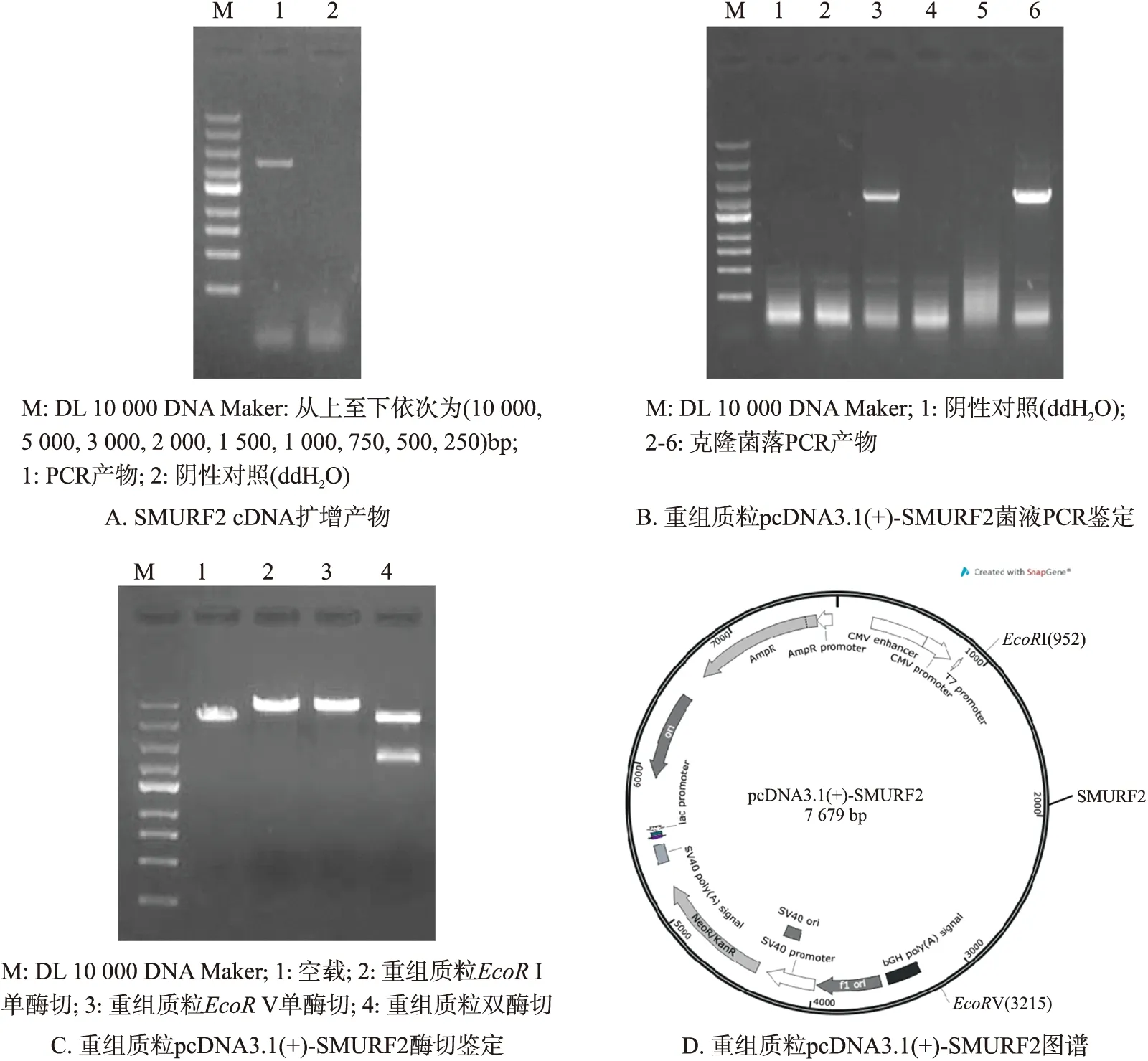
图2 SMURF2表达质粒的构建Fig.2 Construction of SMURF2 expression plasmid
2.3 SMURF2在前列腺癌细胞系中高表达
接下来,利用RT-PCR和Western blotting在前列腺(癌)细胞WPMY-1、BPH1、PC-3、DU145、22Rv1、LNCaP中,检测SMURF2的表达. 当细胞密度到80%时,提取细胞的总RNA和总蛋白,图8A,B所示为SMURF2在6种细胞中mRNA和蛋白水平的表达情况. 从结果中可以看出,在6种细胞的蛋白水平上,正常前列腺细胞WPMY-1中SMURF2表达量最低,其中PC-3和DU145细胞中SMURF2蛋白的表达水平最高,mRNA水平与蛋白水平基本一致,图1C为SMURF2蛋白水平的灰度分析结果. 通过网站和数据库分析SMURF2可能是STAT1的E3泛素连接酶,因此,想进一步探究二者的关系. 在PC-3、DU145、WPMY-1、22Rv1细胞中过表达SMURF2,检测对STAT1蛋白的影响,Western blotting结果显示过表达SMURF2后STAT1蛋白水平降低,如图1D所示.
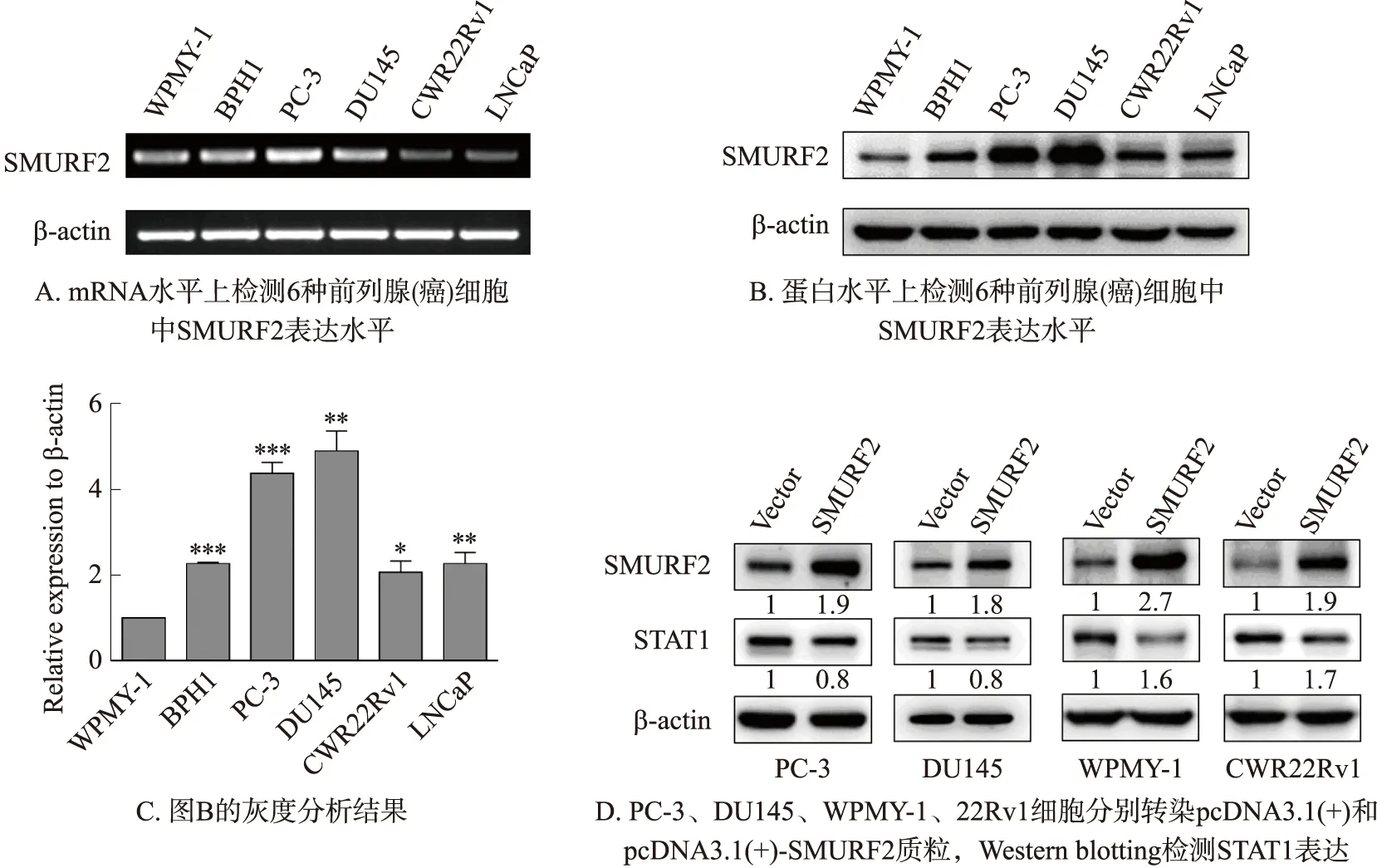
图3 SMURF2在前列腺癌细胞系中高表达Fig.3 SMURF2 expressed highly in prostate cancer cell lines
2.4 SMURF2和STAT1共定位及相互作用
为进一步探究SMURF2是否作为STAT1的E3泛素连接酶在前列腺癌细胞中发挥作用,接下来通过免疫荧光实验,如图4A所示,检测到二者在PC-3细胞核和细胞质中都有表达,并且存在共定位. 又通过在HEK293T细胞中外源过表达SMURF2和STAT1,如图4B所示,发现用FLAG的抗体可以检测到SMURF2蛋白,说明这两种蛋白能够相互作用.
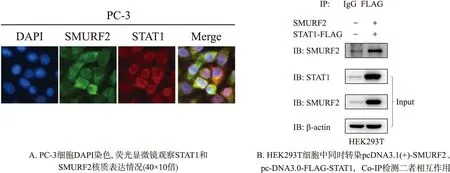
图4 SMURF2和STAT1共定位及相互作用Fig.4 The colocalization and interaction of SMURF2 and STAT1
2.5 SMURF2调节STAT1泛素化和EMT相关蛋白
SMURF2作为E3泛素连接酶,在前列腺癌细胞中可以降解STAT1蛋白,但是不影响STAT1 mRNA水平,结果如图5A所示. 于是进一步研究SMURF2对STAT1蛋白泛素化水平的影响. 通过蛋白酶体抑制剂(MG132)处理或与过表达SMURF2共处理PC-3细胞8 h,Western blotting结果如图5B所示,在MG132与过表达SMURF2共处理组中STAT1蛋白的泛素化水平要明显高于MG132单独处理组,并且检测到二者存在相互作用.
有研究报道在肺癌细胞中,IL-27激活STAT1信号通路抑制STAT3过表达,STAT1激活抑制EMT标志蛋白Slug,Vimentin,N-cadherin表达[19]. STAT1激活后进入核内,结合在Slug的启动子上,抑制Slug的表达[20]. STAT1与EMT相关,研究发现SMURF2可以降解STAT1蛋白,接着进一步检测了EMT相关蛋白(图5C),结果显示PC-3细胞中EMT标志蛋白相对于对照组,E-cadherin蛋白表达量明显降低,而 N-cadherin、Slug、Vimentin等蛋白表达量明显升高.
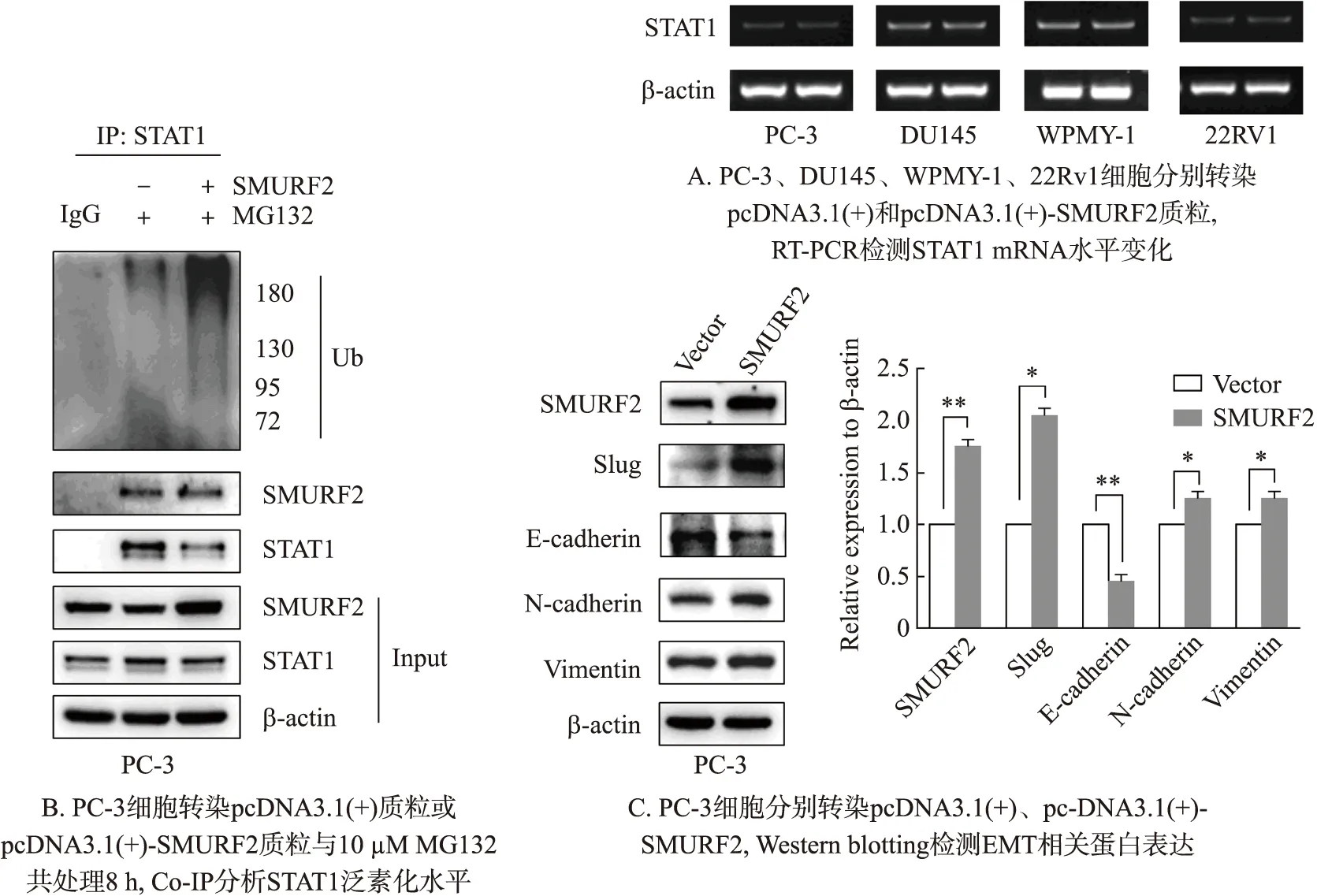
图5 SMURF2调节STAT1泛素化和EMT相关蛋白Fig.5 The regulation of SMURF2 to STAT1 ubiquitination and EMT-related proteins
3 结论
SMURF2属于HECT家族E3泛素连接酶,拥有广泛的底物,参与多条信号通路,在不同癌症中发挥不同的作用,但在前列腺癌中的功能尚不明确. 本研究通过数据库分析得知SMURF2蛋白在前列腺正常组织和前列腺癌组织中表达情况存在差异,并进一步在mRNA水平及蛋白水平证实了SMURF2在前列腺癌细胞中高表达. 通过免疫荧光实验观察到SMURF2与STAT1蛋白在前列腺癌细胞中存在共定位,又通过Co-IP实验和泛素化检测实验证明SMURF2在前列腺癌细胞中可以增强STAT1的泛素化水平从而降解STAT1蛋白. 有文献报道STAT1蛋白激活会抑制癌细胞EMT的发生,研究进一步检测了EMT相关蛋白,发现过表达SMURF2会增强前列腺癌细胞发生EMT. 但SMURF2是否作为STAT1的E3泛素连接酶在癌症中发挥作用及SMURF2对前列腺癌细胞功能的影响还需要实验进一步验证. 本研究为探究前列腺癌发生发展提供相关分子机制,同时也为前列腺癌的靶向治疗提供了相关的理论依据.
