干扰WNT5B抑制胃癌细胞的集落形成、侵袭和迁移
2021-10-21徐龙京卜爽爽牛智领
徐龙京,卜爽爽,牛智领
(1濮阳市第三人民医院医学检验科;2濮阳市人民医院,濮阳457000)
胃癌(gastric cancer,GC)是全球第5大最常见的恶性肿瘤,也是第3大致死的癌症类型[1,2]。部分早期GC患者可通过手术治愈[3]。但由于早期GC与胃炎和胃溃疡等症状相似,容易被忽视,造成绝大多数GC患者确诊时已为进展期,手术切除(甚至不可切除)辅以全身化疗成为治疗GC的主要方式,但其预后不理想,易复发[4]。因此,寻找影响GC进展的关键生物标记物对GC的治疗和预后都具有重大意义。
据报道,几乎所有的肿瘤中存在无翅型MMTV整合位点家族蛋白(wingless-type MMTV integration site family proteins,WNT)信号的激活,其在肿瘤的发生、进展和预后中均起着重要作用[5]。目前已经发现超过20个WNT家族成员,其中WNT5B是WNT5A的同源物(二者氨基酸总同源性为80.2%)[6]。已知WNT5B在胰腺癌、结直肠癌和肺癌中表达,且表达水平表达与这些癌症的恶性表型有关[7,8]。另有研究发现WNT5B在GC细胞高表达[9],但尚其在GC中的作用尚不明确。因此,本研究将重点观察WNT5B在胃癌中表达情况及其表达水平与胃癌细胞集落形成、迁移和侵袭的关系,并分析相关机制。
材料和方法
1 临床样本采集
2020年2月—8月期间,从在我院接受胃癌手术的患者的手术标本中选择4对胃肿瘤和癌旁非癌胃组织样本。本研究中有关患者样本使用的所有方案均经我院医学伦理委员会批准,所有患者均签署知情同意书。
2 细胞
人正常胃粘膜细胞株GES-1和人胃癌细胞株MGC-803、SGC-790、AGS和MKN-45均购自中国科学院上海细胞库。
3 主要试剂
DMEM培养基、胎牛血清(FBS)和1%青霉素/链霉素混合液购自美国Gibco公司;靶向WNT5B(shRNA)的2种短发夹的慢病毒载体(WNT5B-shRNA1和WNT5B-shRNA2)以及对照载体(Con-shRNA)由上海吉凯基因医学科技股份有限公司合成;NP-40裂解液、苯基甲磺酰氟(PMSF)、BCA蛋白测定试剂盒、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)和山羊抗兔IgG(H+L)以及Cy3标记山羊抗兔IgG(H+L)均购自上海碧云天生物科技有限公司;小鼠源WNT5B单克隆抗体购自美国Santa Cruz Biotechnology公司;兔源β-catenin、cyclin D1、c-Myc和GAPDH单克隆抗体购自武汉博士德生物工程有限公司;增强型ECL化学发光底物试剂盒购自万类生物科技(武汉)有限公司;山羊血清、Triton X-100和DAPI试剂购自北京索莱宝生物科技有限公司。
4 细胞培养
GES-1、MGC-803、SGC-790、AGS和MKN-45细胞分别接种于含10%FBS和1%青霉素/链霉素的DMEM培养基(Gibco,Carlsbad,CA,USA)中,在37℃、5%CO2的潮湿培养箱正常培养。
5 慢病毒载体感染
按照说明书步骤,取对数生长期的SGC-790和AGS细胞重新以3.5×104/孔的密度接种在6孔板中24h,换液继续培养至汇合度达80%时,更换含5μg/ml聚凝胺的培养基并分别添加10MOI的WNT5B-shRNA1、WNT5B-shRNA2和 Con-shRNA继续培养12h,再更换新的正常培养基继续培养4~5d,收集细胞,用蛋白质免疫印迹法检测感染效率后,用于实验。
6 蛋白质免疫印迹
在冰上用含1mmol/L PMSF的NP-40裂解液将细胞或组织匀浆30~45min后,以1.2×104r/min离心10min收集上清液。使用BCA蛋白测定试剂盒对上清液中蛋白定量后,取样品(每个样品均含40µg蛋白)行热变性(100°C煮5min)后,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离,然后将其转移到聚偏二氟乙烯膜(EDM Millipore公司,美国)上。用5%(w/v)脱脂奶(TBS-T配制)室温封闭30min后,将膜分别与WNT5B(1:2000)、β-catenin(1:400)、c-Myc(1:400)、cyclin D1(1:400)和GAPDH(1:5000)的第一抗体在4°C下孵育过夜,随后将其用TBS-T清洗2次,并分别与辣根过氧化物酶标记的山羊抗小鼠IgG(H+L)或山羊抗兔IgG(H+L)(1:5000)在37°C下孵育45min。再次用TBS-T清洗2次后,用增强型化学发光底物试剂使蛋白条带曝光并显影于胶片。将胶片扫描成电子图像后,用Image J软件定量各蛋白的光密度值。量化的目的蛋白表达水平以目的蛋白的光密度值相对于GAPDH蛋白的光密度值的百分比表示。
7 集落形成实验
分别将500个已感染WNT5B-shRNA1、WNT5B-shRNA2或Con-shRNA的SGC-790和AGS细胞接种在含2ml完全培养基的6孔培养板中。12d后,将细胞用10%(v/v)甲醛(PBS配制)固定15min,用0.1%(w/v)结晶紫溶液染色20min,PBS轻柔洗涤3遍后,将细胞培养板晾干,用数码相机拍照并对集落(肉眼可见或>50个细胞)计数。集落形成率=集落数/接种细胞数×100%。
8 划痕实验
分 别 将 5×105个 已 感 染 WNT5B-shRNA1、WNT5B-shRNA2或Con-shRNA的SGC-790和AGS细胞接种到6孔板中直至汇合。在中心区域,用200µl移液器吸头划一直线。用无血清培养基冲洗2次后,用含1%FBS的培养基培养24h。显微镜下拍摄划痕即刻(0h)和24h时的细胞划痕图。用Image J软件定量摄划痕即刻(0h)和24h时划痕间伤口距离。细胞迁移以划痕愈合率表示。划痕愈合率=[划痕间伤口距离(0h)-划痕间伤口距离(24h)]/划痕间伤口距离(0h)×100%。
9 Transwell实验
用带有8µm孔径聚碳酸酯滤膜嵌套的24孔Transwell板(Costar公司,美国)直接用于细胞迁移检测。细胞迁移实验的方法:将500µl的5×104细胞/ml密度的细胞悬浮液(无血清培养基配制)添加到Transwell小室的上腔室中,将750µl含10%FBS的培养基添加到下腔室,培养24h后,取出嵌套并除去Transwell上腔室滤膜上表面的细胞,将穿滤膜下表面的细胞用10%(v/v)甲醛(PBS配制)固定15min,用0.1%(w/v)结晶紫溶液染色20min。细胞侵袭实验的方法除了将滤膜涂覆1mg/ml基质胶(BD Biosciences公司,美国)外,其他步骤同细胞迁移实验。显微镜下拍摄5~6个随机视野图像,并计数每个视野下细胞数目,取平均值表示每次独立实验的细胞迁移数或侵袭数。细胞相对迁移或侵袭率=WNT5B-shRNA细胞迁移或侵袭数目/Con-shRNA细胞迁移或侵袭数目×100%。
10 免疫荧光
将已感染WNT5B-shRNA1、WNT5B-shRNA2或Con-shRNA的SGC-790和AGS细胞接种到盖玻片上,细胞贴壁后,用4%多聚甲醛固定15min。0.5%(v/v)Triton X-100(PBS配制)处理细胞10min,并在室温下用山羊血清封闭15min。随后,将细胞与β-catenin初级抗体(1:200)在4°C下孵育过夜。用PBS洗涤2次后,将细胞与Cy3标记山羊抗兔IgG(H+L)(1:200)在室温下避光孵育1h。用PBS再次洗涤2次后,将细胞用DAPI复染,在BX53荧光显微镜(Olympus公司,日本)20×物镜下观察并拍照。
11 统计学分析
数据表示为平均值±标准差(),并用SPSS 19软件进行统计学分析。两组均数比较用t检验;多于俩组数据的均数的两两比较用单因素方差分析事后LSD检验。P<0.05则认为差异具有统计学意义。
结 果
1 WNT5B在胃癌组织和胃癌细胞中高表达
为了探索WNT5B在胃癌中的作用,我们首先采用蛋白质免疫印迹法检测了胃肿瘤组织和癌旁非肿瘤胃组织中WNT5B表达水平,与癌旁非肿瘤胃组织比较,胃肿瘤组织中WNT5B表达水平明显升高(图1A)。进一步检测人正常胃粘膜细胞株GES-1和人胃癌细胞株MGC-803、SGC-790、AGS和MKN-45中WNT5B表达水平显示:与GES-1细胞比较,MGC-803、SGC-790、AGS和MKN-45细胞中WNT5B表达水平均明显升高(图1B)。
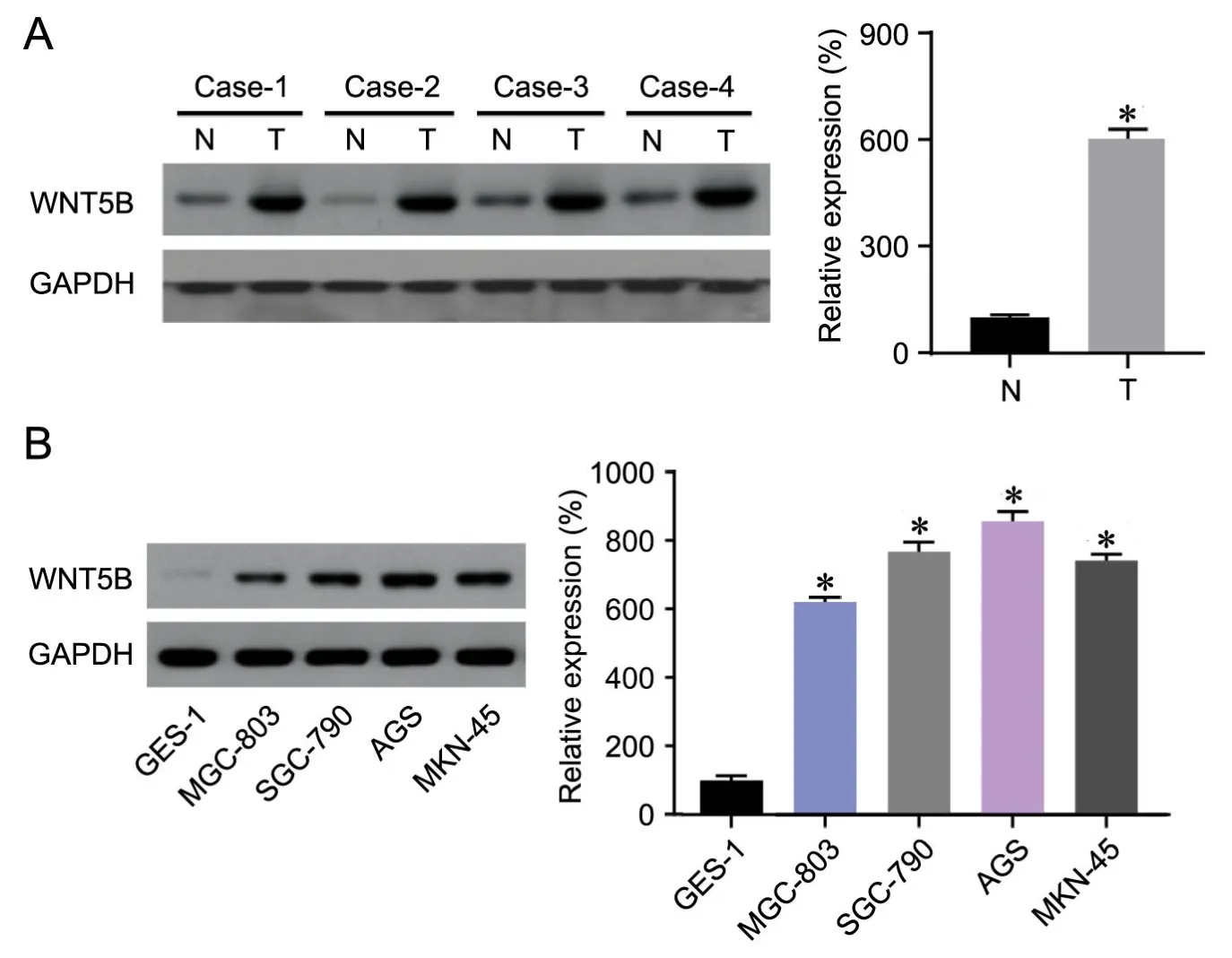
图1 胃部组织和细胞系中WNT5B水平比较。A,正常胃组织和胃肿瘤组织中WNT5B水平的Western blot检测;N,癌旁非肿瘤组织;T,胃肿瘤组织。B,人胃粘膜细胞(GES-1)和胃癌细胞(MGC-803、SGC-790、AGS和MKN-45)中WNT5B水平的Western blot检测。与正常胃组织(A)或正常人胃粘膜细胞(B)比较:***P<0.001; n=4(A)或8(B)Fig. 1 Comparison of WNT5B level in gastric tissues and cell lines. A, Western blot detection of WNT5B expression level in adjacent normal gastric tissues and gastric tumor tissues; N, adjacent normal gastric tissues; T, gastric tumor tissues. B, Western blot detection of WNT5B expression level in human gastric mucosal cells (GES-1) and gastric cancer cells (MGC-803, SGC-790, AGS and MKN-45). Compared with normal gastric tissues (A) or GES-1 cells (B): *P<0.001; n=4 (A) or 8(B)
2 干扰WNT5B可抑制胃癌细胞的集落形成、迁移和侵袭
为评估WNT5B在胃癌发生过程中的作用,我们采用shRNA法干扰WNT5B表达(图2A)后,分析了胃癌细胞增值、迁移和侵袭水平的变化。结果显示,干扰WNT5B可以明显降低胃癌细胞的集落形成率(图2B)并抑制迁移和侵袭(图3)。
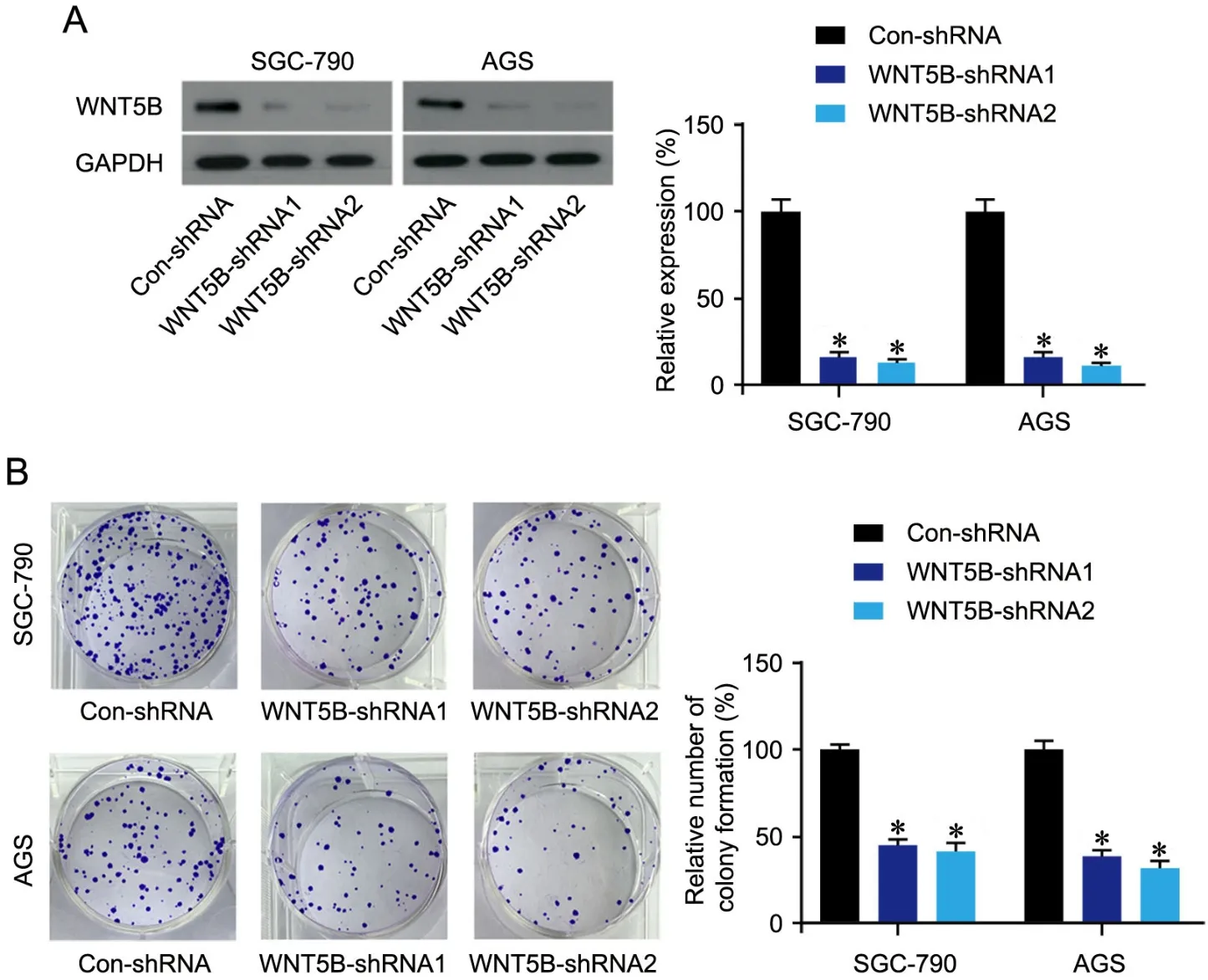
图2 干扰WNT5B对胃癌细胞增殖的影响。A,蛋白质免疫印迹法检测干扰WNT5B后WNT5B蛋白表达水平。B,集落形成实验检测干扰WNT5B后胃癌细胞的增殖能力。与Con-shRNA组相比:*P<0.001;n=8Fig. 2 Effect of WNT5B interference on the proliferation of gastric cancer cells. A, Western blot detection of WNT5B protein level after interfering with its expression. B, colony formation assay for the proliferation level of gastric cancer cells after WNT5B interference. Compared with the Con-shRNA group: *P<0.001; n=8
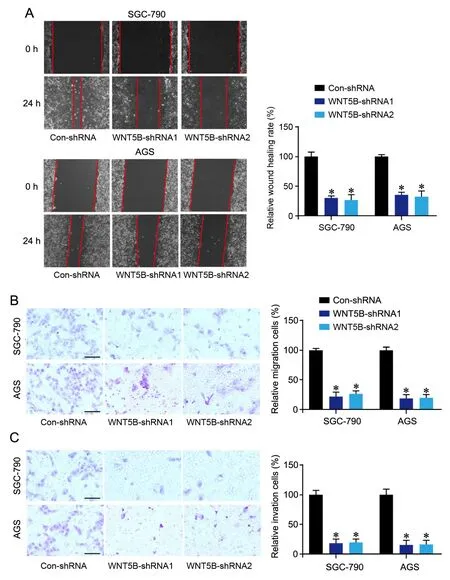
图3 干扰WNT5B对胃癌细胞迁移和侵袭的影响。A,划痕实验检测SGC-790和AGS细胞的迁移。B,Transwell实验检测SGC-790和AGS细胞的迁移。C,Transwell实验检测SGC-790和AGS细胞的侵袭。比例尺,50μm。与Con-shRNA组相比:*P<0.001;n=4Fig. 3 Effect of WNT5B interference on the migration and invasion of gastric cancer cells. A, scratch assay for the migration of SGC-790 and AGS cells. B, Transwell assay for the migration of SGC-790 and AGS cells; C, Transwell assay for the invasion of SGC-790 and AGS cells. Scale bar, 50μm.Compared with the Con-shRNA group: *P<0.001; n=4
3 干扰WNT5B降低胃癌细胞中β-catenin、c-Myc和cyclin D1水平
为了明确干扰WNT5B抑制胃癌细胞增殖、迁移和侵袭的分子机制,对β-catenin信号通路蛋白水平进行了检测。免疫荧光检测显示,与相比,干扰WNT5B后的细胞中WNT5B免疫反应性较Con-shRNA组明显减弱(图4A);蛋白质免疫印迹法检测显示,干扰WNT5B后的细胞中β-catenin、c-Myc和cyclin D1水平均较Con-shRNA组明显降低(图4B—E)。以上结果表明,干扰WNT5B可抑制胃癌细胞中β-catenin信号活性。
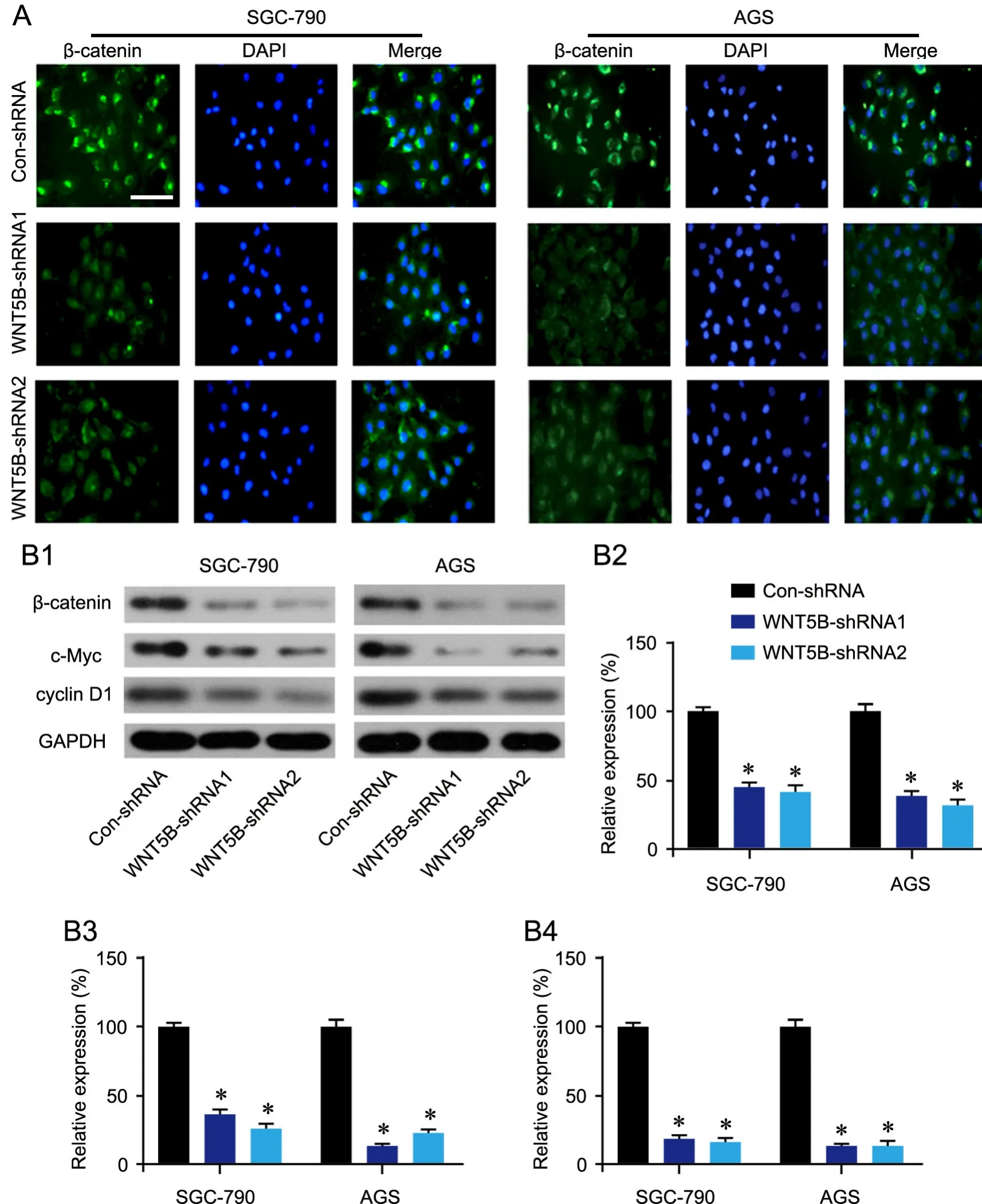
图4 干扰WNT5B对胃癌细胞中β-catenin信号活性的影响。A,干扰WNT5B对胃癌细胞β-catenin影响的免疫荧光检测;比例尺,20μm。B,干扰WNT5B对胃癌细胞β-catenin、c-Myc和cyclin D1影响的Western blot检测及统计学分析;B1,代表性Western blot检测结果;B2,cyclin D1水平统计学分析;B3,c-Myc水平统计学分析;B4,β-catenin水平统计学分析;与Con-shRNA组相比:*P<0.001(n=8)Fig. 4 Effect of WNT5B interference on the β-catenin signaling activity in gastric cancer cells. A, immunofluorescence assay for the effect of WNT5B interference on the β-catenin expression in gastric cancer cells; scale bar, 20μm. B, Western blot detection for the effect of WNT5B interference on the level of β-catenin, c-Myc and cyclin D1 in gastric cancer cells; B1, representative Western blot results; B2, statistical analysis of cyclin D1 level; B3,statistical analysis of c-Myc level; B4, statistical analysis of β-catenin level; compared with the Con-shRNA group: *P<0.001 (n=8)
讨 论
目前GC的治疗效果并不令人满意[4],而筛选影响GC进展的关键标记物可能会为未来对GC治疗措施的制定提供理论支持[10]。WNT5B作为WNT家族的成员之一,其已被发现可促进胰腺癌、结直肠癌和肺癌等多种肿瘤细胞的增殖和迁移[7,8],敲除WNT5B可抑制三阴乳腺癌细胞的细胞生长和迁移[11],说明WNT5B可作为多种肿瘤的促癌进展因子。另外,已有文献报道WNT5B在胃癌MKN-45细胞中高表达[9],提示WNT5B在胃癌中可能也发挥重要作用。本研究证实了胃癌组织中WNT5B表达高于正常胃组织,胃癌细胞株中WNT5B表达高于正常胃粘膜细胞株。随后发现,干扰WNT5B可抑制胃癌细胞的集落形成、迁移和侵袭,提示靶向干扰WNT5B可能是GC潜在的治疗措施之一。
大量研究[5,7,8,11]表明,在绝大多数肿瘤细胞中均存在WNT信号的持续活化,且降低WNT信号活性能导致肿瘤细胞增殖、迁移和侵袭能力降低和凋亡增加。β-catenin作为WNT信号下游最重要的功能分子,其在肿瘤的发生和发展中起着重要作用[5]。有研究[5,12-15]表明,抑制β-catenin能导致甲状腺乳头状癌、结直肠癌、肺癌和乳腺癌等多种肿瘤细胞的生长和迁移受到抑制,表明β-catenin是肿瘤细胞生长所必需的关键蛋白。细胞浆中持续积累的β-catenin转位至细胞核被认为是β-catenin信号通路被激活的标志[5]。细胞核中β-catenin能与T细胞因子(T cell factor,TCF)/淋巴增强因子(lymphoid enhancer factor,LEF)结合,进而激活cyclin D1和c-Myc等原癌基因导致肿瘤细胞的增殖、细胞周期进程、迁移和侵袭[15,16]。比较直接的证据[17,18]显示,抑制β-catenin核转位和表达能降低GC细胞的增殖和迁移。本研究显示,干扰WNT5B不仅能降低GC细胞的细胞核中β-catenin表达量还能抑制总β-catenin以及β-catenin信号下游cyclin D1和c-Myc的表达,提示干扰WNT5B导致的GC细胞中β-catenin信号通路转导抑制可能是其抑制集落形成、迁移与侵袭的重要原因,但干扰WNT5B通过β-catenin信号通路抗GC的具有机制仍需进一步的详细工作来阐明。另外,干扰WNT5B是否通过其他信号通路能发挥抑制GC细胞集落形成、迁移与侵袭的作用也有待进一步研究。
