直接或间接靶向YAP/TAZ治疗头颈部肿瘤的策略选择
2021-10-21冯晓东
冯晓东
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心 中国医学科学院口腔癌变与防治创新单元 四川大学华西口腔医院,成都610041
YAP/TAZ发现于20世纪90年代[1],在哺乳动物的正常生理作用中非常重要,其主要作用包括:调控细胞增殖和生存、维持组织成体干细胞的自我更新、参与器官发育、组织大小调节、组织再生等[2]。Hippo信号通路为常见的YAP/TAZ上游信号通路,其最早在对果蝇中进行的抑癌基因筛查时被发现。随后该信号通路的4个最核心的组成蛋白先后被揭示,包括Warts[哺乳动物同源蛋白:大肿瘤抑制酶1/2(large tumor suppressor kinase 1/2,LATS1/2)[3-4]]、Salvador(Sav1/WW45)[5-6]、Hippo[(巨噬细胞刺激响应蛋白1/2(macrophage stimu‐lating 1/2,MST1/2)][7-11]及Mats(MOBKL-1A-B)[12]。其中Hippo/Salvador形成复合物可以磷酸化并激活Warts-Mats复合物,Warts直接作用于Yki(YAP/TAZ)[13]并对其磷酸化进而抑制其发挥转录因子辅助激活功能。Hippo信号通路任意一个核心组分的缺失或Yki过度表达,都会导致器官的急剧过度增长,Yki下游主要通过辅助激活转录因子调控细胞增殖和生存[13]。在哺乳动物中,Hippo信号通路的MST1/2-Sav复合物磷酸化激活LATS1/2-MOB复合物,LATS1/2通过直接磷酸化YAP/TAZ,发挥对其转录辅助激活功能的抑制作用[13]。除传统的Hippo信号通路调节YAP/TAZ活性以外,大量研究还揭示了不依赖于Hippo信号的YAP/TAZ调控机制,其中最主要的包括细胞骨架动态变化调节机制[14-16]。
YAP具有转化细胞的能力[17],随着对YAP/TAZ相关科学研究的深入,各大肿瘤组学计划及Omics肿瘤组学分析的推进,YAP/TAZ在肿瘤中的普遍重要性也得以体现[18-19],其在肿瘤启始、发展、维持、复发及耐药方面都存在重要作用,因此,靶向YAP/TAZ对肿瘤治疗具有重大潜能[18-19]。新近研究[20-21]提示,在头颈肿瘤中YAP/TAZ存在普遍激活的情况,且在头颈肿瘤生长中起着重要的调节作用,故YAP/TAZ在头颈肿瘤中存在重要的靶向潜能。本文将主要针对直接或间接靶向YAP/TAZ策略的尝试进行总结,结合头颈部肿瘤分析各策略的优劣,并就此提出该方面未来研究的潜在突破方向。
1 直接靶向YAP/TAZ
新近研究发现在头颈部肿瘤中,YAP/TAZ存在普遍激活(约80%)[20-21],YAP对上皮细胞及口腔黏膜上皮的转化及致癌能力已被证实[22-23],且YAP/TAZ在肿瘤中作为治疗靶点的潜能也较确定[16,20,24-25]。YAP/TAZ作为转录辅助因子,主要通过下游对转录因子的激活来发挥其生理和病理作用[2],其下游调控的转录因子家族主要包括:TEA结构域转录因子1-4(TEA domain transcription fac‐tor 1-4,TEAD1-4)、母亲DPP同源物(mothers against decapentaplegic homolog,SMAD)、Runt相关转录因子(Runt-related transcription factors,RUNX)、肿瘤蛋白P73(tumor protein P73,TP-73)、T-Box转录因子5(T-Box transcription factor 5,TBX5)和配对盒转录因子(paired box,PAX)等[26]。在众多YAP/TAZ结合并调控的转录因子家族中,TEAD家族被认为在生理及病理条件下的作用最为重要[26-27],由此发展出一系列的直接靶向YAP/TAZ-TEAD的潜在靶向抑制策略(表1)[16,33-46]。直接靶向YAP/TAZ-TEAD相互作用的药物,如:“维替泊芬”或“C3”等,这些药物普遍存在问题是,毒副作用大且脱靶效应明显[28-29];“环状YAP样肽”或“super-TDU”等又因为分子较大限制了其给药途径,且毒副作用也暂不明确[30-32];直接靶向TEAD家族转录因子,如:“WO2017/053706”和“氟灭酸及其衍生物”等,部分药物相对安全成熟,如:“氟灭酸”,但是在这一类药物具体作用效果及机制不清楚,仍需进一步研究。此外,Hippo通路对YAP/TAZ的调节为抑制调控,其在肿瘤中的作用主要为肿瘤抑制[13],Hippo通路自身作为药物靶点存在策略不可行性。
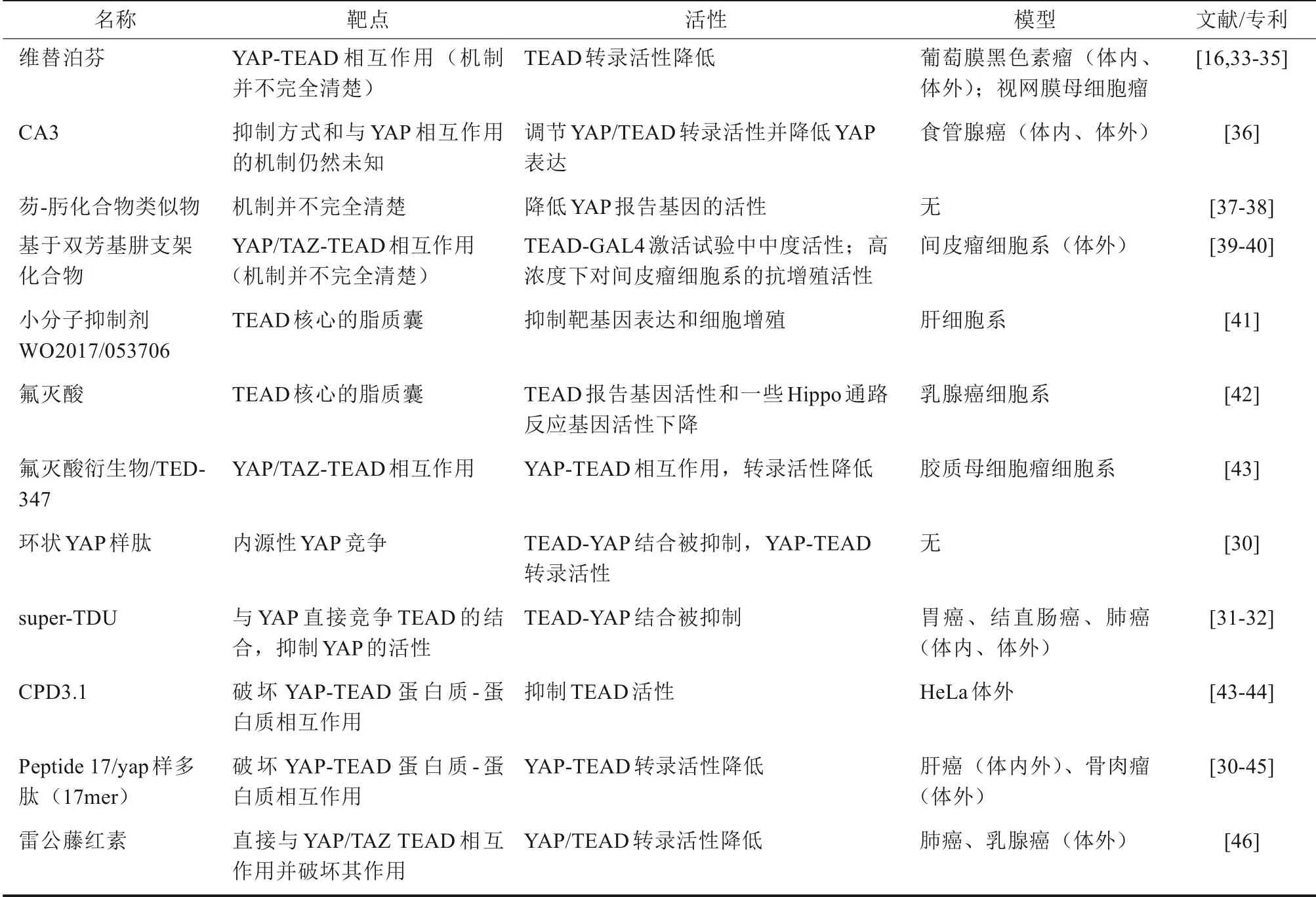
表1 直接靶向YAP/TAZ-TEAD的抑制剂及靶点Tab 1 The inhibitors targeting YAP/TAZ-TEAD
2 间接靶向YAP/TAZ
直接靶向YAP/TAZ-TEAD已发现多种潜在药物,但是这些药物都还停滞在临床前研究阶段,大多存在靶点不清,机制不明,或全身毒副作用等问题[47]。另一方面,YAP/TAZ在干细胞调控及组织再生中具有重要作用[2],直接靶向YAP/TAZ或YAP/TAZ-转录因子相互作用存在显著的体内干细胞影响潜能,故存在较大的策略局限性;与之相对的是,YAP/TAZ在肿瘤中的异常分子事件非常有限[18],其在头颈肿瘤中的异常活化绝大部分源于潜在的上游异常分子事件,故通过靶向YAP/TAZ异常激活机制来间接靶向YAP/TAZ,更具策略优势。与此同时,通过研究YAP/TAZ异常激活机制所暴露的药物作用靶点范围更广,更有可能对应相对成熟的药物,且更具肿瘤特异性,转化可行性优势显著。
已有研究提示,YAP/TAZ可以通过Hippo依赖和Hippo不依赖两种途径进行信号传递[19]。调节YAP/TAZ的胞外信号来源包括:细胞生长因子、细胞压力诱导、细胞接触抑制及细胞骨架支撑调节等[2]。在头颈肿瘤中,已知的具有潜能调节YAP/TAZ激活的异常分子事件包括:G蛋白偶联受体39(G protein-coupled receptor 39,GPR39)、磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基α(phos‐phatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit alpha,PI K3 C A)、表皮生长因子受体(epi‐dermal growth factor receptor,E G FR)、FAT非典型钙粘蛋白1(FAT atypical cadherin 1,FAT1)等[20-21,48-49](图1)。

图1 头颈肿瘤队列中具有潜能调节YAP/TAZ激活的异常分子事件及其发生频率(TCGA数据库,头颈鳞癌PanCancer Atlas队列;mRNA表达水平相较于正常组织)Fig 1 The genes alteration frequencies with YAP/TAZ regulation potentials(TCGA,Head and Neck Squamous Cell Carcinoma-PanCancer Atlas;mRNA expression level compared with normal samples)
笔者将对已知的这些基因驱使YAP/TAZ的潜在调节机制及靶向潜能及研究方向作逐一讨论总结。
2.1 G PR39
G蛋白偶联受体(G protein-coupled receptor,GPCR)为细胞表面最大的受体家族(约800种)[50],对YAP/TAZ具有广泛调节作用[51]。GPCR在肿瘤中的异常分子事件普遍存在,但是由于其种类繁杂且异常分子事件类型多样[52],其在肿瘤异常分子事件中的关注程度并不高。随着测序技术的进步,更多的GPCR肿瘤异常分子事件被发现,其中也包括了GP R39在口腔癌中的过度表达[21,53]。新近研究[21]发现,G PR39主要依赖Gαq-RhoA(ROCK)-FAK信号通路激活YAP,而G P R39自身表达量可以反应其对YAP异常激活的贡献程度(图2)。该信号通路的解析也为进一步探究潜在治疗靶点提供了理论依据,其中ROCK作为GP R39激活YAP的重要节点蛋白[21],已有多种靶向ROCK的药物在临床使用多年,如Fasudil和Ri‐pasudil,其作为用药靶点具有极高的用药可行性;另外,FAK作为G P R39激活YAP的另外一个重要节点蛋白[21,54],其在癌症中的重要作用也比较明确[55],针对FAK的肿瘤治疗探索也较多(如:卵巢癌和胶质瘤等),新近FAK抑制剂已在临床试验中展现出了较好的用药安全性[56-58],提示FAK抑制剂具有较好的转化潜能。
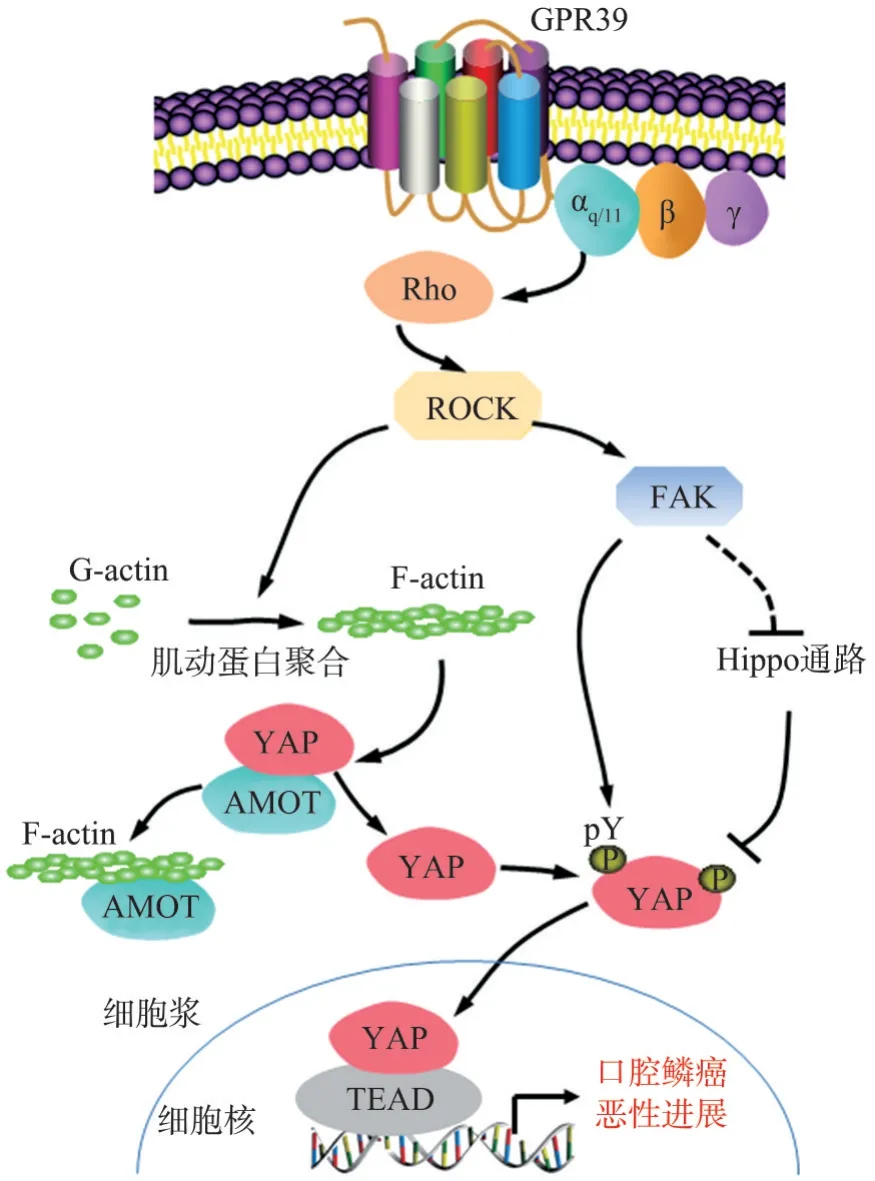
图2 GPR39在口腔癌中调节YAP激活的信号传导机制示意图Fig 2 GPR39 regulates YAP activation signaling network in oral squamous cell carcinoma
2.2 P IK3 C A
P IK3 C A是头颈部肿瘤中最重要的癌基因,其编码蛋白PI3Kα[59-60],其在约30%的头颈部肿瘤中存在获得性异常分子事件(图3)。PI3Kα下游已知信号主要包括PDK1-AKT-mTOR通路,调节细胞增殖和生存进而促进肿瘤发生发展[61]。有趣的是,新近研究[48]发现在头颈部鳞状细胞癌中PI3Kα的过度表达和YAP的异常激活存在较紧密的相关性,但是PI3Kα激活YAP/TAZ的功能并不明确,机制也不清楚,故不存在间接靶向选择依据,需从分子机制层面进行深入研究。
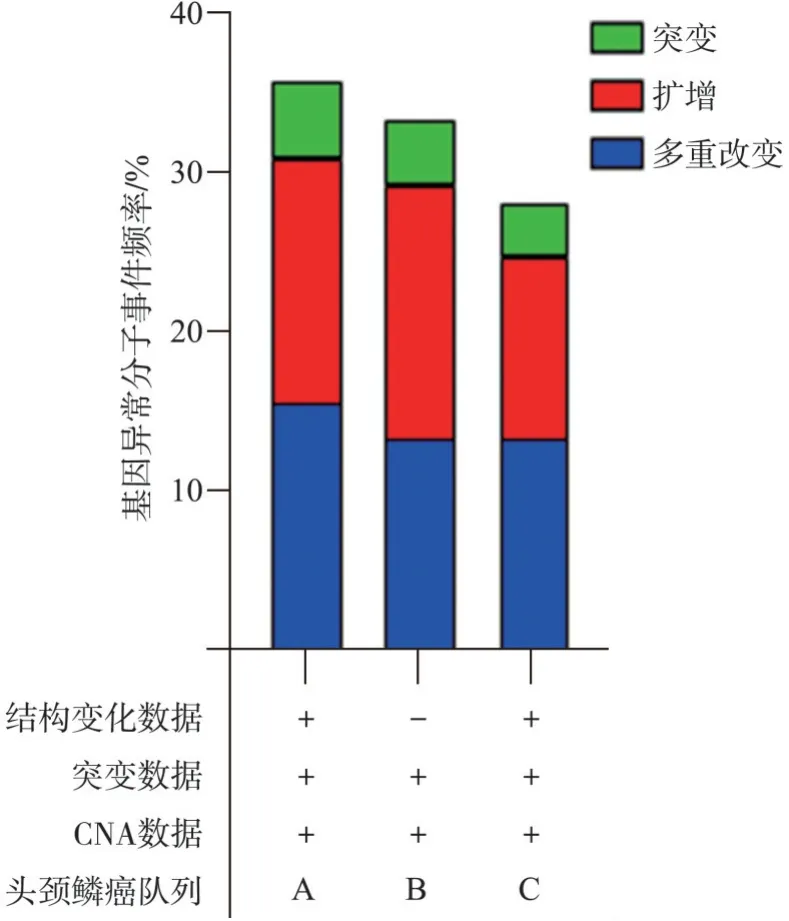
图3 PIK3CA在TCGA-头颈部肿瘤队列中异常分子事件频率(头颈部肿瘤队列包括:A.Nature 2015;B.Firehose Legacy;C.PanCancer Altlas)Fig 3 PIK3CA gene alteration frequencies in TCGA-head and neck cancer cohorts(including,A.Nature 2015;B.Fire‐hose Legacy;C.PanCancer Altlas)
2.3 EG FR
EG FR为头颈部肿瘤里面最重要的异常激活分子[59-62],其主要通过PI3K-AKT-mTOR和MEKERK信号通路调节肿瘤细胞增殖和生存[62]。以往报道[49]显示,EG F R可以在人类乳腺上皮细胞(MCF-10A)和人类胚胎肾细胞(HEK293)中通过PI3K-PDK1依赖的途径抑制Hippo信号进而促进YAP的激活,提示E GFR具有在头颈肿瘤中激活YAP/TAZ的潜能,但是在头颈部肿瘤中的相关功能和机制仍未见报道,故无靶点选择依据。此外,EG F R作为受体络氨酸激酶家族的重要成员,其是否通过络氨酸激酶活性直接作用于Hippo-YAP/TAZ通路也是一个亟待阐明的重要科学问题。针对以上未知问题的深入研究,可为头颈部肿瘤靶向YAP/TAZ治疗提供重要理论依据。
2.4 FAT1
FAT1失活(主要是:拷贝数减少或失活突变)是头颈部肿瘤中较为常见的异常分子事件[20,59-60]。2018年Martin等[20]发现,FAT1在头颈肿瘤中的失活降低了其对Hippo信号通路的激活作用,并导致YAP的异常激活,进而调控头颈肿瘤的恶性生长。FAT1为抑癌基因,其在头颈部肿瘤中激活YAP/TAZ的机制是通过失活Hippo信号通路来实现的,但是由于失活突变导致的是一系列的活性丧失级联反应,故间接靶向抑制的可行性不大。
3 未来研究方向
虽然YAP/TAZ在头颈肿瘤中存在广泛且普遍的激活,在肿瘤生长调节方面具有重要意义,其存在巨大的治疗靶点潜能[19-20],但是由于技术发展的局限性及YAP/TAZ自身调控多种干细胞活性及组织再生的能力,导致直接靶向YAP/TAZ治疗肿瘤存在较大的策略局限性。另一方面,间接靶向YAP/TAZ旨在靶向肿瘤细胞中异常调节YAP/TAZ激活的信号途径,理论上损害正常细胞对YAP/TAZ功能需求的影响较小,故在策略上其具有更好的精准性。而目前间接靶向YAP/TAZ可用靶点和靶点选择依据还不清楚,主要源于YAP/TAZ在肿瘤中的异常调节具体机制还不够清楚。在头颈部肿瘤中,间接靶向YAP/TAZ的研究需进一步从以下几个方面开展研究工作。
1)系统性地分析头颈肿瘤中可以激活YAP/TAZ的异常分子事件。虽然已经知道多种异常分子事件(包括:癌基因或抑癌基因),如:P I K-3 C A、EG F R、G P R39、FAT1等在头颈肿瘤中具有激活YAP/TAZ的潜能[20-21,48-49],但是依然有大量的YAP/TAZ在肿瘤中的异常激活没有得到合理的解释;同时也有大量的异常分子事件对YAP/TAZ的贡献未知。因此需要更为全面地、系统地筛查肿瘤异常分子事件、肿瘤微环境,乃至瘤内应力等,对YAP/TAZ激活的影响。
2)详细解析各事件调节YAP/TAZ激活的分子信号网络。发现具有YAP/TAZ激活潜能的事件往往不足以暴露有效的肿瘤治疗靶点,还需对其信号调节网络作出详细的解析,进一步暴露“可用药”信号节点。因此需要对已知的具有YAP/TAZ激活潜能的事件的调节机制进行系统地、详细地机制解析。
3)依据分子网络研究结果选择治疗靶点及药物进行治疗探索。在肿瘤中YAP/TAZ调节信号网络得以解析的基础上,依据不同的异常分子事件选择具有针对性的YAP/TAZ抑制靶点,并用药进行治疗测试,并最终验证该靶点对该类分子事件参与肿瘤治疗的可行性。
4)筛选靶点和用药对应的生物标记物协助肿瘤精准治疗。在明确治疗靶点疗效及可行性的情况下,如何去判定哪些肿瘤适合该治疗方案?探寻该治疗方案对应有效肿瘤的判定生物标记物对于该治疗方案的转化就变得尤为重要,而找到一个准确且易于操作的生物标记物检测手段会大大提高治疗的精准性。
总之,通过YAP/TAZ调节事件系统性筛查、信号网络解析、药物靶点测试及治疗策略生物标记物验证4个步骤,可为间接靶向YAP/TAZ治疗头颈部肿瘤提供更系统详尽的理论依据,助力靶点选择和对应生物标志物的开发,并最终推进靶向YAP/TAZ头颈肿瘤精准治疗(图4)。
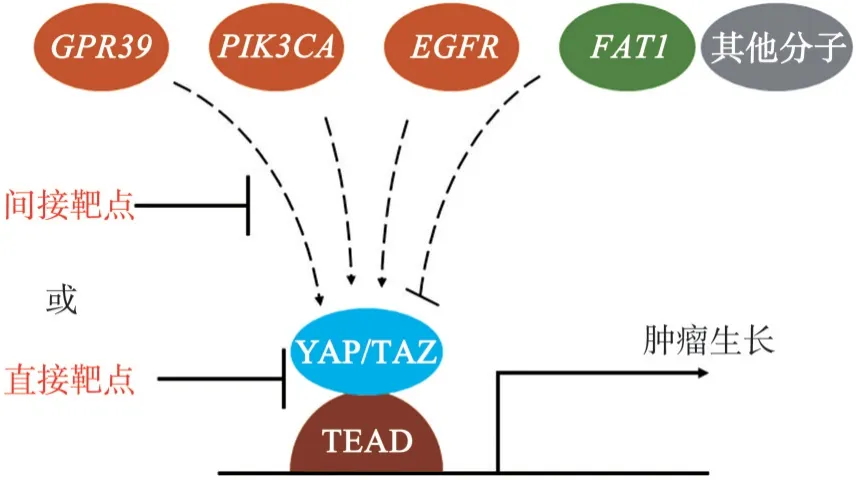
图4 具有YAP/TAZ调节功能的肿瘤异常分子事件及其下游调节机制的解析可以为靶向YAP/TAZ预防或治疗头颈部肿瘤的策略选择提供理论支持Fig 4 Genetic alterations driven-YAP/TAZ and related mechanism could guild targeting-YAP/TAZ therapies for head and neck cancer preventions and treatments
致谢:感谢四川大学华西口腔医学院博士研究生侯菲菲协助资料整理与编辑校对。
利益冲突声明:作者声明本文无利益冲突。
