不同辐照仪对大鼠下颌骨放射性颌骨坏死模型建立的影响
2021-10-21陈滑维张圣福何海涛
陈滑维 张圣福 何海涛
陆军军医大学大坪医院口腔科,重庆400042
随着放疗在头颈癌的应用日趋普及,放射性颌骨坏死(osteoradionecrosis of jaw,ORNJ)逐渐增多,发病率可高达35%[1],临床表现为疼痛、张口受限、咀嚼或言语障碍、难治性瘘道形成,甚至病理性骨折。ORNJ的发病机制不清,防治困难[2-5]。发病机制相关学说主要有:放射-创伤-感染学说、低氧低血供低细胞学说、纤维性变学说[6-8],各学说既相互补充又相互矛盾。这可能与目前尚无成熟、统一的ORNJ动物模型建立方法有关,辐照仪器、照射能量、剂量率不同,照射方法及剂量选择差异等,都不可避免地会影响实验结果。现有ORNJ动物模型建立使用的辐照仪主要有内照射器、直线加速器和小动物辐照仪等[9-11],但不同辐照仪对ORNJ建模的影响鲜见报道。本研究比较直线加速器和小动物辐照仪在不同剂量下对ORNJ建模的影响,探索理想的ORNJ建模方法。
1 材料和方法
1.1 实验动物及分组
由陆军军医大学大坪医院实验动物中心[许可证号SCXK(渝)2017-0006]提供SPF级成年雄性SD大鼠33只,鼠龄12周,体重250 g±20 g,于独立通风笼盒标准实验动物房饲养,自由进食水。适应性喂养1周后,将SD大鼠随机分为CN组(空白对照组,3只)、A组(15只)和B组(15只)。A、B组又各随机分为3个小组:A35、A40、A45组和B35、B40、B45组,每组各5只大鼠。
1.2 辐照
用1%戊巴比妥钠溶液腹腔注射(5 mL·kg-1)麻醉,大鼠右侧卧位固定,铅板遮挡保护,暴露左侧下颌骨磨牙区约2 cm×2 cm照射范围。
CN组只麻醉无照射。A组用直线加速器辐照仪(Elekta Synergy,Elekta公司,瑞典)照射,能量类型X-Ray,能量8 MV,剂量率600 MU·min-1,照射方式为体外照射。B组采用小动物辐照仪(RS-2000,Rad Source公司,美国)照射,能量类型X-Ray,能量160 kV,剂量率1.265 Gy·min-1,照射方式为体外照射。A35/B35、A40/B40、A45/B45组分别接受35、40、45 Gy的照射总剂量,以每天7、8、9 Gy连续5 d分割照射的方法照射。
1.3 照射区拔牙
照射结束后1周,观察照射区域黏膜损伤情况,并由同一术者拔除所有大鼠左侧下颌骨照射区中的3颗磨牙,形成拔牙创伤。
1.4 大体观察及取材
每周观察大鼠照射局部及全身情况、门齿咬合关系、记录体重。拔牙后3周安乐处死所有大鼠,获取左侧下颌骨标本,观察拔牙创牙龈和牙槽窝愈合情况,固定于4%多聚甲醛。
1.5 micro-CT扫描及重建
采用micro-CT(μCT 100,SCANCO公司,美国)扫描,扫描参数:70 kV,114μA,20μm分辨率,20μm层距。采用Inveon Research Workplace软件三维重建,对照射区域牙槽骨及间隔骨质进行分析,感兴趣区域选定为下颌磨牙拔牙创区域。
1.6 组织病理学观察
扫描后的标本经脱水、包埋、切片后行苏木精-伊红(hemotoxylin and eosin,HE)染色。显微镜下观察,在400倍下每个样本选择6张镜下照片,由3个观察者进行空白骨陷窝及骨陷窝内骨细胞计数,评估下颌骨损伤情况,空白骨陷窝率(%)=空白骨陷窝数量/骨组织细胞总数×100%,骨细胞率(%)=骨细胞数/骨组织细胞总数×100%。
1.7 建模成功评估
根据ORNJ的评定标准(辐射史,骨暴露,放射性骨破坏证据,无肿瘤复发,病理可见死骨形成[12-13]),评估模型建立是否成功,并计算各组建模成功率,建模成功率(%)=每组大鼠建模成功数量(只)/每组大鼠总数(只)×100%。
1.8 统计分析
采用SPSS 21.0软件进行统计学分析,组间比较采用完全随机单因素方差分析。
2 结果
2.1 大体表现
照射后1周,A、B组大鼠局部皮肤均出现红肿、脱毛,口腔黏膜溃烂(图1),A组照射区变化不显著,主要累及颈前区域,B组累及照射区域;与B组相比,A组大鼠精神状态、全身情况更差,全身毛发更粗糙,体重下降更明显。

图1 大鼠照射后1周大体观察情况Fig 1 Macroscopic change of rat after 1 week radiation
拔牙后3周,3组大鼠体重均逐渐增加,增幅A组<B组<CN组(表1);A45组颈前区域、B组照射区毛发稀疏、脱落,B45组可见皮肤破溃;A组双侧下颌骨生长受抑制,B组左侧下颌骨受抑制,B40组见严重的咬合错乱(图2);CN组、A35、A40组大鼠拔牙创牙龈愈合,A45、B组拔牙创未愈合、明显骨外露(图3)。

图3 拔牙后3周拔牙创愈合情况Fig 3 Healing of extraction wound 3 weeks after tooth extraction
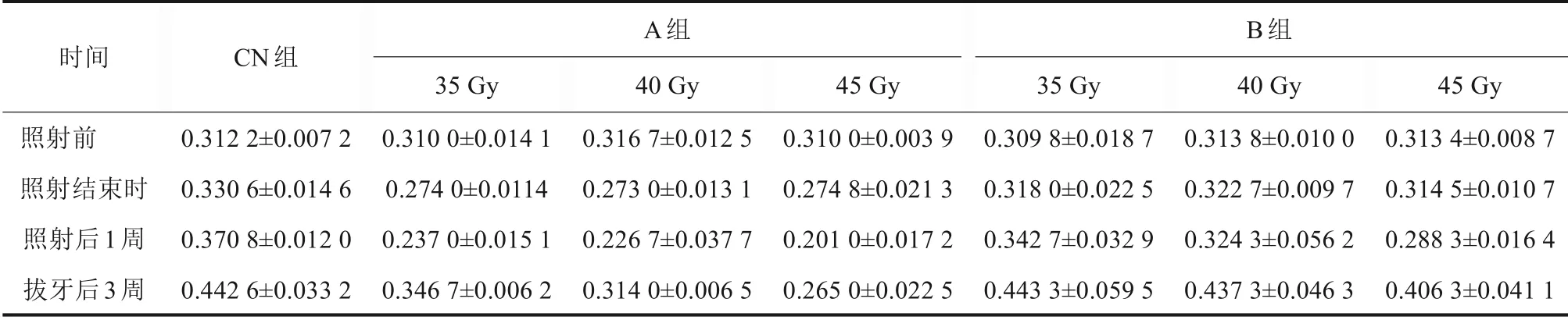
表1 各组大鼠不同时间的体重Tab 1 The weight in different radiation times of rat in every group kg
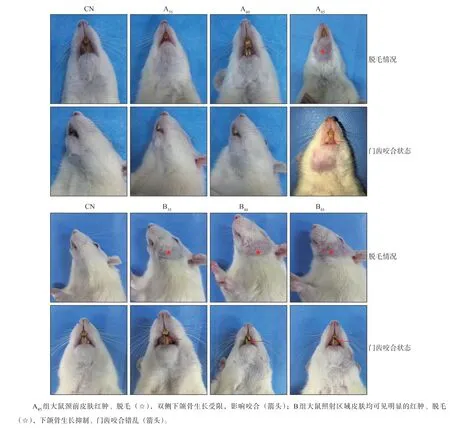
图2 大鼠拔牙后3周大体表现Fig 2 Macroscopic change of rat 3 weeks after tooth extraction
2.2 micro-CT分析
micro-CT分析结果显示,与CN组相比,A35组照射区牙槽骨及间隔骨质轻度缺损,A40、A45、B组照射区牙槽骨骨质缺损、破坏明显,皮质骨骨量减少(图4)。
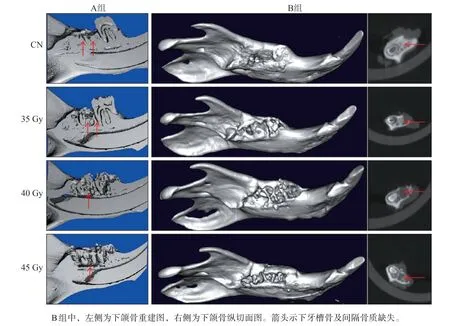
图4 拔牙区micro-CT影像学改变Fig 4 Micro-CT image change of the extraction area 3 weeks after tooth extraction
2.3 组织病理学观察
HE染色显示,随照射剂量增加,A、B组大鼠下颌骨骨细胞、血管数量均减少,血管腔闭塞,残留骨周围破骨细胞数量增加,髓腔形态消失,大量炎症细胞浸润、纤维组织增生(图5)。与CN组相比,A、B组空白骨陷窝率均增加(P<0.05)。A组各亚组间均存在统计学差异(P<0.05),A35组无死骨形成,A40、A45组可见明显死骨。B组各亚组均可见明显死骨形成,B35与B40、B45组间存在统计学差异,B40与B45组间无统计学差异。A35与B35、A40与B40组间骨细胞率、空白骨陷窝率具有统计学差异(图6)。

图5 照射后各组皮质骨及髓腔变化 HE ×100Fig 5 Changes of cortical bone and medullary cavity in each group after irradiation HE ×100
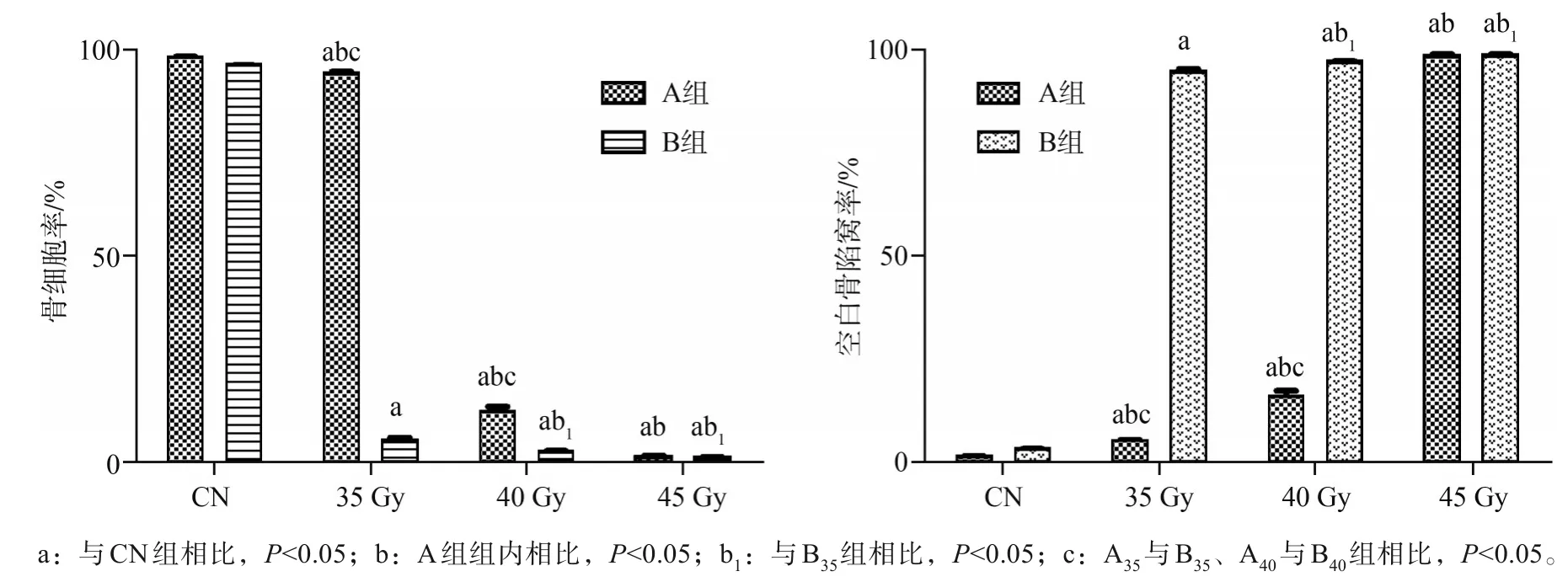
图6 照射后各组骨细胞及空白骨陷窝变化Fig 6 Changes of bone cells and lacunae in each group after irradiation
2.4 建模成功率
A35、A40组大鼠在拔牙时各死亡1只,A45组拔牙时死亡2只,拔牙后3 d死亡1只,A组总存活率为66.7%(10/15)。B40组于照射第2天死亡1只,B组总存活率为93.3%(14/15)。根据ORNJ的标准,病理学上有死骨形成为建模成功的标志,A、B两组的建模成功率分别为40%(6/15)、93.3%(14/15)。
3 讨论
ORNJ是头颈肿瘤放疗中最严重的常见并发症[1],尽管放疗技术及防治措施在不断改善,但由于其发病机制不明,临床防治困难,发病率仍无明显下降[12,14]。ORNJ发病机制研究所用的建模方法差异较大,主要体现在照射仪器种类、照射方法、照射剂量等方面。辐照仪器不同,导致照射能量、剂量率相差较大,同时也会影响照射方法及辐照剂量的选择,故辐照仪器成为了模型建立的关键因素。ORNJ建模仪器主要包括:单次高剂量近距离内照射、单次高剂量外照射、分割外照射和小动物辐照仪等[9-11,15-16]。内照射需要切开下颌骨表面皮肤,置入导管和放射粒子,属于有创操作,动物死亡率高,同时增加局部炎性细胞因子释放,影响下颌骨的微环境,并且近距离内照射很少用于头颈癌的治疗[17]。与之相比,外照射更符合临床治疗模式,对局部微环境影响较小。单次高剂量外照射由于急性不良反应严重、大鼠死亡率高、实验成本高、临床运用价值低等原因,亦非最佳的照射模式选择。分割外照射是临床放射治疗的常用辐照方法,避免了单次大剂量照射的急性不良反应,符合正常细胞的生理变化。RS-2000因其在剂量均一性、安全性、稳定性、试验重复性等方面的优势,已成为生命科学研究领域中重要的X-Ray小动物辐照仪器[11],但目前关于分割模式下直线加速器和小动物辐照仪对ORNJ模型建立是否存在差异鲜见报道。由于照射仪器随着使用时限的延长,同一照射参数下所释放的X线会有所衰减,若未及时矫正可导致试验过程中动物实际接受的剂量不足,为了减少因仪器因素所致的混杂因素,本研究分别采用总剂量35、40、45 Gy进阶式5次分割模式照射大鼠,探索理想的大鼠ORNJ建模方案。
目前ORNJ诊断的主要依据有:辐射史,骨暴露,放射性骨破坏证据,无肿瘤复发,病理可见死骨形成[12-13]。本研究从临床表现、影像学及病理学进行评估,发现照射组照射区域急性皮肤黏膜反应,拔牙创愈合差、骨外露;micro-CT显示拔牙创骨质破坏;病理可见骨组织骨量减少,髓腔空泡化,A40、A45和B组明显死骨形成,符合典型ORNJ病理改变。但是,B组大鼠照射后局部急性黏膜不良反应、体重下降比A组轻,拔牙创骨暴露面积比A组严重。照射后A组双侧颌骨生长明显受抑,B组局限于照射侧。B组总存活率、建模成功率均优于A组,也高于其他文献[18]报道的建模成功率(83%)。本实验中加入了40、45 Gy高剂量照射,在总存活率稍低的情况下,模型成功率却不低于文献报道,表明小动物辐照仪照射后大鼠全身及局部情况较好,死亡率低,建模成功率高,更利于长期及动态观察照射后病理变化。对比2种照射仪器,发现辐照剂量固定的情况下,照射能量及剂量率是主要的差异。直线加速器照射能量为8 MV,剂量率为600 MU·min-1;RS-2000辐照仪器能量为160 kV,剂量率为1.265 Gy·min-1。能量越高,剂量率越大,其组织穿透能力越强,照射深度越深、范围越广,急性不良反应就越重,因而A组大鼠全身及局部不良反应比B组更重,从而增加实验的混杂因素,影响模型建立。此外,A35组肉眼可见拔牙创愈合,影像学上无明显骨质破坏,染色见骨细胞数量降低,空白骨陷窝增多,但无明显死骨形成,因此,直线加速器35 Gy照射后下颌骨改变更符合放射性骨损伤模型。A40组拔牙创愈合,A45组拔牙创明显骨外露,micro-CT上有骨质破坏,病理可见明显死骨形成。A40组的临床表现不符合ORNJ诊断标准,但影像学及病理符合,与临床实际情况存在差异,非最佳模型选择。A45组满足目前ORNJ诊断标准,但大鼠一般情况差,照射后不良反应重,动物死亡风险较高,亦非理想的模型选择。B组照射后下颌骨改变不仅符合典型的ORNJ病理变化,而且试验过程中大鼠一般情况更好,照射后急性炎症反应较轻,大鼠死亡率低,病理变化显著,模型成功率高,进一步验证了小动物辐照仪在ORNJ建模中的优势。同时,B35与B40、B45组间骨细胞、空白骨陷窝变化存在差异,B40与B45组间差异无统计学意义。研究[18-19]发现,35 Gy的照射总剂量对大鼠健康骨骼的组织病理学影响相当于人类辐照总剂量70 Gy,故小动物辐照仪35 Gy照射剂量最接近人体实际情况。
根据目前ORNJ的4种分型[3,20-21],A35组模型也可能是B0S0无明显症状期,属于ORNJ早期病理变化,B组动物模型可能属于中晚期病理改变。但若以治疗纤维化疾病为标准,早期纤维化治疗是临床治疗的关键时期,治疗效果对疾病的愈后具有重要意义,然而现有能与临床ORNJ分型相匹配的动物模型研究较少,尤其是早期ORNJ的认识及治疗。本实验以拔牙后3周为实验终点,未动态描述下颌骨变化,今后尚需进一步延长观察时间。
综上,小动物辐照仪在35 Gy照射剂量下大鼠一般情况好、死亡率低、建模成功率高,简单易行,是较理想的大鼠ORNJ建模方法。
利益冲突声明:作者声明本文无利益冲突。
