合并肝细胞性肝癌的细粒棘球蚴感染裸鼠移植瘤中NK细胞的表达
2021-10-21艾麦提牙森热则耶热合曼下依马旦节里力朱马图迪朱马洪阿力木江吐拉麦提王茂林
艾麦提·牙森,热则耶·热合曼,下依马旦·节里力,王 恒,朱马图迪·朱马洪,阿力木江·吐拉麦提,王茂林,冉 博*
(1新疆医科大学第一附属医院消化血管外科中心肝胆包虫病外科,乌鲁木齐 830054;2新疆维吾尔自治区包虫及肝胆疾病临床医学研究中心;3新疆医科大学第一临床医学院;*通讯作者,E-mail:ranbo822116@163.com)
棘球蚴病是一种棘球蚴绦虫的虫卵感染所致的,呈世界性分布的的人畜共患疾病,严重危害全球卫生和经济发展,尤其在中国西部和南美洲的牧区最为严重[1]。流行病学调查发现,病原微生物包括细菌、真菌和寄生虫感染,也与恶性肿瘤的发生发展密切相关[2,3],目前约有200万恶性肿瘤病例是由病原微生物感染引起的,占全世界恶性肿瘤发生率的16.1%[4]。
研究表明,病原微生物与恶性肿瘤所产生的抗原,如O-糖基化抗原、Tn抗原和arc5抗原等具有许多相似性,这些共同抗原的表达为棘球蚴病与恶性肿瘤的研究提供基础[5,6]。此外,实验证明,给荷瘤动物模型注射寄生虫抗原后,相关免疫系统功能增强、免疫细胞数量增加[7],提示寄生虫感染合并恶性肿瘤可影响宿主免疫细胞功能状态。Noya等[8]研究结果提示,肝囊型棘球蚴病患者囊液中所获取的mucin-like肽具有提高宿主NK细胞数量从而影响恶性肿瘤发生发展的作用。目前关于NK细胞在肝细胞性肝癌合并细粒棘球蚴(Echinococcus granulosus, Eg)感染移植瘤中作用相关的研究甚少。故本研究通过HepG2细胞单独接种和/或与Eg的原头蚴(protoscolices, PSCs)联合接种建立裸鼠皮下移植瘤模型检测NK细胞标志物的表达情况,初步探讨NK细胞在肝细胞性肝癌合并Eg感染裸鼠移植瘤的作用,为寄生虫合并恶性肿瘤的研究提供新思路。
1 材料与方法
1.1 材料
HepG2人肝细胞性肝癌细胞系购自北京北纳创联生物技术公司BNCC细胞库;Eg PSCs来自于新疆乌鲁木齐华凌屠宰场中自然感染细粒棘球蚴的绵羊肝脏,并在无菌条件下获得。
1.2 主要试剂
DMEM培养基、胎牛血清、青霉素、链霉素购自美国Gibco公司;CD16兔单克隆抗体、CD56兔多克隆抗体、NKG2D兔单克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗及DAB显色液购自英国Abcam公司;生理盐水、PBS缓冲液、山羊血清封闭液、柠檬酸钠抗原修复液及中性树胶购自中国中杉金桥生物技术有限公司;Trizole、RNA逆转录试剂盒、SYBR购自大连TaKaRa公司。
1.3 Eg PSCs的收集
在无菌条件下检查囊肿,抽吸原头节。2 000 r/min离心2 min后弃上清。加入10 ml生理盐水清洗3次(按上述条件离心),以10%胎牛血清+DMEM培养基培养Eg PSCs。
1.4 HepG2细胞培养
以10%胎牛血清+1%双抗(青霉素-链霉素)+DMEM培养基培养细胞,置于含5%CO2的37 ℃培养箱中培养,1-2 d换液,2-3 d细胞传代。
1.5 Eg感染合并肝细胞性肝癌的裸鼠移植瘤模型建立
选取40只8-10周龄雌性BALB/c裸鼠,体质量(15±3)g,将其随机分为单独移植组和联合移植组。单独移植组将5×106个HepG2细胞接种于裸鼠皮下;联合移植组将5×106个HepG2细胞和2 000个Eg PSCs联合接种于裸鼠皮下。观察两组裸鼠的饮食、活动反应及精神状态,对外界刺激的反应。其中,肿瘤体积(V)的测量:自接种后第25天起,每4 d用游标卡尺测量皮下移植瘤的长径(a)和短径(b),共测量5次(即接种第25,28,31,34,37天),按公式V=ab2/2计算移植瘤体积。接种37 d获取皮下移植瘤,将一半组织经脱水石蜡包埋用于病理染色,另一半组织冻存于-80 ℃冰箱用于qRT-PCR实验。
1.6 苏木素伊红(HE)染色观察移植瘤的基本病理变化
将薄片放入62 ℃烤箱烤烘60 min后常规脱蜡,放入蒸馏水浸洗3次×5 min,随后浸泡苏木素溶液1.5-2 min,立即蒸馏水冲洗至泛色,用盐酸乙醇分化2-5 s,再放入蒸馏水反蓝40-60 s后浸泡伊红溶液1-1.5 min,蒸馏水反复冲洗至泛色,常规脱水,透明并晾干,中性树胶封片后光学显微镜下观察并收集图像。
1.7 免疫组织化学染色检测NK细胞相关蛋白在移植瘤中的表达
将薄片放入62 ℃烤箱烤烘60 min后常规脱蜡,用蒸馏水冲洗3次×5 min,泡在枸橼酸抗原修复液高温(90-100 ℃)修复15 min,自然冷却至室温。PBS缓冲液冲洗3次×5 min,置于3% H2O2溶液室温孵育10 min,PBS缓冲液冲洗3次×5 min,滴加山羊血清室温封闭1 h后滴加一抗(CD16 1 ∶200;CD56 1 ∶100;NKG2D 1 ∶400)置于4 ℃冰箱孵育过夜。次日复温1 h后,PBS缓冲液洗3次×5 min,滴加二抗(1 ∶2 000)室温孵育90 min;PBS缓冲溶液冲洗3次×5 min后滴加适量DAB显色液于光学显微镜下观察显色。苏木精复染10-30 s,反复冲洗至泛色,浸泡盐酸乙醇分化2-3 s后,用蒸馏水反蓝40-60 s。最后常规脱水、透明、自然晾干后封固。显微镜下观察并采图,使用ImageJ软件计算阳性区域面积,然后进行统计分析。
1.8 qRT-PCR检测NK细胞相关mRNA在移植瘤中的表达
用Trizole试剂提取裸鼠皮下移植瘤中的总mRNA。按照反转录试剂盒说明书操作反转录为cDNA,反转录条件:25 ℃ 10 min,42 ℃ 50 min,85 ℃ 5 min。按照荧光定量PCR扩增试剂盒说明书操作,扩增条件设置:94 ℃预变性4 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,循环40次,72 ℃检测信号。使用2-ΔΔCt法来计算相对mRNA含量,ΔCt=Ct目的基因-Ct管家基因GAPDH,ΔΔCt=ΔCt联合移植组-ΔCt单独移植组,2-ΔΔCt表示联合移植组目的基因mRNA的相对含量较单独移植组所改变的倍数。引物序列见表1。
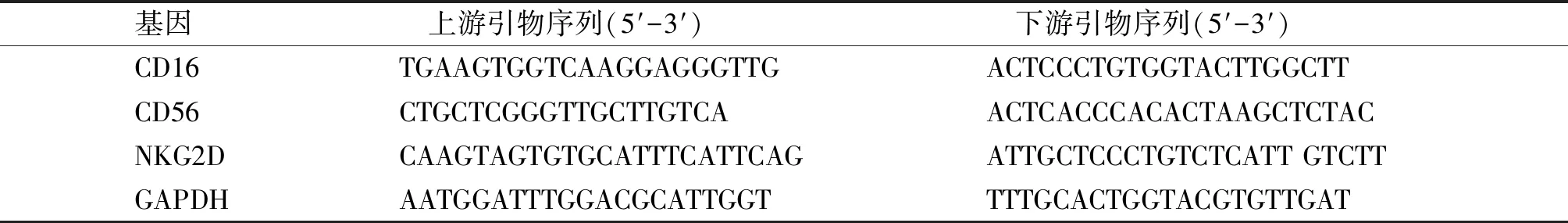
表1 qRT-PCR引物序列
1.9 统计分析
2 结果
2.1 皮下移植瘤的大体变化
自接种后第25天起,每4 d测量皮下移植瘤体积,共5次。结果显示,与单独移植组相比,联合移植组不同接种时间移植瘤的体积明显增大,差异具有统计学意义(P<0.05,见图1),表明Eg感染对HepG2细胞体内的增殖有促进作用。

图1 皮下移植瘤体积的变化Figure 1 Changes of volume of subcutaneous lesions
2.2 皮下移植瘤的基本病理变化
HE染色显示,HepG2细胞单独移植组细胞形态和体积不均一,细胞质嗜碱,核质比例增加,有丝分裂活性增强。此外,部分细胞出现脂肪变性、凝固性坏死和空泡。Eg PSCs和HepG2细胞联合移植组中细胞病理变化更为明显,并可见典型的Eg PSCs结构(见图2)。

黑色箭头表示脂肪变性,蓝色箭头表示空泡样变化,黄色箭头表示凝固性坏死,红色箭头表示Eg PSCs结构图2 皮下移植瘤的基本病理变化Figure 2 Basic pathological changes of subcutaneous lesions
2.3 CD16阳性NK细胞在皮下移植瘤中的表达
免疫组织化学染色结果显示,CD16阳性NK细胞主要定位于皮下移植瘤组织,呈棕褐色。定量结果显示,Eg PSCs和HepG2细胞联合移植组CD16阳性NK细胞的表达量明显高于HepG2细胞单独移植组,差异具有统计学意义(P<0.05)。qRT-PCR结果显示,联合移植组中CD16 mRNA表达量较单独移植组明显增加,差异具有统计学意义(P<0.05,见图3)。
2.4 CD56阳性NK细胞在皮下移植瘤中的表达
免疫组织化学染色结果显示,CD56阳性NK细胞主要定位于皮下移植瘤组织,呈棕褐色。定量结果显示,Eg PSCs和HepG2细胞联合移植组CD56阳性NK细胞的表达量明显高于HepG2细胞单独移植组,差异具有统计学意义(P<0.05)。qRT-PCR结果显示,联合移植组中CD56 mRNA表达量较单独移植组明显增加,差异具有统计学意义(P<0.05,见图4)。

箭头表示CD16阳性NK细胞;与单独移植组(HepG2)相比,*P<0.05图3 CD16阳性NK细胞在皮下移植瘤中的表达 (×200)Figure 3 Expression of CD16 positive NK cells in the subcutaneous lesions (×200)

箭头表示CD56阳性NK细胞;与单独移植组(HepG2)相比,*P<0.05图4 CD56阳性NK细胞在皮下移植瘤中的表达 (×200)Figure 4 Expression of CD56 positive NK cells in the subcutaneous lesions (×200)
2.5 NKG2D在皮下移植瘤中的表达
免疫组织化学染色结果显示,NK细胞分泌的NKG2D主要定位于皮下移植瘤组织,呈棕褐色。定量结果显示,Eg PSCs和HepG2细胞联合移植组NKG2D阳性细胞的表达量明显高于HepG2细胞单独移植组,差异具有统计学意义(P<0.05)。qRT-PCR结果显示,联合移植组中NKG2D mRNA表达量较单独移植组明显增加,差异具有统计学意义(P<0.05,见图5)。

箭头表示NKG2D阳性细胞;与单独移植组(HepG2)相比,*P<0.05图5 NKG2D在皮下移植瘤中的表达 (×200)Figure 5 NKG2D expression in the subcutaneous lesions (×200)
3 讨论
寄生虫感染与恶性肿瘤之间存在密切的关系。寄生虫感染后随着血流到达全身各个部位寄生,导致宿主免疫力下降从而引起各种疾病的发生。此外,寄生虫感染所产生的代谢产物或分泌的细胞因子和生长因子对宿主微环境产生细胞毒素作用,并诱导某些类型恶性肿瘤发生[9,10]。相反,在恶性肿瘤发生发展过程中,肿瘤特异性抗原在体内被降解为小片段,通过影响宿主免疫系统和免疫细胞功能状态从而引起各种感染性疾病的发生[11,12]。在临床工作中寄生虫感染合并恶性肿瘤患者十分罕见,但由于缺乏典型的临床表现和特征,大多数患者未及时发现并到中晚期才寻求治疗,对这些患者来说手术和药物治疗效果均较差。因此,开展寄生虫感染合并恶性肿瘤发生相关的研究显得尤为重要。
研究表明,与肝恶性肿瘤患者相比(中位生存时间6个月),囊型棘球蚴病合并肝恶性肿瘤患者生存时间明显延长(中位生存时间17个月),提示Eg感染与肝恶性肿瘤的发生发展之间存在明确的相关性[13]。此外,体外采用Eg PSCs和HepG2细胞共培养发现,Eg PSCs能促进HepG2细胞的增殖、侵袭和迁移能力,这可能与Eg PSCs分泌一些细胞因子有关[14]。Eg侵入中间宿主后引起机体免疫系统发生一些变化从而逐渐形成病理性的免疫逃避机制。其中,NK细胞作为重要的固有免疫细胞参与T细胞特异性免疫反应的过程,引起Eg病灶微环境免疫状态的改变[15,16]。此外,囊液中的分泌物通过改变宿主NK细胞数量和功能状态对恶性肿瘤的发生发展具有促进作用。由于体外共培养实验体系未考虑到免疫系统的作用,因此需要开展动物实验进一步探讨Eg感染对肝恶性肿瘤的影响以及阐明宿主免疫细胞的功能状态。
本实验中采用Eg PSCs和HepG2细胞系建立裸鼠皮下移植瘤模型,结果显示,在联合移植组中皮下移植瘤体积较单独移植组明显增大,提示Eg感染在体内促进HepG2细胞的增殖,这与近期体外实验结果一致[17]。研究表明,寄生虫感染和恶性肿瘤生长过程中,通过高表达免疫抑制性NKG2A导致NK细胞功能的耗竭和机体免疫耐受,从而影响疾病的转归[18,19]。我们免疫组织化学染色和qRT-pCR结果显示,与单独HepG2细胞移植组相比,在联合移植组中CD16、CD56、NKG2D等NK细胞标志物表达量明显增加,表明Eg感染后NK细胞可能通过高表达免疫抑制性分子处于免疫耗竭的状态从而促进HepG2细胞体内的增殖。
总之,NK细胞作为重要的固有免疫细胞可能参与Eg感染引起的HepG2细胞增殖过程。随着对Eg病灶和肿瘤微环境认识的进一步加深,研究免疫细胞在Eg感染合并恶性肿瘤的作用及其可能的机制具有深远意义,靶向Eg与恶性肿瘤共同抗原或Eg代谢产物有望成为治疗恶性肿瘤的新靶点。
