超声造影对胆管细胞癌与肝细胞癌的鉴别诊断价值
2021-10-21洪德娜朱桂新张敬红
洪德娜 朱桂新 张敬红 李 冰
由于肝细胞癌与胆管细胞癌的生物学行为、治疗方法及预后均不相同,故准确鉴别诊断尤为重要。肝细胞癌发生于慢性肝病的基础上,而胆管细胞癌多发生于正常肝脏组织中,且预后极差。研究[1]表明,肿瘤新生血管越多,癌组织生长越活跃,易在病灶组织发展过程中大量释放生成因子,促使新生血管形成,加上肝细胞癌具有血管依赖性病变的特点,可在一定程度上促使新生血管生成,而新生血管在癌细胞的发生、发展及转移过程中具有重要作用,因此临床将肿瘤微血管密度(microvessel density,MVD)作为衡量肿瘤血管生成的标准。随着影像学技术的发展,超声造影已成为诊断肝癌的重要方法,本研究旨在探讨超声造影鉴别诊断胆管细胞癌与肝细胞癌的价值。
资料与方法
一、研究对象
选取2015年5月至2019年8月我院经病理确诊的胆管细胞癌患者42例(胆管细胞癌组)和肝细胞癌患者114例,其中肝细胞癌患者按照不同分化程度[1]分为高分化组、中分化组、低分化组,每组各38例。胆管细胞癌中,男22例,女20例,年龄46~58岁,平均(52.12±1.23)岁,体质量指数(23.45±1.05)kg/m2;高分化组中,男18例,女20例,年龄43~55岁,平均(52.16±1.27)岁,体质量指数(23.49±1.09)kg/m2;中分化组中,男19例,女19例,年龄45~57岁,平均(52.14±1.25)岁,体质量指数(23.52±1.02)kg/m2;低分化组中,男21例,女17例,年龄44~58岁,平均(52.19±1.19)岁,体质量指数(23.47±1.07)kg/m2。纳入标准:①原发性肝癌的诊断标准参考《原发性肝癌诊断、分型、分期标准的探讨》[2];②临床资料完整;③超声造影检查前1周未服用影响心率及全身循环的药物;④认知功能正常。排除高血压病、冠状动脉粥样硬化性心脏病、合并慢性阻塞性肺疾病及脑卒中患者。各组一般资料比较差异均无统计学意义。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
1.仪器与试剂:使用GE Logiq E 9彩色多普勒超声诊断仪,凸阵探头,频率3.5 MHz,机械指数0.08~0.12;配备实时超声造影成像技术及时间-强度曲线分析软件。造影剂为SonoVue(意大利Bracco公司)。
2.超声造影检查:患者取平卧位,先行常规超声检查,观察病变部位、边界、血流分级;然后经肘静脉团注造影剂2.4 ml,生理盐水5.0 ml冲管,启动动态录像记录,连续观察6 min造影图像,应用时间-强度分析软件将取样框置入病灶感兴趣区,自动绘制时间-强度曲线,获得始增时间、达峰时间、始退时间、持续时间、始增强度及峰值强度。所有参数均检测3次,取平均值;所有操作均由同一超声医师严格按照操作步骤完成。
3.MVD检测:根据病理结果选取标本中心部位(非坏死处)进行组织切片、染色,染成棕黄色或棕褐色的内皮细胞作为阳性血管计数,取3次检测的平均值为MVD值。所有操作均由同一病理医师严格按照操作步骤完成。
三、统计学处理
结 果
一、各组超声造影检查结果比较
胆管细胞癌组始增时间和峰值强度高于均高、中、低分化组,达峰时间高于低分化组(均P<0.05);胆管细胞癌组达峰时间与高、中分化组比较差异均无统计学意义。胆管细胞癌组始退时间、持续时间均低于高、中、低分化组,差异均有统计学意义(均P<0.05);始增强度与高、中、低分化组比较差异无统计学意义。见表1和图1。
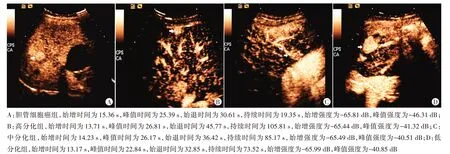
图1 各组超声造影图
表1 各组超声造影参数比较(±s)
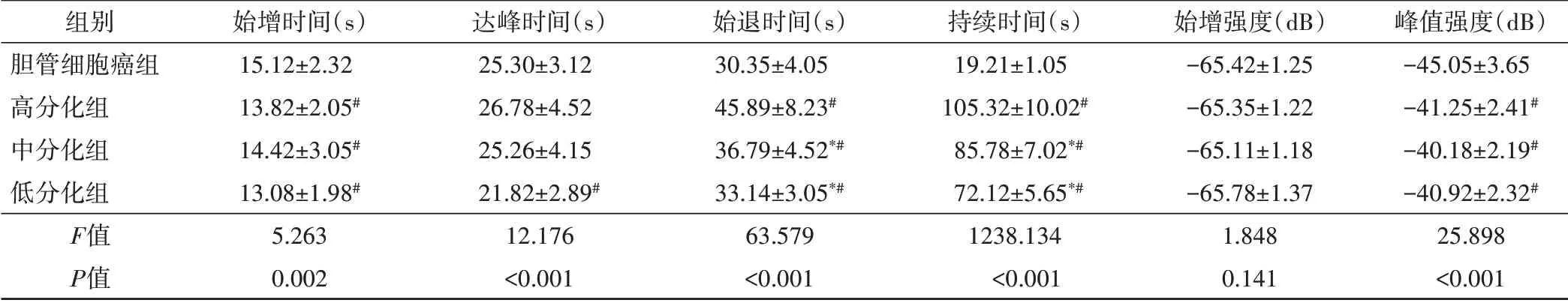
表1 各组超声造影参数比较(±s)
与高分化组比较,*P<0.05;与胆管细胞癌比较,#P<0.05
组别胆管细胞癌组高分化组中分化组低分化组F值P值始增时间(s)15.12±2.32 13.82±2.05#14.42±3.05#13.08±1.98#5.263 0.002达峰时间(s)25.30±3.12 26.78±4.52 25.26±4.15 21.82±2.89#12.176<0.001始退时间(s)30.35±4.05 45.89±8.23#36.79±4.52*#33.14±3.05*#63.579<0.001持续时间(s)19.21±1.05 105.32±10.02#85.78±7.02*#72.12±5.65*#1238.134<0.001始增强度(dB)-65.42±1.25-65.35±1.22-65.11±1.18-65.78±1.37 1.848 0.141峰值强度(dB)-45.05±3.65-41.25±2.41#-40.18±2.19#-40.92±2.32#25.898<0.001
二、MVD检测结果
胆管细胞癌组、高分化组、中分化组、低分化组MVD分别为(38.71±2.45)个/0.75 mm2、(51.25±5.65)个/0.75 mm2、(73.45±8.78)个/0.75 mm2、(110.05±12.32)个/0.75 mm2,差异有统计学意义(F=588.768,P<0.001)。见图2。
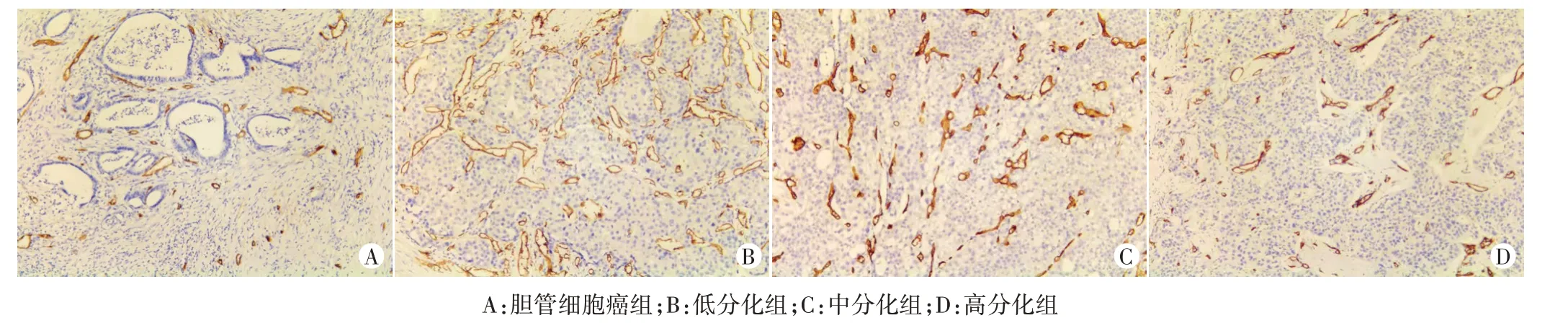
图2 各组病理图(HE染色,×200)
三、相关性分析
相关性分析显示,达峰时间、峰值强度与MVD均呈负相关(r=-0.226、-0.274,均P<0.05),持续时间、始增强度与MVD均呈正相关(r=0.349、0.246,均P<0.05)。
四、ROC曲线分析
各超声造影参数单独及联合应用鉴别诊断胆管细胞癌与肝细胞癌的ROC曲线分析见图3和表2。始增时间、峰值时间、始退时间、持续时间、始增强度、峰值强度及其联合应用鉴别诊断胆管细胞癌与肝细胞癌的AUC分别为0.695、0.799、0.655、0.624、0.635、0.639、0.995,联合应用的AUC高于各参数单独应用(均P<0.05)。
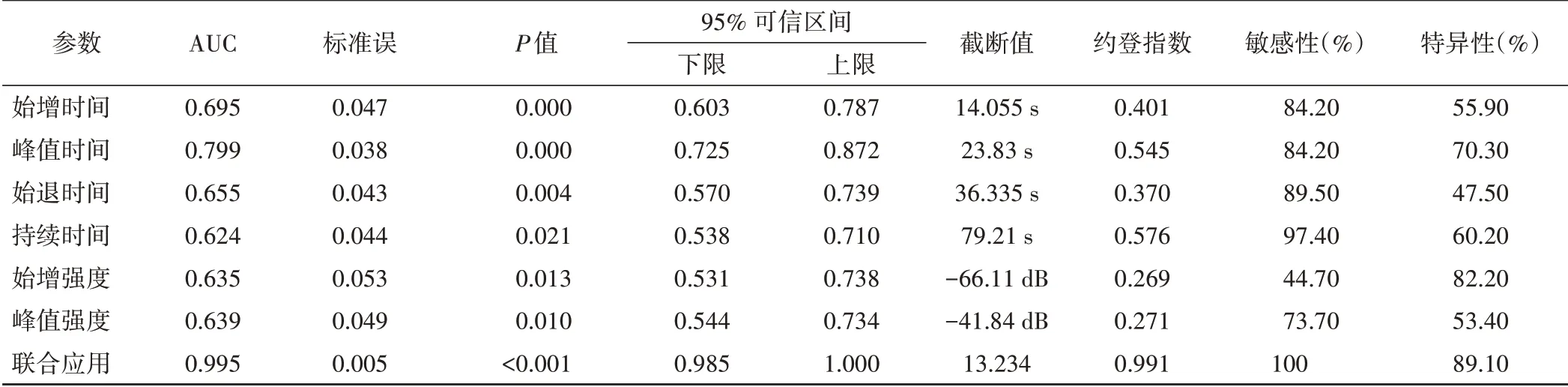
表2 超声造影参数单独及联合应用鉴别诊断胆管细胞癌与肝细胞癌的ROC曲线分析
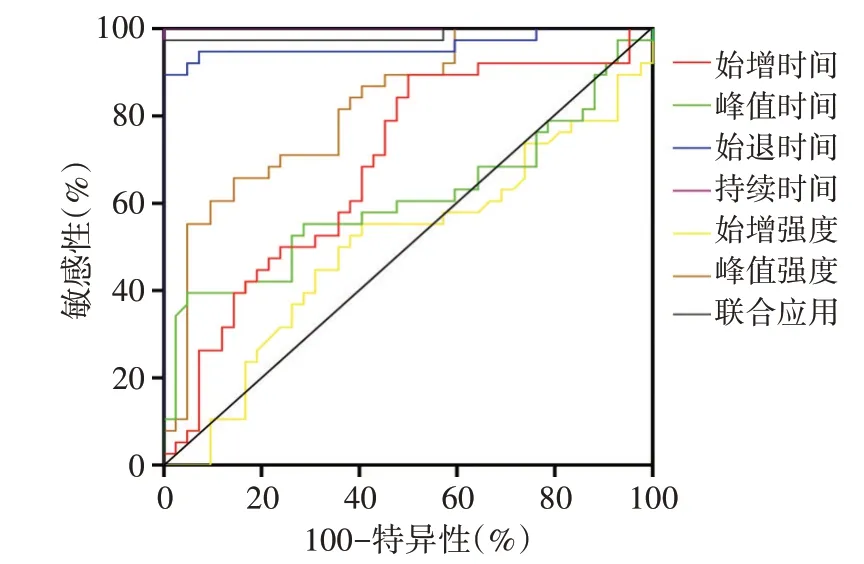
图3 各超声造影参数单独及联合应用鉴别诊断胆管细胞癌与肝细胞癌的ROC曲线图
讨 论
肝细胞癌与胆管细胞癌均为原发性肝癌,两者病理类型不同,血流动力学亦不相同,临床多采用常规超声对二者进行鉴别诊断,由于胆管细胞癌的常规超声表现缺乏特征性,故不易与肝细胞癌、肝内转移癌等区分[3]。超声造影可通过显示病灶内血流灌注情况为疾病的诊断提供参考依据。研究[4]显示,胆管细胞癌有活性的肿瘤细胞主要位于肿瘤周边,病灶组织伴有不同程度的纤维化,而纤维化组织又多位于肿瘤中央,且伴有不同程度的凝固性坏死灶,与二者交织在一起,为超声造影检查提供了有利条件。
超声造影显示肝细胞癌病灶表现为动脉相快速均匀高增强,消退则呈低增强,动脉相呈不均匀高增强时提示肝细胞癌患者存在不同程度的坏死、纤维化及透明样变性;若周边见3个高增强病灶,说明肝细胞癌患者内部出现大片坏死或纤维化[5]。有研究[6]显示,肝细胞癌患者门静脉相、延迟相的超声造影回声与癌细胞的分化程度直接相关。本研究结果显示,高、中、低分化组始退时间、持续时间比较差异均有统计学意义(均P<0.05);其中高分化组始退时间较中、低分化组更晚,而持续时间较中、低分化组更长(均P<0.05)。分析原因为早期及分化程度较低的肝细胞癌患者不仅有滋养动脉供应,在一定程度上还接受门静脉供血,中、低分化患者始退时间和持续时间的缩短也与血供减少相关[7]。本研究结果显示,胆管细胞癌组始退时间、持续时间均低于高、中、低分化组(均P<0.05),分析原因为胆管细胞癌内缺乏动静脉分流,因此血供较少,动脉相呈不均匀低增强,当门脉相造影剂迅速消退时会呈现更明显的低增强,而肝细胞癌内具有较多的血管数量,其血流速度快、血供多,因此动脉相表现与胆管细胞癌相反,临床可根据该表现区分肝细胞癌与胆管细胞癌[8]。
新生血管形成是肿瘤血流灌注量增加的主要原因,亦是超声造影显像特征形成的病理学基础。MVD可评估肿瘤新生血管的生成,故临床认为原发性肝癌患者的超声造影参数与MVD密切相关。本研究结果显示,高、中、低分化组及胆管细胞癌组MVD表达量比较差异有统计学意义(P<0.05),与谢国平等[9]研究结果一致。本研究超声造影检查显示,低分化组达峰时间较其他组更短,原因为肿瘤单位体积内的血管数量较多、管腔较大,当造影剂进入病灶内,易较快达到峰值。另外,受血管壁侵蚀的影响,低分化肝细胞癌患者易形成动静脉瘘,使动脉血流速度加快及流量增加,导致达峰时间提前。故临床认为达峰时间在一定程度上能够反映肝细胞癌的MVD,对预测该病的浸润、转移及复发具有重要意义。
本研究还发现达峰时间与MVD呈负相关(P<0.05),间接佐证了“达峰时间能反映肝细胞癌的MVD”的结论,与潘建强等[10]研究结果一致。本研究ROC曲线分析显示,始增时间、达峰时间、始退时间、持续时间、始增强度、峰值强度及其联合应用鉴别诊断胆管细胞癌与肝细胞癌的AUC分别为0.695、0.799、0.655、0.624、0.635、0.639、0.995,联合应用的AUC高于各参数单独应用(均P<0.05),故建议上述参数联合诊断,以提高检出率。
综上所述,超声造影能有效鉴别胆管细胞癌与肝细胞癌,可通过时间-强度曲线定量参数评估肿瘤的分化程度,反映肿瘤内新生血管,为临床治疗提供客观依据。但本研究为回顾性分析,样本量相对较少,今后需大样本多中心研究。
