EV71 灭活疫苗适龄接种儿童CVA6 血清中和抗体变化分析
2021-10-20曾洁媛殷琼洲王雷李家洪张莹王丽春李琦涵杭连菊车艳春
曾洁媛,殷琼洲,王雷,李家洪,张莹,王丽春,李琦涵,杭连菊,车艳春
1.中国医学科学院北京协和医学院医学生物学研究所云南省重大传染病疫苗研发重点实验室,云南昆明650118;2.湖北省疾病预防控制中心,湖北武汉430079;3.湖北省襄州区疾病预防控制中心,湖北襄州441199;4.湖北省襄阳市疾病预防控制中心,湖北襄阳441022
手足口病(hand,foot and mouth disease,HFMD)是由肠道病毒引起的多发于学龄前儿童的急性传染病[1]。其中肠道病毒 71 型(entervirus type 71,EV71)是引起HFMD 的主要病原体之一,更是HFMD 重症及死亡病例的首要致病原[2-3]。近年来,柯萨奇病毒A 组 6 型(Coxsackievirus A6,CVA6)曾在美国[4]、西班牙[5]、法国[6]等国家引起 HFMD 暴发;在我国大陆地区,该病毒自2012 年起亦引发多次HFMD 流行[7-12],与其相关的HFMD 比例也逐渐上升,引起我国大陆地区HFMD 病原谱发生改变[12]。因此,由CVA6 导致的 HFMD 引发了学术界广泛关注[13-14]。
肠道病毒传染性强,主要通过消化道、呼吸道和密切接触等途径传播,在短时间内可造成较大范围的流行。由于目前国内大陆地区上市的EV71灭活疫苗对其他肠道病毒引起的HFMD 无交叉保护作用,为全面防控HFMD 疫情,除对适龄儿童接种EV71 灭活疫苗以预防EV71 相关HFMD 外,需同时关注肠道病毒传染源,尤其应重点监测非EV71的肠道病毒传染源。人作为肠道病毒的唯一宿主,HFMD 患者和隐性感染者均为疾病传播的主要传染源,其中隐性感染者因其表现隐匿难以监控,且易引起疫情的扩散和蔓延,为HFMD 防控带来挑战[15]。
为了解人群中EV71 及CVA6 的隐性感染情况,以及接种EV71 灭活疫苗后抗EV71 和抗CVA6中和抗体水平的变化,本研究在湖北省襄阳市招募无HFMD 疾病史及EV71 灭活疫苗接种史的6 ~ 71月龄儿童,在开展EV71 灭活疫苗上市后免疫原性研究的同时,平行观察了CVA6 对健康儿童的感染情况,及其与EV71 灭活疫苗免疫效果的关系,以期为HFMD 防控提供科学依据。
1 材料与方法
1.1 研究对象 根据EV71 灭活疫苗上市后Ⅳ期临床试验的总体规划,经湖北省疾病预防控制中心伦理委员会批准,在湖北省襄阳市开展了EV71 灭活疫苗上市后研究。研究入组人员为无HFMD 疾病史且无EV71 灭活疫苗接种史的6 ~ 71 月龄健康儿童,均由家长签署知情同意书。
1.2 疫苗及细胞 EV71 灭活疫苗由中国医学科学院医学生物学研究所生产,为微乳白色混悬液,每瓶0.5 mL,每次人用剂量为0.5 mL,中和抗体效价不低于3.0 EU,1 次免疫动物后诱导产生的中和抗体效价不低于3.0 EU;接种部位为儿童上臂三角肌,肌内注射(注射前须摇匀);免疫2 剂次,每剂间隔1 个月。Vero 细胞和 RD 细胞由该所提供。
1.3 疫苗接种及样本采集 由专业采血护士分别于疫苗接种第0 天(免疫前)和第2 剂接种后第28天采集2.5 mL 静脉血于非抗凝管中,分离血清,置-20 ℃冰箱冻存待检。共采集115 名研究对象的免疫前及免疫后血样。
1.4 抗EV71 中和抗体检测 采用微量中和试验。将待检血清用MEM 基础培养液以1 ∶2 比例稀释后置56 ℃水浴锅中灭活30 min;用MEM 基础培养液将EV71 收获液(由中国医学科学院医学生物学研究所提供)稀释至使用浓度为100 CCID50/ 0.05 mL,作为病毒攻击液。于96 孔板中加入MEM 基础培养液,50 μL / 孔,将每份血清样品按编号加入板中第1行,50 μL / 孔,每板 2 孔,然后对板中血清样品进行2 倍系列稀释至所需稀释度(即从第1 列以1 ∶4的比例开始进行2 倍系列稀释),最后1 孔混匀后弃去50 μL 混合液,病毒对照、细胞对照不加血清;向板中各孔加入 EV71 攻击液,50 μL / 孔,细胞对照不加病毒攻击液,将病毒攻击液从100 CCID50/0.05 mL开始10、100、1 000 倍稀释后,分别加入病毒回滴板中,每个稀释度 4 孔,50 μL / 孔,每孔补加 MEM 基础培养液50 μL(相当于血清量),37 ℃孵箱中和3 h;胰酶消化对数生长期的Vero 细胞,用含10%灭活FBS 的细胞生长液制备浓度为106个 / mL 的细胞悬液,各孔均加入细胞悬液100 μL,置37 ℃,5% CO2培养箱培养7 d;每日观察细胞病变效应(CPE)。抗EV71 中和抗体滴度 ≥ 1 ∶8 记为阳性。
1.5 抗CVA6 中和抗体检测 采用微量中和试验。将待检血清用MEM 基础培养液以1 ∶2 比例稀释后置56 ℃水浴锅中灭活30 min;用MEM 基础培养液将CVA6 收获液(由中国医学科学院医学生物学研究所提供)稀释至使用浓度为100 CCID50/50 μL。于96 孔板中加入 MEM 基础培养液,50 μL / 孔,将每份血清样品按编号加入板中第 1 行,25 μL / 孔,每板 2孔,然后对板中血清样品进行2 倍系列稀释至所需稀释度(即从第1 列以1 ∶4 的比例开始进行2 倍系列稀释),最后1 孔混匀后弃去50 μL 混合液,病毒对照、细胞对照不加血清。向板中各孔加入CVA6 病毒液,50 μL / 孔,细胞对照不加病毒液,将病毒液从100 CCID50/ 0.05 mL 开始 10、100、1 000 倍稀释后,分别加入病毒回滴板中,每个稀释度4 孔,50 μL/孔,每孔补加MEM 基础培养液50 μL(相当于血清量),37 ℃孵箱中和3 h;胰酶消化对数生长期的RD 细胞,用含10%灭活FBS 的细胞生长液制备浓度为106个 /mL 的细胞悬液,各孔均加入细胞悬液100 μL,置37 ℃,5%CO2培养箱培养7 d,每日观察CPE。抗CVA6 中和抗体滴度≥1 ∶4 记为阳性。
1.6 统计学分析 非正态分布计量资料采用中位数描述集中趋势,以四分位数间距描述其离散趋势;以GMT 描述抗体水平;计数资料采用频数和构成比(%)描述分布情况。采用Kruskal-Wallis秩和检验比较研究对象免疫前及免疫后抗体滴度差异;计数资料采用χ2检验比较组间差异;以Cochran-Armitage趋势检验进行趋势分析。统计学检验均为双侧检验,α 取0.05。运用Stata 14.0 软件进行统计分析,以P<0.05 为差异有统计学意义。
2 结 果
2.1 研究对象概况 共采集了115 名无HFMD 疾病史和EV71 疫苗接种史适龄儿童的免疫前及免疫后血样。研究对象月龄中位数为31(四位分数间距:14 ~ 66),最小月龄为6,最大月龄为71。男童64名,占比55.65%,女童51 名,占比44.35%。不同年龄组的人数及性别构成情况见表1,各组性别分布差异无统计学意义(P= 0.267)。

表1 不同年龄组健康儿童性别构成情况Tab.1 Gender composition of healthy children in various age groups
2.2 EV71 灭活疫苗适龄接种人群的免疫前抗EV71及抗CVA6 中和抗体水平 该地区无HFMD 疾病史和EV71 疫苗接种史的适龄接种儿童的免疫前抗EV71 及抗CVA6 中和抗体阳性率分别为27.93%和33.91%。4 个年龄组的抗EV71 抗体阳性率为0.00% ~ 51.11%,抗CVA6 中和抗体阳性率为21.74% ~ 47.83%,均呈现随月龄增加而逐渐升高的趋势(EV71:P< 0.001,CVA6:P= 0.037)。见表2。

表2 EV71 灭活疫苗适龄接种儿童免疫前抗EV71 及抗CVA6 中和抗体阳性率Tab.2 Positive rates of neutralizing antibody against EV71 and CVA6 in serum samples of children before inoculation with inactivated EV71 vaccine
2.3 EV71 灭活疫苗适龄接种儿童的中和抗体共同阳性率 该地区无HFMD 疾病史和EV71 疫苗接种史的6 ~ 71 月龄儿童的抗EV71 及抗CVA6 中和抗体共同阳性率为15.32%。完成EV71 灭活疫苗2剂免疫后,共同阳性率升至32.74%。见表3。4 个年龄组儿童抗体共同阳性率在完成EV71 灭活疫苗2 剂免疫后均上调,最高为 >35 ~ 71 月龄组的50.00%,见图 1。

表3 EV71 灭活疫苗适龄接种儿童免疫前及免疫后抗EV71 及抗CVA6 中和抗体共同阳性率Tab.3 Co-positive rates of neutralizing antibodies against EV71 and CVA6 in serum samples of children before and after inoculation with inactivated EV71 vaccine
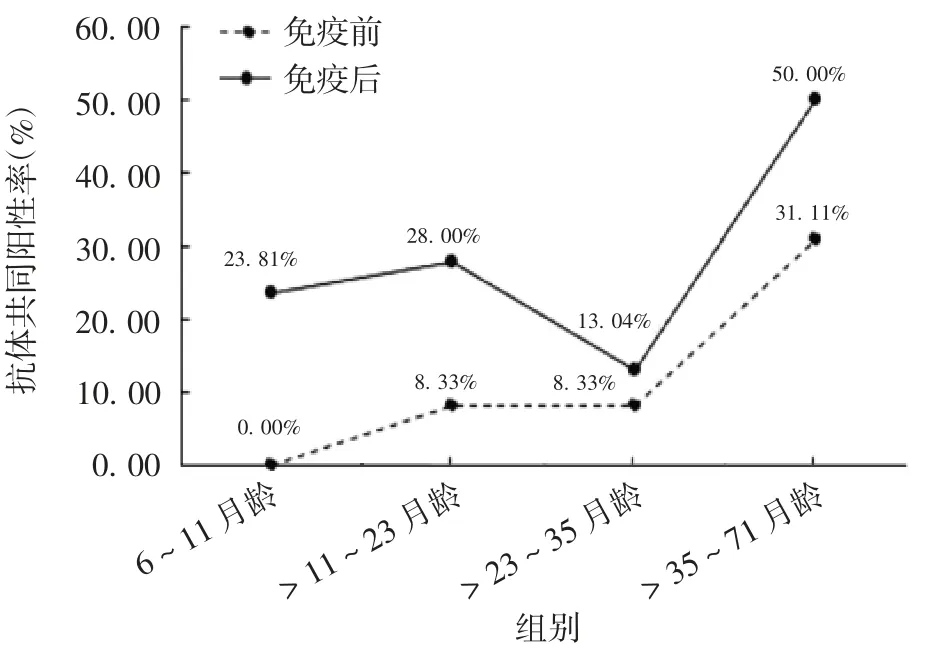
图1 不同年龄组EV71 灭活疫苗接种人群的免疫前及免疫后抗EV71 及抗CVA6 中和抗体阳性率Fig.1 Positive rates of neutralizing antibodies against EV71 and CVA6 in serum samples of children before and after inoculation with inactivated EV71 vaccine in various age groups
2.4 EV71 灭活疫苗适龄接种儿童全程免疫后的抗体水平变化 该地区适龄儿童完成EV71 灭活疫苗2 剂免疫后,抗EV71 中和抗体阳性率和GMT 分别由免疫前27.93%和7.01 升至98.23%和46.52(P均< 0.001);而抗CVA6 中和抗体阳性率仍维持在 33.91%,GMT 由3.09 升至 4.10,但差异无统计学意义(P= 0.348),见表 4 和表 5。

表4 EV71 灭活疫苗接种人群的抗EV71 及抗CVA6 中和抗体阳性率Tab.4 Positive rates of neutralizing antibody against EV71 and CVA6 in serum samples of children before and after inoculation with inactivated EV71 vaccine
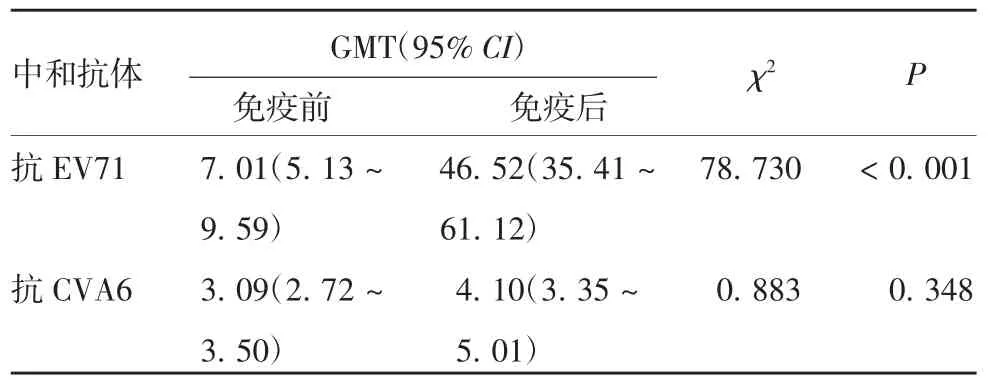
表5 EV71 灭活疫苗接种人群的抗EV71 及抗CVA6 中和抗体GMTTab.5 GMTs of neutralizing antibodies against EV71 and CVA6 in serum samples of children inoculated with inactivated EV71 vaccine
接种2 剂EV71 灭活疫苗后,4 个年龄组的抗EV71 中和抗体阳性率均明显上升(P均 < 0.001),除 >23 ~ 35 月龄组为91.30%外,其他3 组阳性率均达到100.00%;而4 组抗CVA6 中和抗体阳性率在免疫前及免疫后均维持不变。见图2。4 个年龄组免疫后抗EV71 中和抗体GMT 均较免疫前上升(P均 < 0.001),但抗CVA6 中和抗体GMT 与免疫前相比差异均无统计学意义(P均 > 0.05)。见图3。
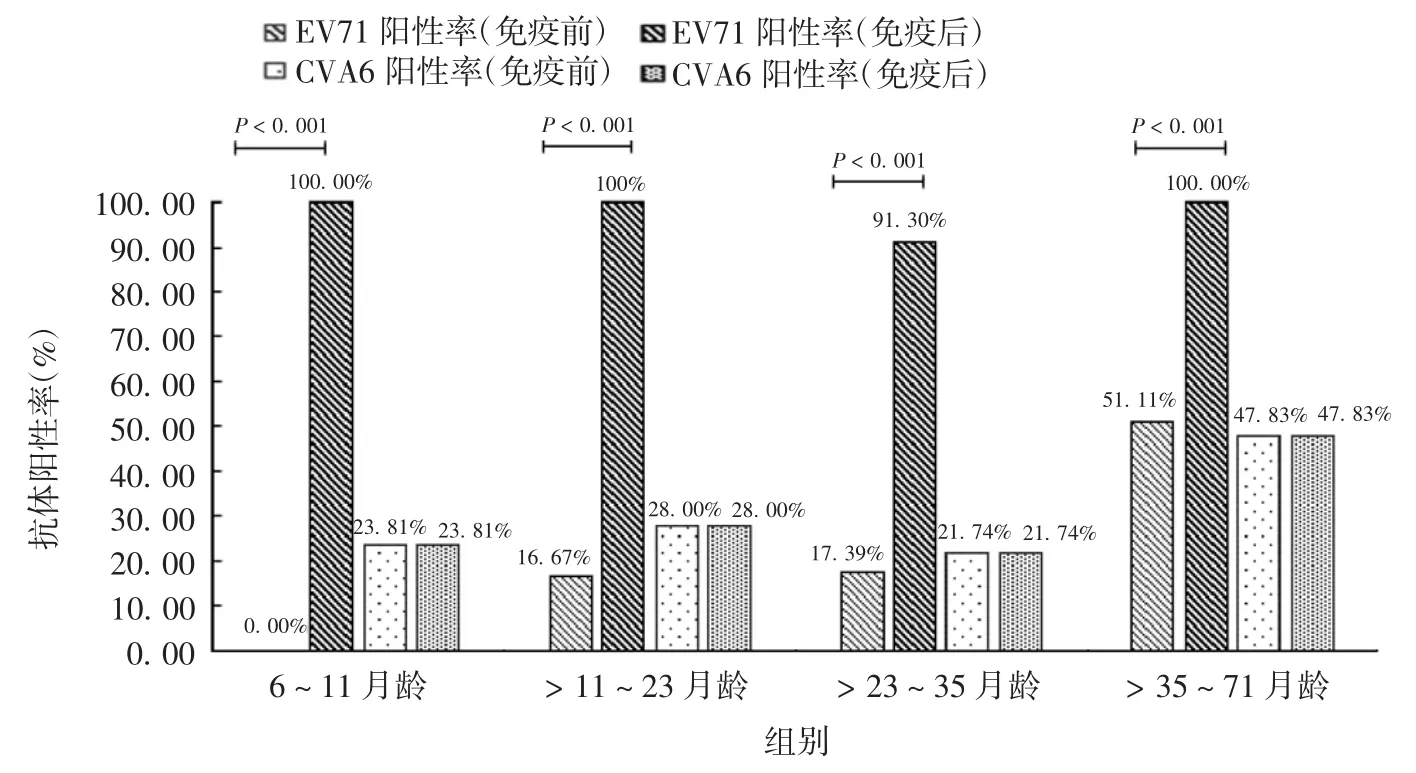
图2 不同年龄组EV71 灭活疫苗接种人群免疫前及免疫后的抗EV71 及抗CVA6 中和抗体阳性率Fig.2 Positive rates of neutralizing antibodies against EV71 and CVA6 in serum samples of children in various age groups before and after inoculation with inactivated EV71 vaccine

图3 不同年龄组EV71 灭活疫苗接种人群免疫前及免疫后的抗EV71 及抗CVA6 中和抗体GMTFig.3 GMTs of neutralizing antibodies against EV71 and CVA6 in children of various age groups before and after inoculation with inactivated EV71 vaccine
3 讨 论
隐性感染者是HFMD 传播的主要传染源之一,因其表现隐匿难以监控,且易引起疫情扩散及蔓延,为防控HFMD 带来挑战[15]。当前我国大陆地区的肠道病毒血清流行病学研究多以HFMD 患者为研究对象,着重探索HFMD 的病原谱,对健康人群的肠道病毒中和抗体水平及隐性感染状况研究相对较少[16-18]。因HFMD 的主要致病病原体为EV71 和CVA16,2 种病毒的流行率均在80%以上,因此当前针对健康人群的肠道病毒抗体水平的研究也主要关注EV71 和CVA16[16-17],少有研究调查健康人群的CVA6 抗体水平和隐性感染状况。目前可查询到的CVA6 隐性感染现状的报道是王宏宇[18]于2010年在山东省济宁市开展的一项HFMD 病例对照研究,结果显示,该地区254名3 ~ 60 月龄健康儿童的EV71 和CVA6 中和抗体阳性率分别为15.0%和1.6%。本研究对襄阳市无HFMD 疾病史和EV71 灭活疫苗接种史的6 ~ 71 月龄儿童的调查显示,该人群免疫前血清抗EV71 及抗CVA6 中和抗体阳性率分别为27.93%和33.91%,与陈润莉等[16]报道的健康人群中25.50%的抗EV71 中和抗体阳性率一致,高于王宏宇[18]报道的15.0%。该人群抗CVA6中和抗体阳性率高达33.91%,也与2012 年以来我国大陆地区CVA6 相关HFMD 比例上升的报道相符[7-12]。此外,两种抗体阳性率随年龄增加总体呈上升趋势,与郭学斌等[19]及孙宝昌等[20]的研究结果一致,可能是随着年龄增长,儿童机体免疫力增强,经外界感染不同型别肠道病毒的机会增加,因此通过隐性感染获得特异性免疫力的比例也随之上升。然而也有其他研究结果认为二者呈相反关系[21-22]。本研究还发现,该人群共同感染上述2 种病毒的隐性感染率达15.32%,提示当前肠道病毒隐性感染情况复杂,需重点监控。
在完成2 剂EV71 灭活疫苗免疫后,无论是总体情况还是各年龄组,适龄健康儿童的抗EV71 中和抗体阳性率和GMT 均较免疫前明显上升;但抗CVA6中和抗体阳性率在免疫后仍维持不变,GMT 在免疫前后差异无统计学意义(P>0.05)。结果显示,接种EV71 灭活疫苗并不影响接种儿童的抗CVA6 中和抗体水平,表明EV71 和CVA6 之间无交叉反应。当前我国大陆地区上市的EV71 灭活疫苗的疫苗株来源为EV71 的C4 亚型C4a 分支,既往多项研究也指出,该亚型EV71 仅针对EV71 的其他基因型或亚型,如 B1、B3、B4、B5、C1、C2、C3、C4 及 C5 起交叉保护作用[23-25],且上市前临床研究也未发现该疫苗对CVA16 及其他肠道病毒相关HFMD 起到交叉保护作用[26-27]。我国在 2012 年后 HFMD 病原谱的改变,以及当前适龄接种儿童较高的EV71 和CVA6 隐性感染率,均对当前HFMD 的防控提出了新挑战。
本研究初步调查了无HFMD 疾病史和EV71 灭活疫苗接种史的适龄接种儿童的血清抗EV71 及CVA6 中和抗体阳性率,以了解该人群EV71 及CVA16隐性感染率,为HFMD 防控提供科学依据。研究同时分析了适龄接种儿童完成EV71 灭活疫苗全程免疫后抗CVA6 中和抗体水平的变化,为探索接种EV71 灭活疫苗后CVA6 与EV71 的交叉反应情况提供参考。由于当前研究对象来自特定区域,样本量有限,不能代表我国大部分地区EV71 及CVA16的隐性感染总体情况。因此,更为明确的结果有待更多地域、更大人群范围的数据来进一步验证。
