甘珀酸对大鼠切口痛的影响及其作用机制
2021-10-20东淑珍石翊飒师永倩金平
东淑珍,石翊飒,师永倩,金平
兰州大学第二临床医学院,甘肃兰州730000
甘珀酸(carbenoxolone,CBX)是一类非特异性的缝隙连接(gap junction,GJ)阻滞剂,近年研究发现,CBX 对疼痛有明显的缓解作用,其机制可能是通过减少缝隙连接蛋白43(connexins 43,Cx43)的表达及磷酸化发挥镇痛作用[1],也可能是通过抑制缝隙连接蛋白1(pannexin 1,PX1)的表达,减少星形胶质细胞对ATP 的摄取及细胞内钙离子浓度的变化发挥镇痛作用[2]。
有报道表明,缝隙连接蛋白(connexin,Cx)在慢性疼痛中发挥重要作用,且有可能成为新一代镇痛药物的靶点[3]。不同于 Cx,PX 的细胞外环上有 2 个半胱氨酸残基,而Cx 的细胞外环上有3 个半胱氨酸残基[4-5]。PX1 以一种半通道单体的形式存在,允许ATP、Ca2+等小分子通过,从而参与星形胶质细胞的激活[6-7]。在炎症性和神经性疾病中,星形胶质细胞被激活,表现为星形胶质细胞增殖并增加其活化标志物胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)的表达。CBX 对PX1 的阻断作用是通过与PX1 的六聚体结合并关闭其通道作用,从而阻断钙离子及其他信号分子的内流。PX1 在星形胶质细胞表面高表达,参与星形胶质细胞的激活。本研究通过建立大鼠切口痛模型,探讨CBX 对大鼠切口痛的影响及PX1 在其发生机制中的作用。
1 材料与方法
1.1 主要试剂及仪器 CBX(A8389)及CBX 抑制剂10 panx(A2700)购自美国 APExBIO 公司;兔抗 GFAP多克隆抗体(Ab-BF0345)购自美国Affinity 公司;鼠抗PX1 单克隆抗体(ab139715)购自美国Abcam 公司;鼠抗GAPDH 单克隆抗体(sc-365062)购自美国Santa Cruz Biotech-nology 公司;FITC 标记的山羊抗鼠IgG(H+L)(S007)、TRITC 标记的山羊抗兔 IgG(H +L)(S0015)及HRP 标记的山羊抗鼠和山羊抗兔IgG(R0020)购自美国 Proteintech 公司;Von Frey 纤维丝购自美国North Coast Medical 公司;Plantar Tes(t37370)购自意大利UGO BASILE 公司。
1.2 实验动物 清洁级SD 大鼠,雄性,102 只,体重200 ~ 250 g,8 ~ 10 周龄,由中国农业科学院兰州兽医研究所实验动物中心提供,动物合格证号为:62000600000518。所有实验操作遵循国际疼痛学会相关指南,且通过兰州大学第二医院伦理委员会审核批准(D2019-064)。
1.3 动物分组及处理 将SD 大鼠随机分为5 组:对照组、模型组、生理盐水组、CBX 组(0.6 μg /10 μL)、抑制剂组(1.25 μg / 10 μL),对照组 6 只,其他组每组24 只。生理盐水组、CBX 组、抑制剂组大鼠于术前30 min,参考文献[8]的方法经鞘内分别注射生理盐水、CBX、CBX 抑制剂 10 panx,均 10 μL / 只,模型组不给药;参考文献[9]的经典Brennan 法对大鼠分别进行趾部切口痛模型操作。对照组不给药不进行手术处理。
1.4 行为学的测定
1.4.1 机械缩足阈值(mechanical withdrawal threshold,MWT)测定 参考文献[10]方法。术前 30 min所有大鼠进行 MWT 检测;术后 2、4、6、24 h,模型组、生理盐水组、CBX 组、抑制剂组分别取6 只大鼠进行检测,对照组于各时间点对6 只大鼠进行重复检测。将大鼠置于底部为金属网格的有机玻璃箱中适应30 min,采用 Von Frey 纤维丝(0.4 ~ 15 g)通过金属网格垂直刺激大鼠左后爪切口旁皮肤,使纤维丝持续弯曲并保持6 ~ 8 s,每次刺激间隔时间大于30 s。初始刺激强度2.0 g。若5 次刺激中出现3 次快速缩足或舔足反应记为疼痛X,再给予低一级强度刺激;若少于3 次则记为0,再给予高一级强度刺激。直到出现不同的刺激反应(记为X0 或0X)时,再连续检测4 次,获得有6 位字符,根据该6 位字符,通过von Frey 纤维丝阳性常数表查出常数κ(如OXOXOO =0.22)。同时记录最后一次刺激强度,按下式计算50% MWT 值。
50% MWT =[10 Xf + κδ]/ 10 000
式中Xf 为最末次测试的对数值,δ 为各刺激强度log 值相邻间距和的平均数,此处常数κ 为0.175。
1.4.2 热缩足潜伏期(thermal withdrawal latency,TWL)测定 参考文献[11]方法。测定时间点及大鼠数量与1.4.1 项相同。将大鼠放于有机玻璃箱中适应10 ~ 15 min,将热辐射刺激仪热源放在后爪切口旁所在的玻璃板下,测定缩腿潜伏期,即光照开始至发生缩腿反应的时长,持续时间为30 s,保持同一刺激强度,重复测量3 次,取平均值,每次测量间隔5 min。
1.5 大鼠脊髓腰膨大中PX1 蛋白表达水平的检测采用 Western blot 法。于术后 2、4、6、24 h 行为学检测后,各组随机取3 只大鼠,颈椎脱臼处死,立即摘取腰膨大,进行组织匀浆,冰上裂解15 min,16 099 ×g离心30 min;取上清液,经10% SDS-PAGE 分离蛋白后,转移至PVDF 膜,用含5%脱脂奶粉TBST 溶液于室温封闭2 h;加入鼠抗PX1 单克隆抗体及鼠抗GAPDH 单克隆抗体(均 1 ∶800 稀释),室温摇床孵育 1 h,4 ℃孵育过夜;TBST 洗涤 3 次,每次 10 min,加入HRP 标记的山羊抗鼠和山羊抗兔IgG(均1 ∶8 000 稀释),室温摇床孵育 2 h;TBST 洗涤 3 次,每次10 min,加入 ECL 发光液,曝光,应用 Image J 软件测定条带平均光密度值。
1.6 大鼠脊髓星形胶质细胞GFAP 与PX1 共表达情况的检测 采用免疫荧光法。于术后2 h,行为学测试结束后,对照组、模型组、CBX 组、抑制剂组随机各取3 只大鼠,用10%水合氯醛麻醉,暴露心脏并经心尖穿刺主动脉置管,依次灌注生理盐水250 mL和4%多聚甲醛500 mL,暴露并取出腰膨大,浸入4%多聚甲醛过夜;依次浸入20%、30%蔗糖溶液梯度沉底,冰冻切片;室温下风干,用4%多聚甲醛室温固定15 min,PBS 洗涤 3 次,每次 5 min,0.5% TritonX-100室温通透 10 min;PBS 洗涤 3 次,每次 5 min,放入预热95 ℃的柠檬酸钠抗原修复液中,95 ~ 100 ℃温度下加热15 min,取出,冷却后用PBS 洗涤3 次。每组切片分别加入兔抗GFAP 多克隆抗体和鼠抗PX1单克隆抗体(均 1 ∶100 稀释),4 ℃孵育过夜;用 PBS洗涤3 次,每次5 min,加入FITC 标记的山羊抗鼠IgG(H + L)和 TRITC 标记的山羊抗兔 IgG(H + L)(均1 ∶100 稀释),37 ℃孵育 1 h;用 PBS 洗涤 3 次,每次5 min,用 DAPI 溶液进行避光复染 8 min,PBS 洗涤3 次,加入荧光免疫淬灭剂封片,荧光显微镜下观察拍照。
1.7 统计学分析 应用GraphPad Prism 7.0 软件制图,SPSS 20.0 统计软件进行统计学分析,数据结果均采用均数 ± 标准差()表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验。检验经Dunnett分析,若不满足方差齐性,采用Welch ANOVA分析;两两比较采用Games-Howell test。以P< 0.05 为差异有统计学意义。
2 结 果
2.1 行为学的测定
2.1.1 MWT 各组大鼠术前MWT 差异无统计学意义(t= 0.00 ~ 0.40,P> 0.05)。与对照组比较,模型组和生理盐水组术后2、4、6 h 的MWT 明显降低(t= 2.74 ~ 8.36,P< 0.001);与模型组比较,生理盐水组各时间点MWT 差异无统计学意义(t=-0.34 ~ 1.50,P> 0.05),CBX 组及抑制剂组术后2、4 h 的 MWT 均明显升高(t= -10.22 ~ 6.82,P<0.001);与CBX 组比较,抑制剂组各时间点的MWT差异无统计学意义(t= -2.00 ~ 2.16,P> 0.05)。见表1。
表1 不同时间点各组大鼠的 MWT(g,,n = 6)Tab.1 MWTs of rats in various groups at various time points(g,,n = 6)
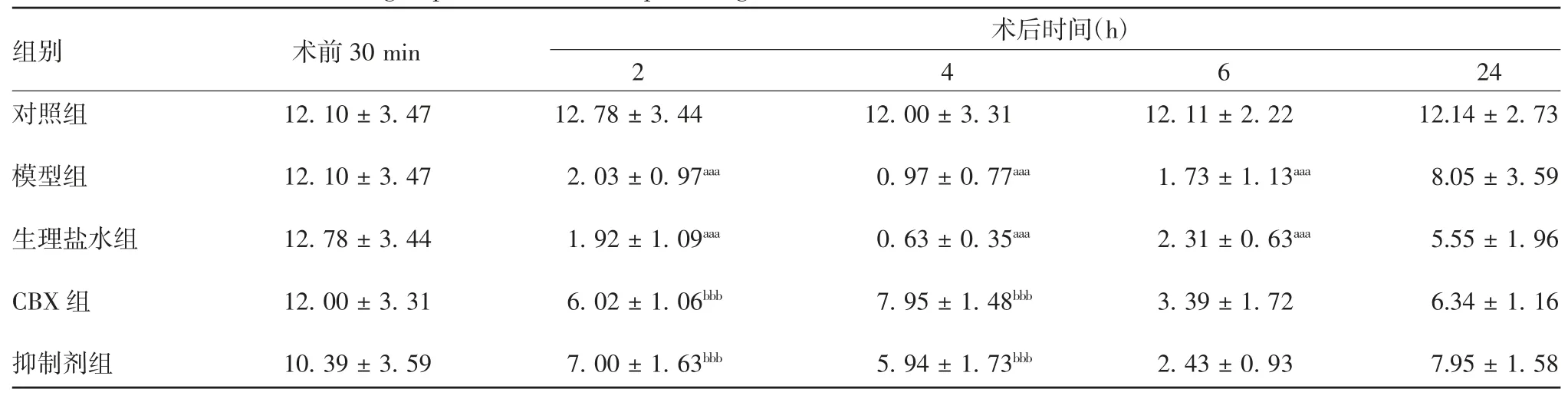
表1 不同时间点各组大鼠的 MWT(g,,n = 6)Tab.1 MWTs of rats in various groups at various time points(g,,n = 6)
注:aaa 表示与对照组比较,P < 0.001;bbb 表示与模型组比较,P < 0.001。
组别 术前组别 术前30 min 24对照组 12.10 ± 3.47 12.78 ± 3.44 12.00 ± 3.31 12.11 ± 2.22 12.14 ± 2.73模型组 12.10 ± 3.47 02.03 ± 0.97aaa 00.97 ± 0.77aaa 01.73 ± 1.13aaa 08.05 ± 3.59生理盐水组 12.78 ± 3.44 01.92 ± 1.09aaa 00.63 ± 0.35aaa 02.31 ± 0.63aaa 05.55 ± 1.96 CBX 组 12.00 ± 3.31 06.02 ± 1.06bbb 07.95 ± 1.48bbb 03.39 ± 1.72 06.34 ± 1.16抑制剂组 10.39 ± 3.59 07.00 ± 1.63bbb 05.94 ± 1.73bbb 02.43 ± 0.93 07.95 ± 1.58术后时间(h)2 4 6
2.1.2 TWL 各组大鼠术前TWL 差异无统计学意义(t= -1.22 ~ 0.00,P> 0.05);与对照组比较,模型组和生理盐水组各时间点的TWL 明显降低(t=5.20 ~ 61.88,P< 0.001);与模型组比较,生理盐水组间的TWL 差异无统计学意义(t= -0.99 ~0.92,P> 0.05),CBX 组及抑制剂组 2、4、6 h 的TWL 均明显升高(t分别为-12.25~3.13 和-12.54~6.92,P< 0.001);与 CBX 组比较,抑制剂组术后 2和 24 h 的 TWL 明显升高(t=-2.77~2.41,P<0.05)。见表2。
表2 不同时间点各组大鼠的 TWL(s,,n = 6)Tab.2 TWLs in various groups at various time points(s,,n = 6)

表2 不同时间点各组大鼠的 TWL(s,,n = 6)Tab.2 TWLs in various groups at various time points(s,,n = 6)
注:aaa 表示与对照组比较,P < 0.001;bbb 表示与模型组比较,P < 0.001;c 表示与 CBX 组比较,P < 0.05。
组别 术前30 min 24对照组 25.13 ± 0.69 24.73 ± 0.81 25.01 ± 0.98 25.14 ± 0.53 24.64 ± 0.68模型组 25.13 ± 0.69 05.54 ± 1.15aaa 03.32 ± 0.36aaa 05.98 ± 0.55aaa 09.17 ± 1.99aaa生理盐水组 24.73 ± 0.81 06.07 ± 0.58aaa 03.32 ± 0.57aaa 06.39 ± 1.32aaa 09.12 ± 0.46aaa CBX 组 25.27 ± 0.69 13.76 ± 3.33bbb 17.08 ± 2.73bbb 13.53 ± 3.73bbb 18.74 ± 0.90抑制剂组 24.68 ± 0.65 18.57 ± 2.64bbb,c 15.82 ± 2.42bbb 13.77 ± 2.70bbb 20.96 ± 2.06c术后时间(h)2 4 6
2.2 大鼠脊髓腰膨大中PX1 蛋白的表达水平 与对照组比较,模型组和生理盐水组术后各时间点PX1的表达水平明显升高(t=-11.97~-4.63,P<0.05);与模型组比较,生理盐水组各时间点的PX1 表达量差异无统计学意义(t=-5.05~0.38,P>0.05),CBX组 2、4、24 h 的 PX1 表达水平明显降低(t= 3.40 ~6.66,P< 0.05),抑制剂组 2、4、6、24 h 的 PX1 表达量明显降低(t= 3.49 ~ 8.89,P< 0.05);与抑制剂比较,CBX 组术后 2、6 h 的 PX1 蛋白表达水平明显升高(t= -4.69 ~ 4.89,P< 0.05),4 h 的PX1 蛋白表达水平明显降低(t= -4.69,P< 0.05)。见图1 和图2。

图1 Western blot 法检测大鼠脊髓腰膨大中PX1 蛋白的表达情况Fig.1 Western blotting of PX1 expression in lumbar segment of the spinal cord of rats
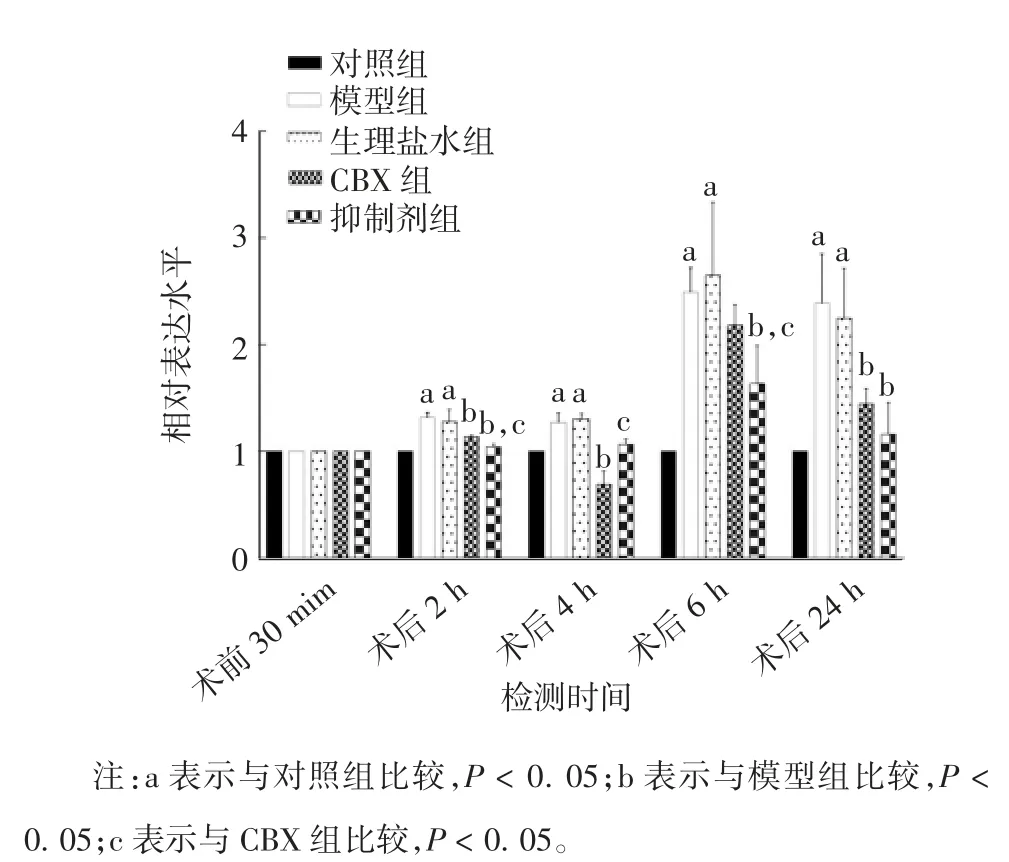
图2 不同时间点各组大鼠脊髓腰膨大中PX1 蛋白的相对表达量Fig.2 Relative expression levels of PX1 in lumbar segment of the spinal cord of rats in various groups at various time points
2.3 大鼠脊髓星形胶质细胞GFAP 与PX1 的共表达模型组的PX1 和星形胶质细胞GFAP 共表达最明显,CBX 组的共表达有所减少,抑制剂组减少最明显,见图3。

图3 免疫荧光法检测各组大鼠脊髓中PX1 与GFAP 的共表达(× 200)Fig.3 IFA of co-expression of PX1 and GFAP in lumbar segment of the spinal cord of rats in various groups(× 200)
3 讨 论
本实验采用Brennan 法建立经典大鼠趾部切口痛模型,以大鼠患肢蜷缩或不能承重为模型建立成功。急性切口痛模型与临床的术后疼痛相似,术后大鼠表现为痛觉过敏、自发性疼痛和诱发性疼痛。本实验结果表明,模型组大鼠术后24 h 的MWT 呈降低趋势,以术后4 h 最为明显,与本课题组前期相关实验结果一致[12]。有研究表明,CBX 主要用于缓解各种神经病理性疼痛及炎性痛,同时参考多项研究结果,确定本实验中CBX 及其抑制剂10 panx 的浓度分别为 0.6 和 1.25 μg / 10 μL[13-15]。
本实验结果显示,与术前比较,模型组和生理盐水组术后24 h 内PX1 的表达水平明显增加,以术后6、24 h 最明显(P< 0.05);免疫荧光结果显示,与对照组比较,模型组的PX1 和星形胶质细胞GFAP的共表达明显,表明PX1 在急性疼痛的产生及维持过程中具有重要作用。行为学结果显示,鞘内注射CBX 后,大鼠术后 2、4 h 的 MWT 明显升高(P<0.05);Western blot 结果显示,术前鞘内注射CBX 能够明显减少PX1 的表达量,以术后4 h 阻断效应最为明显(P< 0.05);免疫荧光显示,CBX 组术后 2 h 的 PX1和GFAP 的共表达有所减少,证明鞘内注射CBX能够通过减少PX1 的表达量及星形胶质细胞的活化,从而缓解急性疼痛。
综上所述,脊髓背角星形胶质细胞表面的PX1在急性疼痛的产生及持续中发挥着重要作用,为后续研究新型镇痛药物提供了新的靶点。鞘内注射CBX 能通过抑制PX1 及胶质细胞的活化而明显缓解急性疼痛,但其镇痛效果短暂,需多次鞘内注射给药或鞘内置管持续给药以维持其效果。
