磷脂酰肌醇蛋白聚糖1 表达对肺腺癌A549 细胞增殖、凋亡及周期的影响
2021-10-20崔营营李诗扬赵雅男迪力娜尔艾尔肯刘倩倩陈玉丙
崔营营,李诗扬,赵雅男,迪力娜尔·艾尔肯,刘倩倩,陈玉丙
1.江苏省苏北人民医院功能检查科,江苏扬州225000;2.吉林省肿瘤医院放疗一科,吉林长春130000;3.吉林大学第二医院肿瘤放疗科,吉林长春130000
国际癌症研究机构(International Agency for Research on Cancer,IARC)2020 年报告显示,肺癌以11.4%的比例成为全球第二大癌症,并成为癌症相关死亡的主要原因。非小细胞肺癌(non small cell lung cancer,NSCLC)约占全部肺癌病例的 80% ~85%[1],目前对于 NSCLC 的治疗,逐渐形成手术、放化疗、分子靶向治疗、免疫治疗的多学科综合治疗模式。但因放射抵抗及化疗、靶向耐药等,肺癌转移和复发仍是临床面临的严峻挑战,其5 年生存率仅为15%[2]。因此,迫切需要寻找新的作用靶点来开发NSCLC 的新型治疗模式。
磷脂酰肌醇蛋白聚糖(glypican,GPC)是一组细胞表面糖蛋白,其基因家族在整个动物物种中广泛表达,并可作为调节细胞生长、运动和分化的多种信号分子的共受体。GPC1是GPC基因家族的成员之一,其在胰腺癌、胶质母细胞瘤等多种恶性肿瘤中过表达,并与肿瘤的发生、进展及不良预后相关[3-6]。NSCLC 中同样检测到GPC1 的高表达,并与患者的恶性程度及不良预后相关,且在放化疗后表达水平显著降低[7-8]。表明GPC1 在NSCLC 的发生及进展中发挥重要作用,有望成为NSCLC 新的肿瘤标志物及治疗靶点。
细胞周期、凋亡等细胞途径是主要的致癌信号传导途径,但在细胞水平上探讨GPC1 对NSCLC 作用的途径特征及作用方式的研究较少。本研究以肺腺癌A549 细胞为研究对象,通过转染GPC1干扰载体下调GPC1 的表达,进而探讨GPC1 表达对A549细胞增殖及凋亡的影响,为GPC1 作为肺癌重要参考靶点,开发新的治疗方案提供试验依据。
1 材料与方法
1.1 主要试剂及GPC1shRNA 肺腺癌A549 细胞株购自中科院上海细胞生物学研究所细胞库;HDMEM 培养基和脂质体Lipofectamine 2000 购自美国Gibco Life Technologies 公司;细胞周期与凋亡检测试剂盒和细胞增殖与毒性检测试剂盒购自上海七海复泰生物科技公司;BCA 蛋白定量试剂盒购自北京博迈德科技发展公司;兔抗GAPDH 多克隆抗体和兔抗GPC1 多克隆抗体购自美国Abcam 公司;HRP Goat anti-Rabbit IgG 购自武汉爱博泰克生物科技公司;GPC1shRNA 套餐(载体类型:pGPU6 /GFP /Neo):shRNA-1(CCCTGACTATTGCCGAAAT)、shRNA-2(GGGACACTGTGCAGTGAGA)、shRNA-3(GCCGGAAGGTCAGCAGGAA)、shRNA-4(GTGCCAACCTGCACCTGGA)、阴性对照(无意义 shRNA 序列)、阳性对照(针对GAPDH的shRNA)均购自苏州吉玛基因有限公司。
1.2 细胞培养 用H-DMEM 培养基 + 胎牛血清 +青霉素 / 链霉素双抗配置完全培养基(比例为100 ∶10 ∶1),于 37 ℃,5% CO2细胞培养箱中常规培养A549 细胞。
1.3 细胞转染及GPC1干扰载体的筛选 取对数生长期的 A549 细胞,按 2 × 105个 / 2 mL 的密度接种于6 孔细胞培养板,当细胞生长至孔板面积80%时弃去培养基,分别用250 mL 不完全培养基稀释2 μg质粒和4 μL 脂质体,静置5 min 后将二者混匀,在室温下孵育20 min 后加至培养孔内,于37 ℃,5%CO2培养箱中继续培养6 h 后,更换为含双抗的完全培养基。将转染不同GPC1shRNA 序列质粒的A549细胞分别设为 GPC1-shRNA1、GPC1-shRNA2、GPC1-shRNA3、GPC1-shRNA4 组,转染无意义 shRNA 序列质粒的A549 细胞设为阴性对照组(shNC 组),转染GAPDHshRNA 序列质粒的A549 细胞设为阳性对照组(GAPDH 组),未转染的A549 细胞设为空白对照组(NC 组),每组均设3 个平行样。转染后继续培养48 h,荧光倒置显微镜观察细胞转染情况及生长状态,收集细胞,提取RNA,采用Real time PCR 检测各组细胞GPC1mRNA 的表达,筛选沉默效率最高的干扰载体,后续试验将转染该组的A549 细胞设为GPC1沉默组(shGPC1 组)。
1.4 转染GPC1干扰载体后A549 细胞中GPC1 表达的检测
1.4.1 细胞分组及转染 将对数生长期的A549 细胞分为 3 组:shGPC1、NC 和 shNC 组,按 1.3 项转染相应质粒,每组设3 个平行样。转染后继续培养48 h,收集细胞,检测GPC1mRNA 及蛋白的表达。
1.4.2GPC1mRNA 表达的检测 采用Real time PCR法。提取各组细胞RNA,逆转录成cDNA,以其为模板,进行Realtime PCR。反应体系:9μL ddH2O,12.5 μL SYBR Premix Ex taqⅡ(2 ×),0.5 μL ROX Reference DyeⅡ(50×),上下游引物各 1 μL(100 pmol / L),1 μL cDNA。置于PCR 仪进行PCR 扩增反应,采用NCBI-primer-blast 设计GPC1引物,F:5′-GTGGCCAGCGACGTGGT C-3′,R:5′-AGGCAGTGAGCACAGTAGACC-3′。引物由生工生物工程(上海)股份有限公司合成。记录各组Ct值,采用 2-ΔΔCt法计算各组细胞中GPC1mRNA 的相对表达水平。
1.4.3 GPC1 蛋白表达的检测 采用Western blot法。各组细胞中加入适量的蛋白裂解液,置于-70 和37 ℃条件下各1 h。用BCA 蛋白定量试剂盒对样品蛋白进行定量,经12% SDS-PAGE 分离后,转移至PVDF 膜上,加入封闭液,37 ℃水平摇床孵育1 h;加入一抗(1 ∶700 稀释),于 4 ℃冰箱过夜;TBST 缓冲液洗膜 3 次,加入二抗(1 ∶1 000 稀释),37 ℃水平摇床孵育1 h;PBS 缓冲液洗膜3 次,加入ECL 显色液,置化学发光仪内显色,用Image J 检测灰度值。
1.5 沉默GPC1表达对A549 细胞增殖影响的检测采用CCK8 试验。取对数生长期的A549 细胞,按2 × 103个 /(100 μL·孔)接种至 96 孔细胞培养板培养过夜,将细胞分为 shGPC1、NC、shNC 组,同时设无细胞的空白对照孔,每组6 个平行样。细胞转染质粒后继续培养48 h。每孔加入10 μL 7sea-Cell Counting kit,轻轻吹打混匀,避免产生气泡,培养箱中孵育2 h,酶标仪450 nm 处检测吸光度值(A),并按下式计算细胞抑制率。

1.6 沉默GPC1表达对A549 细胞凋亡和细胞周期影响的检测
采用流式细胞术。取对数生长期的A549 细胞,按 2 × 105个 /(2 mL·孔)接种至 6 孔细胞培养板培养过夜,将细胞分为 shGPC1、NC、shNC 组,每组 3个平行样。转染质粒后继续培养48 h,分别收集各组细胞检测细胞凋亡及细胞周期。
1.6.1 细胞凋亡检测 各EP 管加入400 μL 缓冲液、5μLAnnexinV,充分混匀,室温条件下避光孵育15 min;加入 10 μL 碘化丙啶 PI,冰上孵育 5 min,30 min 内上流式细胞仪检测。
1.6.2 细胞周期检测 各EP 管中的细胞沉淀用预冷的1 mL 70%乙醇轻轻混匀,4 ℃固定过夜;PBS 洗涤后收集细胞,加入细胞周期缓冲液500 μL(1 mL缓冲液、25 μL 碘化丙啶 PI、20 μL RNase A),轻轻混匀,37 ℃,避光温育30 min;5 h 内上流式细胞仪检测激发波长488 nm 处的红色荧光。
1.7 统计学分析 采用IBM SPSS Statistics 21 软件进行统计学分析,实验数据以平均值 ± 标准差()表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1GPC1干扰载体的筛选 Real time PCR 检测显示,GPC1-shRNA3 组 A549 细胞中GPC1mRNA 的表达水平最低,且较NC 组和shNC 组显著降低(F=76.117,P< 0.001),见图 1。倒置荧光显微镜下观察显示,转染GPC1干扰载体的A549 细胞生长状态良好,可见绿色荧光蛋白表达,转染效率较高,见图2。筛选出沉默效率最高的GPC1-shRNA3 进行后续试验。

图1 各组A549 细胞中GPC1 mRNA 的表达水平Fig.1 Expression levels of GPC1 mRNA in A549 cells of various groups
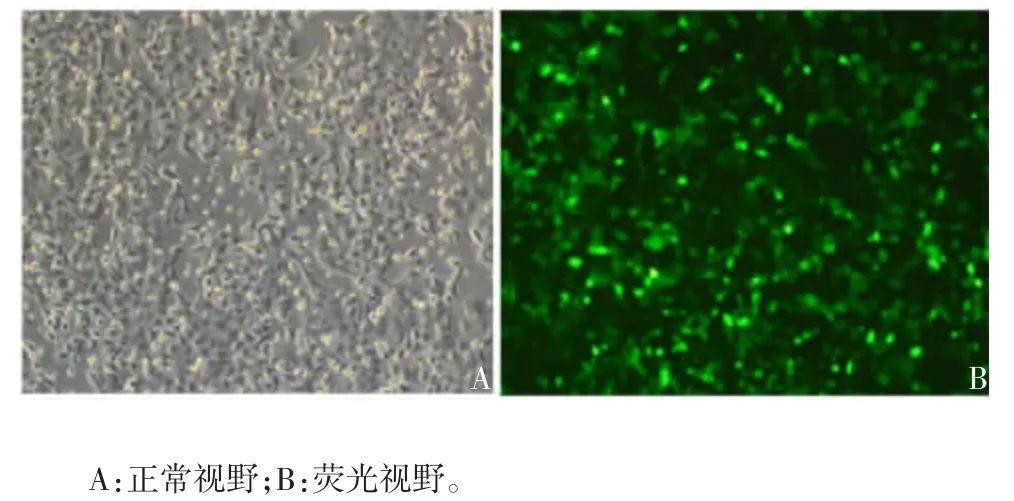
图2 A549 细胞转染GPC1 shRNA 质粒48 h 的荧光显微镜观察(× 200)Fig.2 Fluorescent microscopy of A549 cells 48 h after transfection with GPC1 shRNA plasmid(× 200)
2.2 转染GPC1干扰载体后A549 细胞中GPC1 的表达
2.2.1GPC1mRNA 的表达 Real time PCR 结果显示,与 NC 组和 shNC 组比较,shGPC1 组 A549 细胞中GPC1mRNA 的表达水平显著降低(F= 24.714,P= 0.001),NC 组与 shNC 组差异无统计学意义(F= 24.714,P= 0.671);转染GPC1shRNA 可沉默A549 细胞中GPC1mRNA 的表达,沉默效率可达64%。见表1。
2.2.2 GPC1 蛋白的表达 Western blot 结果显示,与 NC 组和 shNC 组比较,shGPC1 组 A549 细胞中GPC1 蛋白的表达水平亦显著降低(F= 24.714,P=0.001),NC 组与 shNC 组差异无统计学意义(F=24.714,P= 0.321);转染GPC1shRNA 可沉默 A549细胞中GPC1 蛋白的表达,沉默效率达48%。见图3和表1。

图3 Western blot 分析各组A549 细胞中GPC1 蛋白的表达Fig.3 Western blotting of expression of GPC1 protein in A549 cells of various groups
表1 各组 A549 细胞中 GPC1 mRNA 和蛋白的表达(,n = 3)Tab.1 Expressions of GPC1 mRNA and protein in A549 cells of various groups(,n = 3)

表1 各组 A549 细胞中 GPC1 mRNA 和蛋白的表达(,n = 3)Tab.1 Expressions of GPC1 mRNA and protein in A549 cells of various groups(,n = 3)
注:aa 表示与 NC 组和 shNC 组比较,P < 0.01。
组别mRNA 相对表达量(2-ΔΔCt)蛋白相对表达量NC 1.010 ± 0.176 1.007 ± 0.013 shNC 1.060 ± 0.112 0.992 ± 0.025 shGPC1 0.366 ± 0.112aa 0.517 ± 0.011aa
2.3 沉默GPC1表达对A549 细胞增殖的影响 CCK8试验结果显示,shGPC1、NC 和 shNC 组 A549 细胞的A450值分别为(0.756± 0.003)、(1.266± 0.005)和(1.255 ± 0.003),与 NC 组及 shNC 组比较,shGPC1组A549 细胞的生长明显受到抑制(F= 35 620.284,P<0.001),细胞抑制率分别可达40.32%和39.82%。
2.4 沉默GPC1表达对A549 细胞凋亡的影响 流式细胞术检测结果显示,与NC 组及shNC 组比较,shGPC1 组A549 细胞凋亡率分别增加9.9%和9.06%,差异均有统计学意义(F= 1 048.334,P< 0.001),见图4 和表2。
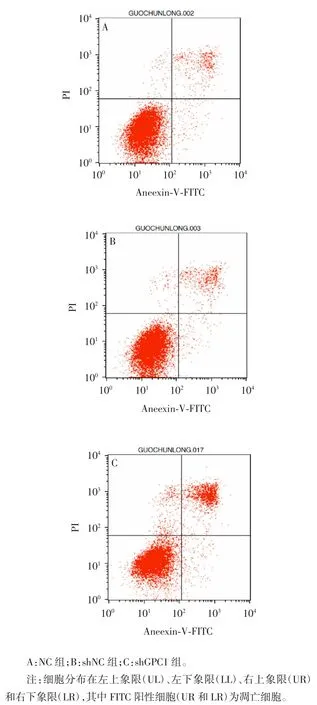
图4 流式细胞术检测各组A549 细胞凋亡率Fig.4 Flow cytometry of apoptosis rates of A549 cells in various groups
2.5 沉默GPC1表达对A549 细胞周期的影响 流式细胞术检测结果显示,与NC 组及shNC 组比较,shGPC1 组 A549 细胞 G2/M 期比例分别增加 16.01%和15.07%,差异均有统计学意义(F= 3 301.016,P< 0.001),见图 5 和表 2。
表2 各组 A549 细胞的凋亡率及处于 G1、S、G2/ M 期的比例(%,,n = 3)Tab.2 Percentages of A549 cells in G1,S and G2 / M phases in various groups(%,,n = 3)

表2 各组 A549 细胞的凋亡率及处于 G1、S、G2/ M 期的比例(%,,n = 3)Tab.2 Percentages of A549 cells in G1,S and G2 / M phases in various groups(%,,n = 3)
注:aaa 表示与 NC 组比较,P < 0.001;与 shNC 组比较,b 表示 P < 0.05,bbb 表示 P < 0.001。
细胞周期比例G1 S G2/ M NC 4.93 ± 0.12 91.27 ± 0.60 5.17 ± 0.67 3.57 ± 0.18 shNC 5.77 ± 0.19 89.01 ± 0.13 6.49 ± 1.33 4.51 ± 0.32 shGPC1 14.83 ± 0.46aaa,bbb 75.82 ± 0.44aaa,bbb 4.60 ± 0.61b 19.58 ± 0.29aaa,bbb组别 细胞凋亡率

图5 流式细胞术检测各组A549 细胞周期Fig.5 Flow cytometry of cell cycles of A549 cells in various groups
3 讨 论
细胞外信号可显著调节癌症的特征[9-10],在癌症发展中发挥重要作用。GPC1 属于硫酸乙酰肝素蛋白聚糖(heparan sulfate proteoglycan,HSPG)家族成员,主要存在于细胞表面和细胞外基质,对生长因子信号的转导起调节作用。目前已证实,GPC1 在肺癌等多种恶性肿瘤中呈现高表达,其参与肿瘤的发生及进展,介导肿瘤对化疗药物的耐受。但对于GPC1表达在NSCLC 中的作用途径及机制研究较少。
本研究以肺癌A549 细胞为基础,通过转染GPC1干扰载体成功沉默GPC1 表达,进而探究GPC1 表达对A549 细胞增殖、凋亡及周期进程的影响。结果显示,shGPC1 组A549 细胞的增殖明显受到抑制,抑制率可达40.32%。有报道在人角质形成细胞、胰腺癌细胞系中也观察到类似现象[11-12],当下调这些细胞系中GPC1 的表达时,细胞生长受限。推测GPC1可增强细胞对生长因子的反应,促进细胞增殖,当下调其表达时,可表现出对细胞增殖的抑制,使细胞生长速率明显下降。细胞凋亡结果显示,shGPC1组细胞的凋亡率较NC 组及shNC 组显著增加(P<0.05),即沉默GPC1 表达可进一步促进A549 细胞凋亡。在食管鳞癌细胞(esophageal squamous cell carcinoma,ESCC)中同样出现该结果,同时发现,GPC1高表达时,细胞中caspase-3 的活化显著降低,下调GPC1 表达后,促凋亡蛋白Bim 和Bik 的表达水平增高,同时抗凋亡蛋白Bcl-w 的表达水平下降,进而促进 ESCC 细胞的凋亡[13]。由此可见,GPC1 抑制肿瘤细胞凋亡的作用途径可能是活化抗凋亡相关基因的同时抑制凋亡相关基因及蛋白的表达,具体机制有待进一步研究。
沉默GPC1表达可抑制A549 细胞增殖、促进其凋亡,推测可能与抑制有丝分裂的发生相关。本研究发现,与 NC 组比较,shGPC1 组 A549 细胞的 G1期及S 期比例下降,而G2/M 期比例增加16.01%(P<0.001),即沉默GPC1 表达使A549 细胞被阻滞在G2/M 期,影响其正常有丝分裂的进行。从另一角度分析,放射抵抗是造成NSCLC 患者放疗失败的常见原因。细胞周期在不同时相具有不同的辐射敏感性,S 期、G0/ G1期和 G2/ M 期的细胞分别具有抗辐射性、相对辐射敏感性和辐射敏感性[14],因此,调控细胞周期成为影响辐射敏感性的重要因素。本研究发现,沉默GPC1 表达后,引起A549 细胞阻滞在G2/ M 期,该期的放射敏感性较高,考虑下调GPC1表达可增强NSCLC 的放射敏感性。有报道已证实,M2-型丙酮酸激酶基因敲除后,显著增加了处于G2/M 期的细胞比例,促进了细胞凋亡[15],从而提高了放射敏感性。另有研究发现,沉默Ⅱ型跨膜丝氨酸蛋白4 表达引起细胞在G2/ M 期的阻滞,从而提高了细胞的凋亡能力,进一步提高了三阴性乳腺癌的放射敏感性[16]。因此,靶向GPC1 与放射治疗联合可能提高NSCLC 的放射敏感性,需进一步实验进行验证,为开发新型NSCLC 治疗方案提供理论基础。
综上所述,本研究发现,沉默A549 细胞GPC1的表达可显著抑制细胞增殖,促进细胞凋亡,并引起细胞发生G2/ M 期阻滞,为以GPC1 作为重要的参考靶点来研发新的靶向治疗药物提供了参考,也为探索新型NSCLC 治疗方案提供了思路。
