1 株高滴度噬斑型三型副流感病毒野毒株的分离纯化及鉴定
2021-10-20火文关文竹王云瑾韩平马超包红寇桂英李雄雄巩晗博白慕群
火文,关文竹,王云瑾,韩平,马超,包红,寇桂英,李雄雄,巩晗博,白慕群
1.兰州生物制品研究所有限责任公司甘肃疫苗工程技术研究中心,甘肃兰州730046 2.阿尔伯塔大学理学院,阿尔伯塔省加拿大T6G2R3
人三型副流感病毒(human parainfluenza virus type 3,HPIV-3)是仅次于呼吸道合胞病毒的、引起5岁以下婴幼儿急性下呼吸道严重疾病的病原体,主要可致婴幼儿肺炎和支气管炎[1]。每年均会出现HPIV-3 的暴发,主要发生在春夏两季[2-4]。急性呼吸道感染住院患儿中HPIV-3 感染非常普遍,流行病学研究显示,HPIV-3 感染的患者中80%均是5 岁以下婴幼儿[5],造成了较大的疾病和经济负担。有研究显示,美国2011—2019 年间共检测了2 700 万份下呼吸道感染住院患儿的下呼吸道标本,HPIV-3 阳性标本超过67 000 份,阳性率为2.5%[6]。中国湖南一项下呼吸道感染住院患儿副流感病毒感染的流行病学调查结果显示,HPIV-3 感染率为13.8%[7]。中国广州一项流行病学调查显示,2009—2016 年间,下呼吸道感染住院患儿中HPIV-3 的感染率为4.4%[8]。另外,HPIV-3 感染还是导致老年慢性病患者和免疫力低下成年人下呼吸道疾病和死亡的重要原因[9],在器官移植和免疫抑制患者中,HPIV-3 感染导致的死亡率在3% ~ 47%不等[10-11]。至目前为止,尚无治疗HPIV-3 感染的特效药物和预防性疫苗上市,因此疫苗的开发研究非常必要。本研究分离出1 株可在体外长期传代的高滴度HPIV-3 病毒株,为HPIV-3疫苗的研发以及动物模型和检测方法的建立奠定了基础。
1 材料与方法
1.1 临床标本 下呼吸道感染住院患儿下呼吸道分泌物标本2 037 份,由甘肃省妇幼保健医院收集并提供;下呼吸道分泌物标本3 000 份,由甘肃省疾控中心收集并提供。均收集于预先装有2 mL DMEM培养基的离心管中,-80 ℃冻存备用。
1.2 细胞 人胚肺二倍体成纤维细胞(WI-38)、非洲绿猴肾细胞(Vero)、恒河猴肾细胞(MA104)均由兰州生物制品研究所有限责任公司第二研究室保存并提供。
1.3 主要试剂及仪器 DMEM /MEM /RPMI1640 细胞培养基购自美国Gibco 公司;胰酶、低熔点琼脂糖购自美国Sigma 公司;RNA 提取试剂盒RNeasy mini kit 购自美国 Qiagent 公司;one-step PrimeScript RTPCR Kit(RR055A)、one-step PrimeScript real-time RTPCR Kit(RR064A)和Ex TaqE(DRR100B)购自宝生物工程(大连)有限公司;去支原体抗生素Plasmocin购自美国Invivogen 公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG、FITC 标记的兔抗羊IgG(A16143)、羊抗HPIV-3 全病毒抗体(PA1-73041)购自美国Thermo Fisher 公司;兔抗重组HPIV-3 HN 蛋白多克隆抗体和兔抗重组F 蛋白多克隆抗体由兰州生物制品研究所有限责任公司第二研究室制备;Western blot 显色底物Lumi-Light Western blotting substrate和凝胶成像仪购自美国GE 公司;细胞培养板、细胞培养瓶和两层细胞工厂均购自美国Corning 公司;实时定量PCR 扩增仪购自美国AB 公司;PCR 扩增仪购自美国BIO RAD 公司;Casy 细胞计数仪购自德国INNOVATIS 公司。
1.4 HPIV-3 培养液RNA 提取 用RNeasy mini kit进行提取,具体操作按试剂盒说明书进行。取病毒培养液 150 μL,加入 RLT 裂解缓冲液 150 μL,β-巯基乙醇3 μL,充分混匀,冰盒静置5 min;加入冷75%乙醇300 μL,混匀;RNA 提取试剂盒提取RNA,4 ℃保存备用。
1.5 HPIV-3 nest-RT-PCR 检测 引物由兰州生物制品研究所有限责任公司第二研究室自行设计及验证。RT-PCR 上游引物 BPIS:5′-aaactcagacttggtacctgac-3′,下游引物 BPIA:5′-gaattgagtttaagcccttgtc-3′,产物长度510 bp。具体操作按one-step PrimeScript RTPCR kit 试剂说明书进行。RT-PCR 反应体系:2 ×One Step Buffer 10 μL,PrimeScriptOne Step Enzyme Mix 0.4 μL,BPIS 0.4 μL,BPIA 0.4 μL,RNA 8.8 μL,共 20 μL。RT-PCR 反应条件:48 ℃ 30 min;94 ℃2 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,共 30 个循环;72 ℃ 5 min。nest-PCR 上游引物 BPISn:5′-atcaactgtgttcgactccc-3′,下游引物 BPIAn:5′-accaaggactatgagatgcc-3′,产物长度 300 bp。具体操作按 Ex TaqE 试剂说明书进行。nest-PCR 反应体系:10 × PCR buffer 2 μL,dNTP Mixture(各 2.5 mmol / L)1.6 μL,BPISn(10 pmol / μL)0.4 μL,BPIAn(10 pmol / μL)0.4 μL,Ex TaqE 0.1 μL,RT-PCR 产物 2 μL,去离子水补至 20 μL。nest-PCR 反应条件:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 30 s,共 30 个循环;72 ℃5 min。引物由宝生物工程(大连)有限公司合成。
1.6 临床标本的传代培养 取出-80 ℃冻存的标本,室温融化,涡旋振荡2 min,吸入1.5 mL 离心管中,14 000 ×g离心 20 min;收集上清液,用针式滤器除菌过滤,接种至生长有WI-38 细胞的6 孔板中,37 ℃孵育2 h;弃上清,加入3 mL DMEM 培养基,37 ℃,5% CO2培养箱培养7 d;孔对孔连续传代10次,进行RT-PCR 检测。取HPIV-3 呈阳性的培养孔,进行滴度测定,将阳性、高滴度病毒株继续进行噬斑克隆。
1.7 HPIV-3 阳性培养物的噬斑克隆纯化 将10 次连续传代培养的HPIV-3 阳性培养上清液进行10 倍系列稀释(10-1~ 10-8倍),分别接种至生长MA104、WI-38 和 Vero 细胞的 6 孔板上,10-3~ 10-8每个稀释度接种 1 孔,1 mL / 孔,37 ℃,5% CO2细胞培养箱培养2 h;弃上清液,加入用DMEM 配制的0.8%低熔点琼脂糖,3 mL / 孔,室温凝固后,倒置于 37 ℃,5% CO2细胞培养箱培养4 d;加入用含中性红的DMEM 配制的1%低熔点琼脂糖,室温凝固,倒置于37 ℃,5% CO2细胞培养箱培养24 h;尽量在高稀释度孔中挑取蚀斑,接种至24 孔板同种细胞上,37 ℃,5% CO2细胞培养箱培养 7 d。RT-PCR 法检测HPIV-3 阳性克隆培养物,重复克隆5 次。挑取噬斑克隆滴度最高的克隆毒株进行外源因子检测。
1.8 克隆毒株的外源因子检测 用巢式RT-PCR 法检测纯化后克隆毒株中的鼻病毒、腺病毒、呼吸道合胞病毒、H1N1 甲型流感病毒、H2N3 甲型流感病毒、乙型流感病毒和支原体。检测引物由兰州生物制品研究所有限责任公司第二研究室自行设计,引物序列见表1,并通过阳性培养物验证。引物由宝生物工程(大连)有限公司合成。

表1 外源因子检测用引物序列Tab.1 Sequences of primers for detection of adventitious agents
1.9 支原体的去除及病毒稳定性检测 将高滴度克隆纯化的HPIV3LZ1728C19 病毒株以0.05 MOI 接种至 Vero 细胞上,用含 10 μg /mL Plasmocin 的MEM培养基于37 ℃,5% CO2培养箱培养7 d。每代取病毒培养液提取RNA,TaqMan 探针Real-Time RT-PCR法测定病毒滴度;提取病毒培养液DNA,巢式PCR法测定病毒培养液支原体(引物序列同1.8 项)。以相同的MOI 传代直至支原体检测阴性。同时每5代测定病毒HN和F基因核苷酸序列,比较其氨基酸的同源性。
1.10 最适宿主细胞的确定 WI-38、MA104 和Vero细胞计数:用含EDTA 的2.5%胰酶消化Vero 和MA104 细胞1 ~ 2 min,用含5% ~ 10%胎牛血清的MEM 和RPMI1640 培养液吹打分散;用不含EDTA的2.5%胰酶消化WI-38 细胞20 ~ 30 s,用含10%胎牛血清的DMEM 培养液吹打分散。用Casy 细胞计数仪计数细胞浓度,计算总细胞数。HPIV3LZ1728-C19 接种:按照0.05 MOI 分别接种至100%铺满WI-38、MA104 和 Vero 细胞的 T25 细胞瓶内,37 ℃,5%CO2细胞培养箱培养2 h;弃上清液,每瓶加入10 mL细胞培养液,37 ℃,5% CO2细胞培养箱继续培养。每天倒置显微镜下观察细胞病变,并取样,采用TaqMan探针Real-Time RT-PCR 法检测病毒滴度,绘制病毒增殖曲线,直至90%细胞病变脱落。
1.11 HPIV-3 病毒培养液的大量制备 将克隆纯化去除特定外源因子的HPIV3LZ1728C19 以0.05 MOI接种二层 WI-38 细胞工厂,37 ℃,5% CO2培养箱培养7 d,收集上清液,TaqMan 探针Real-Time RT-PCR法检测病毒滴度,-80 ℃冻存。
1.12 HPIV-3 病毒滴度测定 采用TaqMan 探针Realtime RT-PCR 法。引物由兰州物制品研究所有限责任公司第二研究室自行设计,引物(HNRealS/HNRealA)和探针(HNProbe)(序列未公布)位于HPIV-3 的HN基因上。使用Primer 5 设计引物,Primer Ex-press 3.0验证引物 / 探针退火温度,Blast 验证引物特异性。用one-step PrimeScript RT-PCR Ki(tRR064A)完成。RT-PCR 反应体系:2 × one step RT-PCR bufferⅢ10 μL,TaKaRa Ex TaqHS(5U / μL)0.4 μL,Prime Script RT Enzyme MixⅡ0.4 μL,HNRealS(10 pmol / μL)0.6 μL,HNRealA(10 pmol / μL)0.6 μL,HNProbe(10 pmol / μL)0.2 μL,ROX Reference Dye(50 ×)0.4 μL,RNase free H2O 5.4 μL,RNA 2 μL。RNA标准品为4.7 × 100~ 4.7 × 107copies /μL 的体外转录HPIV-3 HN RNA。RT-PCR 反应条件:Stage 1 Reverse transcription Reps,42 ℃ 5 min;Stage 2,95 ℃10 s;Stage 3 PCR Reps:40 times,95 ℃ 5 s,57 ℃34 s,57 ℃进行荧光信号采集。
1.13 HPIV-3 病毒超速离心纯化 将HPIV3LZ172 8C19 病毒培养液于 4 ℃,11 000 ×g离心 30 min;沉淀细胞碎片,收集上清液,取50 mL 加至70 mL 专用离心管中,用8 cm 长针头从底部轻轻推入20 mL 50%蔗糖(保持界面清晰),4 ℃,140 000 ×g超速离心4 h;弃上清液,用无菌TNE Buffer 重悬沉淀,电子显微镜下观察病毒形态(由兰州大学电镜中心完成)。
1.14 HPIV3LZ1728C19 病毒外壳蛋白的鉴定 将超速离心纯化的HPIV3LZ1728C19 病毒蛋白进行12% SDS-PAGE 分析。将凝胶按照标准程序[12]进行Western blot 分析。一抗为兔抗重组HPIV-3HN蛋白多克隆抗体和兔抗重组F 蛋白多克隆抗体(均1 ∶500 稀释),二抗为辣根过氧化物酶(HRP)标记的羊抗兔 IgG(1 ∶1 000 稀释)。用 Lumi-Light Western blotting substrate 显色,凝胶成像仪成像。
1.15 HPIV3LZ1728C19 病毒感染细胞的免疫荧光鉴定 将HPIV3LZ1728C19 病毒以0.05 MOI 感染96 孔板 Vero 及 MA104 细胞,37 ℃,5%CO2培养 48 h;弃上清,加入 80%丙酮,100 μL / 孔,室温 15 min;吸出丙酮,室温干燥 2 h;加入去离子水,100 μL / 孔,室温10 min;去除去离子水,拍干细胞板,加入羊抗HPIV-3 全病毒抗体(1 ∶200 稀释),100 μL / 孔,37 ℃孵育1 h;弃上清,PBST 洗板,加入FITC 标记的兔抗羊 IgG(1 ∶500 稀释),37 ℃孵育 1 h;弃上清,PBST洗板,加入60%甘油,荧光显微镜下观察感染细胞。
1.16 HPIV3LZ1728C19 毒株全基因组核苷酸序列测定 采用二代基因测序法,由上海伯杰医疗科技有限公司完成。
1.17 HPIV3LZ1728C19 毒株基因序列进化分析和进化树绘制 进化树应用NCBI Blast 程序在线完成。传代培养病毒HN、F 蛋白氨基酸同源性比对用La-sergene 软件的MegAlign 模块完成。
2 结 果
2.1 临床标本中HPIV-3 阳性率 临床标本接种WI-38 细胞培养 7 d,RT-PCR(一次 PCR)检测阳性率为 1.45%(73 / 5 037),nest-PCR 检测阳性率为18%(906 / 5 037)。将 73 份 RT-PCR 检测阳性标本经10 次细胞传代培养后,仅2 份标本为HPIV-3阳性(2 / 5037),表明 HPIV-3 感染普遍存在,但能够长期体外传代存活的高滴度病毒株非常稀少。2 份HPIV-3 阳性标本,其中1 株病毒滴度为4.7 ×107copies/mL,命名为HPIV3LZ1728,进行后续研究。
2.2 HPIV3LZ1728 的噬斑克隆纯化结果 10 次细胞传代培养的HPIV3LZ1728 在MA104 和Vero 细胞上均有蚀斑形成,见图1;在WI-38 细胞上无噬斑形成。挑取滴度最高的1 个克隆毒株进行外源因子检测。

图1 HPIV3LZ1728C19 在Vero 和MA104 细胞上的噬斑结果Fig.1 Plaques formed by HPIV3LZ1728C19 on Vero and MA104 cells
2.3 克隆毒株的外源因子检测结果 克隆株除支原体外,其余6 种外源因子检测结果均为阴性,见图2。
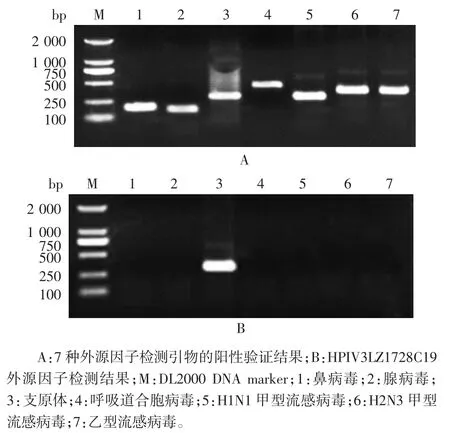
图2 HPIV3LZ1728C19 分离株外源因子检测结果Fig.2 Test for adventitious agents in HPIV3LZ1728C19 isolate
2.4 克隆毒株的去支原体传代结果 随着去支原体传代培养,克隆毒株培养液的支原体PCR 扩增条带逐渐变弱,直至13 代去支原体培养,HPIV3LZ17-28C19 分离株支原体检测为阴性。
2.5 克隆毒株传代的增殖稳定性和遗传稳定性HPIV-3 病毒滴度检测结果显示,HPIV3LZ1728C19克隆株在传代过程中,滴度均无显著变化,1 mL 滴度值在7.5 ~ 8.5 之间,见图3。氨基酸同源性比对结果显示,经过25 代传代培养,F 蛋白氨基酸同源性高于99.4%,HN 蛋白氨基酸同源性高于99.5%,见图4,表明HPIV3LZ1728C19 毒株在有限传代过程中具有遗传和增殖稳定性。

图3 HPIV3LZ1728C19 分离株在Vero 细胞传代过程中的病毒滴度测定Fig.3 Determination of titer of HPIV3LZ1728C19 isolate during subculture in Vero cells
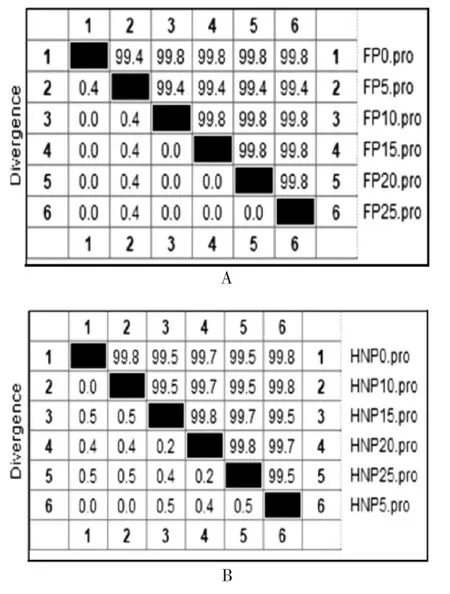
图4 HPIV3LZ1728C19 分离株在Vero 细胞传代过程中的 F(A)和 HN 蛋白(B)氨基酸同源性Fig.4 Homologies of amino acids of F(A)and HN(B)proteins of HPIV3LZ1728C19 isolate during subculture in Vero cells
2.6 HPIV3LZ1728C19 最适宿主细胞及增殖曲线病毒滴度检测结果显示,病毒在3 种细胞上均可产生明显病变,并高滴度增殖,在MA104 细胞上滴度最高,可达 109copies / mL;在 WI-38 和 Vero 细胞上滴度相似,可达 107~ 108copies / mL。见图 5 和图 6。

图5 HPIV3LZ1728C19 在3 种宿主细胞上的病变情况(× 100)Fig.5 CPE of HPIV3LZ1728C19 isolate on WI-38,Vero and MA104 cells(× 100)

图6 HPIV3LZ1728C19 在3 种宿主细胞中的增殖曲线Fig.6 Proliferation curves of HPIV3LZ1728C19 on WI-38,Vero and MA104 cells
2.7 纯化HPIV-3 病毒培养液的电镜观察 电镜下可见长轴径150 ~ 300 nm 的病毒颗粒,且在病毒的外周可见清晰的脂质外膜,见图7。
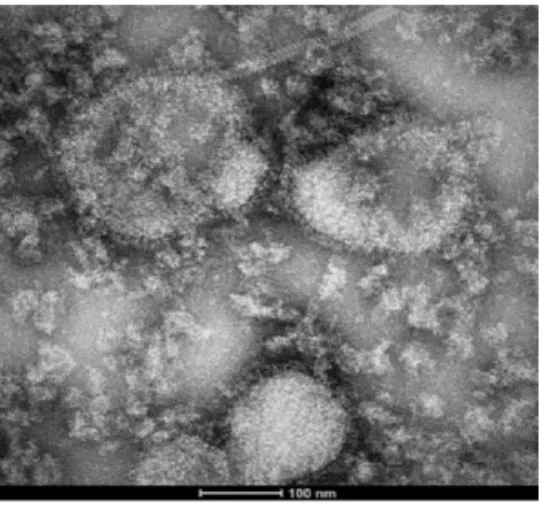
图7 HPIV3LZ1728C19 的电镜图谱Fig.7 Electron micrograph of HPIV3LZ1728C19
2.8 HPIV3LZ1728C19 病毒外壳蛋白的鉴定结果12% SDS-PAGE 分析显示,在磷酸蛋白(PP)、血凝素神经氨酸酶(HN)、融合蛋白(F0)、核蛋白(NP)、Furin 酶切融合蛋白(F1)、基质蛋白(M)的预测相对分子质量大小处均可见清晰的染色条带。Western blot 分析显示,超速离心纯化病毒与重组HPIV-3HN蛋白抗体在预期的相对分子质量(64 000)处出现特异性反应条带;与重组F 蛋白抗体在预期的相对分子质量(60 000)处出现较弱的F0 条带,同时在相对分子质量约50 000 处也出现了更强的反应条带,这与F0 蛋白的Furin 酶切产物F1 的相对分子质量大小一致。表明HPIV3LZ1728C19 毒株具有HPIV-3的HN 和F 蛋白。见图8。

图8 纯化HPIV3LZ1728C19 的 SDS-PAGE(A)和 Western blot(B)分析Fig.8 SDS-PAGE(A)and Western blot(B)profiles of purified HPIV3LZ1728C19
2.9 感染细胞的荧光显微镜观察 HPIV3LZ1728-C19 感染的两种细胞的细胞膜处均有强烈的荧光染色,见图9,表明在Vero 和MA104 细胞中高滴度复制的病毒为HPIV-3。
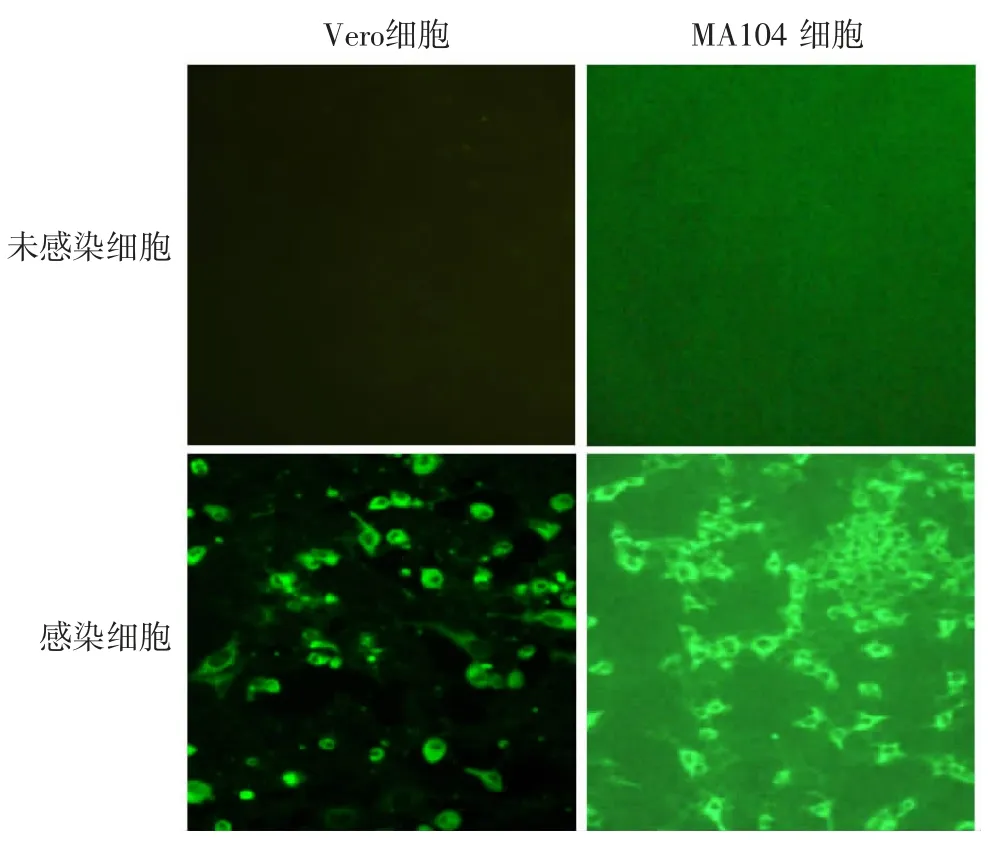
图9 HPIV3LZ1728C19 感染细胞的免疫荧光显微镜观察(× 100)Fig.9 IFA of cells infected with HPIV3LZ1728C19(× 100)
2.10 HPIV3LZ1728C19 分离株全基因组结构特征及进化分析 二代基因测序结果表明,HPIV3LZ-1728C19 株全长基因组含有15 462 个核苷酸。全基因组核苷酸序列比对结果显示,HPIV3LZ1728C19全基因序列与GenBank 上登录的HPIV-3 株HPIV3 /VietNam / 094 / 2010(MH006672.1)同源性最高为99.14%,其次与 HPIV3 / MEX / 2545 / 2006(No.KF-530250)同源性为99.08%。表明HPIV3LZ1728C19毒株的基因组具有HPIV-3 的遗传特征。进化树分析显示,HPIV-3 进化的起源均位于亚洲(MN145875 /杭州、MH006672 / 越南和 HPIV3LZ1728C19)。HPIV3LZ1728C19 处于单独的进化分支,且位于进化分支的上游。其下游的进化病毒株遍布美洲、欧洲和亚洲。见图10。HPIV3LZ1728C19 基因组序列已登录GenBank,收录号为:MT374082。核苷酸序列分析可知,该HPIV3LZ1728C19 株符合副黏病毒科基因组“6 碱基原则”,按照 5′-NP(111-1658)-PP / C(1784-3565)-M(3753-4814)-F(5072-6691)-HN(6806-8524)-L(8571-15347)-3′的顺序编码 6 种蛋白,基因结构与已知序列HPIV-3 分离株相同。氨基酸序列分析显示,HPIV3LZ1728C19 各编码区具有以下特征:NP基因编码1 个516 aa 的蛋白,含有323F-X4-Y-X4-SYAMG337副黏病毒NP 蛋白特征序列;PP基因编码1 个600 aa的蛋白;M基因编码1 个 354 aa 的pI9.58 的碱性蛋白。F基因编码1 个540 aa 的蛋白,肽链上有1个106RTKR109Furin 酶切位点,359NRSQ362、446NNSV449、508NITI512三个糖基化位点,以及490SSTTIIVILIMMIILFIINITIITIAIK517跨膜区域;HN基因编码 1 个 573 aa的蛋白,有252NRKCSC257唾液酸位点,308NISP311和485NPTG488两个糖基化位点;L基因编码 1 个 2 259 aa 的蛋白,有 1 个797GDNQ800RNA 聚合酶活性位点,1 个1811K-X21-G-E-G-A-G1837ATP 结合位点。见表2。HPIV3LZ1728C19 毒株的这些蛋白特征区域均与其他HPIV-3 病毒分离株相同。表明HPIV3LZ1728C19 病毒株是HPIV-3。

图10 HPIV3LZ1728C19 全基因组遗传进化分析Fig.10 Phylogenetic analysis of whole genome of HPIV3LZ1728C19

表2 HPIV3LZ1728C19 各编码区的位置、氨基酸数量以及编码特征结构区域Tab.2 Location,number of amino acids and encoded characteristic domains of encoding regions of HPIV3LZ1728C19
3 讨 论
为了从临床标本中分离1 株可以在体外长期传代的高滴度HPIV-3 野毒株,2005—2017 年间,每年第4 季度至次年第1 季度,兰州生物制品研究所有限责任公司委托甘肃省妇幼保健医院和甘肃省疾病预防控制中心收取下呼吸道感染住院患儿下呼吸道分泌物标本,共计5 037 份。所有标本均接种WI-38 细胞,37 ℃培养 7 d,用 nest-RT-PCR 检测培养上清HPIV-3 RNA,结果显示,RT-PCR 检测阳性率为1.45%(73 / 5 037),nest-PCR 检测阳性率为 18%。表明在甘肃下呼吸道感染住院患儿中HPIV-3 感染非常普遍,且本研究结果显著高于许多报道[2,13],可能是我们将所有样本进行了WI-38 细胞培养,从而使HPIV-3 检出率明显增加。为了进行后续HPIV-3野毒株的分离,将RT-PCR 阳性标本在WI-38 细胞上连续传代10 次,HPIV-3 阳性培养物仅剩下2 个。表明虽然HPIV-3 感染非常普遍,但能够长期体外传代培养的病毒株非常稀少。我们将其中最高滴度的病毒进行噬斑克隆纯化并去除支原体,获得1 株可在体外长期传代的高滴度的无特定外源因子的HPIV-3 野毒株,并命名为HPIV3LZ1728C19。
对于HPIV-3 的分离,常用的细胞基质有人胚肺成纤维细胞、人喉癌细胞(Hep-2)、Vero 细胞、Madin-Darby 犬肾细胞、人黑色素瘤细胞(HMV-Ⅱ)、恒河猴肾细胞等[14]。为了后续疫苗的研发,我们选取了WHO许可的人用疫苗细胞基质WI-38 和Vero 细胞[15],进行了阳性标本的筛选和分离,结果显示,HPIV3LZ-1728C19 感染的WI-38 和Vero 细胞,均可产生显著的细胞病变,并且高度增殖,滴度可达1×107copies/mL以上;在Vero 细胞上可形成清晰的噬斑,但在WI-38 细胞上无噬斑出现,这可能与细胞的形态有关。WI-38 细胞是细长的梭状不规则形态,而Vero 细胞则为相对规则均一的橘子瓣形态,有利于噬斑形成。由于细胞表面含有唾液酸受体,MA104 细胞常用于轮状病毒的分离培养[16]。此细胞具有生长速度快、可连续传代、易于规模化培养等优点。本研究将HPIV3LZ1728C19 在MA104 细胞上进行了培养,发现病毒感染MA104 细胞也可形成明显病变和噬斑,且培养液病毒滴度较在WI-38 和Vero 细胞培养中高2个lg 滴度值,虽然MA104 细胞不是人用疫苗的许可细胞基质,但HPIV3LZ1728C19 可在其中高度增殖并形成噬斑,可用其制备非疫苗用抗原以及建立中和抗体检测方法。后续的研究还表明,HPIV3LZ-1728C19 可感染 BALB / c 小鼠,在小鼠的上下呼吸道显著增殖,造成小鼠肺部的炎症性病理变化,并诱导小鼠产生显著的细胞和体液免疫应答(未发表),以此我们成功地用HPIV3LZ1728C19 病毒株建立了HPIV-3 感染小鼠动物模型,可用于HPIV-3 疫苗保护效力的评价。
HPIV-3 属于副黏病毒科呼吸道病毒属,是一种具有脂膜的单股负链RNA 病毒,基因组全长约15 400 核苷酸,编码 6 个蛋白[17]。核苷酸测序结果显示,HPIV3LZ1728C19 全基因组含有15 462 个核苷酸,与GenBank 上登录的HPIV-3 基因组同源性最高达到99.14%。序列分析显示,基因组编码6种蛋白,基因结构与已知序列HPIV-3 分离株相同,且编码的6 个蛋白均含有HPIV-3 各蛋白的特征功能结构域。表明HPIV3LZ1728C19 具有HPIV-3 的遗传特征。
用HPIV-3 全病毒抗体对HPIV3LZ1728C19 感染细胞进行了免疫荧光染色,结果显示,感染细胞的细胞膜处出现了强烈的荧光信号,表明HPIV3LZ17-28C19 是HPIV-3。蔗糖密度超速离心纯化的HPIV-3LZ1728C19,在电镜下观察到了病毒颗粒,其形态和大小与文献报道一致[17]。纯化病毒的SDS-PAGE分析结果显示,在预期的 NP(57 800)、PP(67 200)、M(39 500)和HN(64 100)蛋白相对分子质量处,出现了清晰的染色条带,而在F 蛋白相对分子质量(59 900)处,仅有微弱的染色条带,但在F 蛋白的Furin 酶切产物F1 相对分子质量(50 000)处,有清晰的染色条带,在L 蛋白预期相对分子质量(259 000)处无明显的染色条带,可能是由于L 蛋白太大,在常规胶浓度(12%)下,蛋白不能进入分离胶。HN 和F 蛋白特异性抗体Western blot 分析结果显示,在相对分子质量64 000 处有强烈的HN 蛋白反应条带,在相对分子质量50 000 处有强烈的F1 蛋白反应条带,在相对分子质量59 900 处仅有轻微的F 蛋白反应条带,证明 HPIV3LZ1728C19 含有 HPIV-3 的 HN 和 F 蛋白,且F 蛋白上有Furin 酶切位点。HN 和F 是HPIV-3的主要的结构蛋白和中和抗原,与病毒对宿主细胞的感染相关[17-18]。在HPIV-3 感染细胞的过程中,HN蛋白与宿主细胞的唾液酸受体结合,F 蛋白被Furin酶切激活后,以由二硫键结合的F1(49 900)和F2(10 000)肽链亚稳态融合前形式存在,并进行一系列的结构重排形成稳定的融合后形式,促进病毒脂膜和细胞膜之间的融合[19]。Western blot 分析结果表明HPIV3LZ1728C19 F 蛋白主要以酶切后F1 的形态存在,这也许就是此株病毒在3 种宿主细胞中可以高滴度增殖的原因。
综上所述,本研究分离纯化了1 株可以在体外传代的高滴度的HPIV-3 野毒分离株HPIV3LZ172-8C19,并对其遗传特性和细胞培养特性进行了鉴定。HPIV3LZ1728C19 毒株为HPIV-3 疫苗的研发以及HPIV-3 感染动物模型和中和抗体滴度检测方法的建立奠定了基础。
