内脂素通过PI3K/Akt/FoxO1信号通路对糖尿病KKAy小鼠骨骼肌糖脂代谢及胰岛素抵抗的影响
2021-10-20丹姚衢张晗张琳王茜廖鑫章莹李思成高
杨 丹姚 衢张 晗张 琳王 茜廖 鑫章 莹李思成高 琳*
(1.遵义医科大学附属医院内分泌科,贵州 遵义 563003;2.川北医学院附属医院健康管理中心,四川 南充 637000)
内脂素(Visfatin)是一种主要表达于内脏脂肪组织和(或)巨噬细胞的脂肪因子[1],可增加骨骼肌细胞中葡萄糖的转运,促进葡萄糖摄取[2]。研究表明Visfatin在葡萄糖代谢和胰岛素敏感性方面发挥作用,可能参与了2型糖尿病(type 2 diabetes mellitus,T2DM)、胰岛素抵抗(insulin resistance,IR)、肥胖、代谢综合征和多囊卵巢综合征等疾病的发生发展[3-5]。叉头框转录因子1(forkhead box transcription factor 1,FoxO1)在骨骼肌中高表达,当蛋白激酶B(protein kinase B,PKB/Akt)磷酸化后,FoxO1的乙酰化以及泛素化等其他翻译后修饰与磷酸化相互作用,从而影响其转录[6]。丙酮酸脱氢酶激酶4(pyruvate dehydrogenase kinase 4,PDK4)是FoxO1的下游靶基因,能够调控糖酵解和糖异生途径。研究证实Visfatin可通过调控PI3K/Akt信号途径下游分子糖原合成酶激酶3β和葡萄糖转运体4的活性而促进细胞对葡萄糖的摄取,改善糖脂代谢和IR[7-8],但Visfatin是否能作用于PI3K/Akt下游FoxO1/PDK4通路而在糖脂代谢及IR中发挥作用,目前鲜有报道。因此,本研究拟探讨Visfatin在PI3K/Akt/FoxO1信号通路中对糖脂代谢及胰岛素敏感性的影响,旨在为防治糖尿病及IR相关疾病提供新的研究思路。
1 材料和方法
1.1 实验动物
10只8周龄SPF级雄性KKAy小鼠,体重为30.0 g左右,20只同周龄SPF级雄性C57BL/6J小鼠,体重为(20.0±2.0)g,连同高脂饲料均购于北京华阜康有限公司[SCXK(京)2019-0008],普通饲料由重庆腾鑫公司提供,喂养于重庆医科大学实验动物中心[SYXK(渝)2018-0003],给予充足饲料和自由饮水,环境温度(23±2)℃,湿度40%~60%,控制光照时间8:00~20:00。动物实验经遵义医科大学附属医院动物实验伦理委员会审核批准(KLLY-2018-075),并严格遵循实验动物使用的3R原则。
1.2 主要试剂与仪器
Visfatin重组蛋白(以色列PROSPEC公司);蛋白浓度测定试剂盒、蛋白裂解液及磷酸酶抑制剂(美国Thermo公司);脱脂奶粉、兔抗PI3K110α抗体、兔抗Akt抗体、兔抗p-Akt(Ser473)抗体、兔抗FoxO1抗体、兔抗p-FoxO1(Ser256)抗体及兔抗GAPDH抗体(美国CST公司);兔抗PDK4抗体、兔抗G6Pase抗体及兔抗PEPCK抗体(美国abcam公司);SDS-PAGE蛋白上样缓冲液(5×)及SDS-PAGE凝胶配制试剂盒(江苏碧云天生物公司);诺和灵R(丹麦诺和诺德);DEPC水(生工生物工程(上海)股份有限公司);TRIzol试剂(TaKaRa公司);cDNA逆转录试剂盒和2×SYBR Green qPCR master Mix(美国Bimake公司);戊巴比妥钠(美国Sigma公司)和胰岛素试剂盒(江苏博深生物科技有限公司);胶成像系统(德国Analytik Jena公司);电泳槽及转移槽(美国BIO-RAD公司);核酸蛋白浓度测定仪(杭州ALLSHENG公司);雅培血糖仪及配套试纸(英国Abbott公司);全自动生化仪(日本Olympus公司)。
1.3 实验方法
1.3.1 造模及分组
C57BL/6J小鼠按照随机数字表分为普通饲料组和高脂饲料组,喂养8周后,C57BL/6J小鼠普通饲料组随机分为普食(ND)组和普食+内脂素(ND+V)组,高脂饲料组随机分为高脂(HFD)组和高脂+内脂素(HFD+V)组;KKAy小鼠给予高脂饲料喂养8周后,连续2次空腹血糖(FBG)≥13.9 mmol/L定义为糖尿病模型[9],成模后的KKAy小鼠随机分为糖尿病(DM)组和糖尿病+内脂素(DM+V)组;ND+V组、HFD+V组和DM+V组连续3 d腹腔注射重组内脂素蛋白(6μg/kg)[8],其余各组腹腔注射等量生理盐水,并于注射前后测定相关指标(n=5)。
1.3.2 葡萄糖耐量实验(GTT)和胰岛素耐量实验(ITT)
GTT:将小鼠禁食12 h,测定FBG后腹腔注射2 g/kg的20%葡萄糖溶液,于注射后15、30、60、90、120和180 min尾静脉取血测血糖,并计算GTT曲线下面积(AUCGTT)[10]。GTT实验结束间隔1周后行ITT:将小鼠禁食6 h,然后腹腔注射0.75 U/kg的0.1 U/mL胰岛素溶液后,测定6个时间点(0、15、30、60、90和120 min)血糖水平并计算AUCITT[11]。
1.3.3 标本的采集
小鼠禁食后按50 mg/kg体重腹腔注射戊巴比妥钠溶液麻醉,取血,室内静置30 min,3000 r/min离心15 min,移液器吸取上清于EP管中,-80℃超低温冰箱保存。打开胸腹腔,用预冷的生理盐水心脏灌注,直至肝变白为止,游离后肢骨骼肌组织,生理盐水洗净,滤纸吸干后存放于冻存管,于液氮中保存。
1.3.4 基础指标的测定
每周定期测定各组小鼠体重和摄食;采用血糖仪测定FBG(禁食6 h)和餐后血糖(PBG);采用全自动生化仪检测小鼠血清中的甘油三酯(TG)、总胆固醇(TC)以及游离脂肪酸(FFA);采用酶联免疫吸附实验测定小鼠空腹血清胰岛素(FIns);并计算稳态模型评估胰岛素抵抗指数(HOMA-IR),公式为(FBG×FIns)/22.5。
1.3.5 RT-qPCR反应
用TRIzol提取骨骼肌组织总RNA,逆转录合成cDNA,SYBR-Green荧光染料RT-qPCR检测骨骼肌组织的 mRNA 表达。PI3K 上游引物 5’-CCCATGGGACAACATTCCAA-3’,下游引物5’-CATGG CGACAAGCTCGGTA-3’;Akt上游引物5’-TCAGGATGTGGATCAGCGAGA-3’,下游引物5’-CTGCAGGCAGCGGATGATAA-3’;FoxO1上游引物5’-AGAGTTAGTGAGCAGGCTACAT-3’,下 游引物5’-CCGCTGTTGCCAAGTCTGA-3’;β-actin上游引物5’-GGTGGGAATGGGTCAGAAGG-3’,下游引物5’-AGGTCTCAAACATGATCTGGGT-3’。
1.3.6 Western blot检测
各组取适量骨骼肌组织置于冰上的匀浆器中,加入蛋白裂解液和蛋白磷酸酶抑制剂(100∶1)充分研磨,直至乳糜状后转移到EP管中,每隔5 min振荡1次,共30 min,4℃离心10 min,吸取上清测定总蛋白浓度。另取上清与5×SDS-PAGE蛋白上样缓冲液混合后沸水变性5 min,按照每孔40μg蛋白上样进行电泳分离,转膜,5%脱脂奶粉封闭,一抗(浓度为1∶1000~1∶2000)4℃孵育摇床过夜,TBST溶液洗膜3次,加入二抗(浓度为1∶10000)室温孵育1 h,洗膜后用ECL曝光显影,VisionWorks软件进行分析条带的灰度值。
1.4 统计学方法
所有数据用平均数±标准差(±s)表示,用SPSS 25.0软件进行分析,用GraphPad Prism 7和Photoshop软件进行作图。多组间比较用单因素方差分析,两组间比较方差齐时用LSD检验,方差不齐时用Dunnett’s T3检验,P<0.05有统计学意义。
2 结果
2.1 造模8周后各组小鼠的体重、摄食和血糖
在喂养8周后,与ND组比较,HFD组和DM组小鼠体重显著增高,DM组小鼠的摄食显著增高;与HFD组比较,DM组小鼠体重和摄食均显著增高(P<0.01)。与ND组和HFD组比较,DM组的FBG和PBG显著增高(P<0.001)。见表1。
表1 喂养8周后三组小鼠的体重、摄食及血糖(±s,n=5)Table 1 Body weight,food intake and blood glucose in the three groups of mice after 8 weeks of feeded
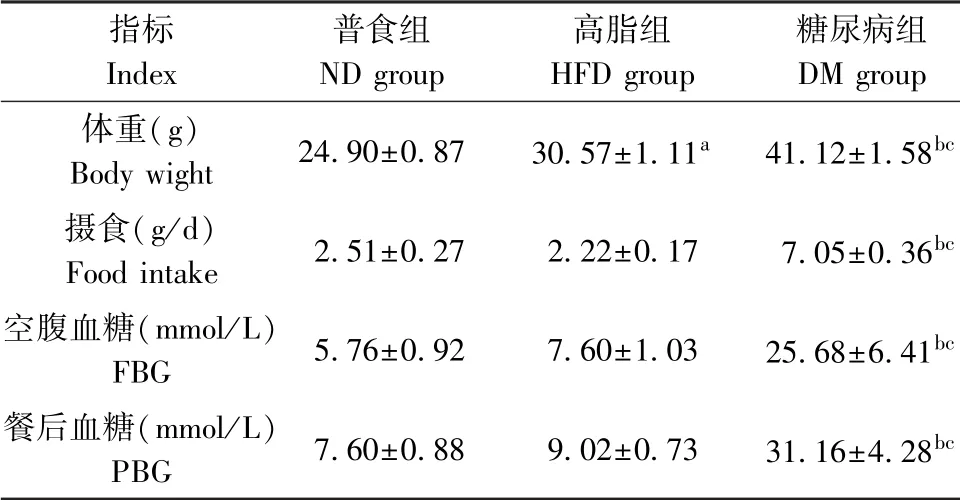
表1 喂养8周后三组小鼠的体重、摄食及血糖(±s,n=5)Table 1 Body weight,food intake and blood glucose in the three groups of mice after 8 weeks of feeded
注:与ND组相比,a P<0.01,b P<0.001;与HFD组相比,c P<0.001。Note.Compared with ND group,a P<0.01,b P<0.001.Compared with HFD group,c P<0.001.
指标Index普食组ND group高脂组HFD group糖尿病组DM group体重(g)Body wight 24.90±0.87 30.57±1.11a 41.12±1.58bc摄食(g/d)Food intake 2.51±0.27 2.22±0.17 7.05±0.36bc空腹血糖(mmol/L)FBG 5.76±0.92 7.60±1.03 25.68±6.41bc餐后血糖(mmol/L)PBG 7.60±0.88 9.02±0.73 31.16±4.28bc
2.2 干预后各组小鼠的相关指标
2.2.1 血清生化指标
与ND组比较,HFD组小鼠TC和FFA水平显著增高(P<0.01),与ND组和HFD组比较,与ND组和HFD组比较,DM小鼠FBG、FIns、TC、TG、FFA和HOMA-IR水平均显著增高(P<0.05)。与DM组相比,DM+V组的FBG、TC、TG和HOMA-IR显著降低(P<0.05)。见表2。
表2 六组小鼠血清生化指标(±s,n=5)Table 2 Serum biochemical parameters of mice in six groups
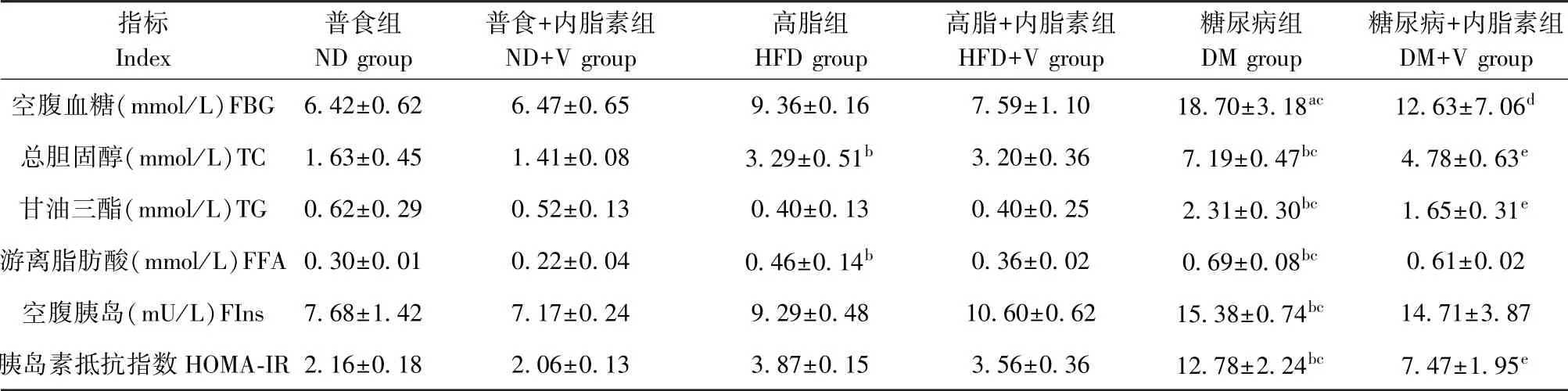
表2 六组小鼠血清生化指标(±s,n=5)Table 2 Serum biochemical parameters of mice in six groups
注:与ND组相比,a P<0.05,b P<0.01;与HFD组相比,c P<0.01;与DM组相比,d P<0.05,e P<0.01。Note.Compared with ND group,a P<0.05,b P<0.01.Compared with HFD group,c P<0.01.Compared with DM group,d P<0.05,e P<0.01.
指标Index普食组ND group普食+内脂素组ND+V group高脂组HFD group高脂+内脂素组HFD+V group糖尿病组DM group糖尿病+内脂素组DM+V group空腹血糖(mmol/L)FBG 6.42±0.62 6.47±0.65 9.36±0.16 7.59±1.10 18.70±3.18ac 12.63±7.06d总胆固醇(mmol/L)TC 1.63±0.45 1.41±0.08 3.29±0.51b 3.20±0.36 7.19±0.47bc 4.78±0.63e甘油三酯(mmol/L)TG 0.62±0.29 0.52±0.13 0.40±0.13 0.40±0.25 2.31±0.30bc 1.65±0.31e游离脂肪酸(mmol/L)FFA 0.30±0.01 0.22±0.04 0.46±0.14b 0.36±0.02 0.69±0.08bc 0.61±0.02空腹胰岛(mU/L)FIns 7.68±1.42 7.17±0.24 9.29±0.48 10.60±0.62 15.38±0.74bc 14.71±3.87胰岛素抵抗指数HOMA-IR 2.16±0.18 2.06±0.13 3.87±0.15 3.56±0.36 12.78±2.24bc 7.47±1.95e
2.2.2 葡萄糖耐量实验和胰岛素耐量实验
在GTT实验中,注射葡萄糖后15 min时,ND组、ND+V组、HFD组和HFD+V组的血糖浓度均上升到最大值,之后开始下降直到180 min时血糖浓度恢复到注射前左右;而DM组小鼠在注射后90 min时血糖才达到峰值,之后开始下降;DM+V组在t=30 min时血糖升高到峰值,在t=180 min血糖回归到0点左右。与ND组比较,HFD组和DM组AUCGTT显著增高(P<0.01或0.001);与HFD组比较,DM组AUCGTT显著增高(P<0.001);与DM相比,DM+V组AUCGTT显著降低(P<0.01)。见图1。
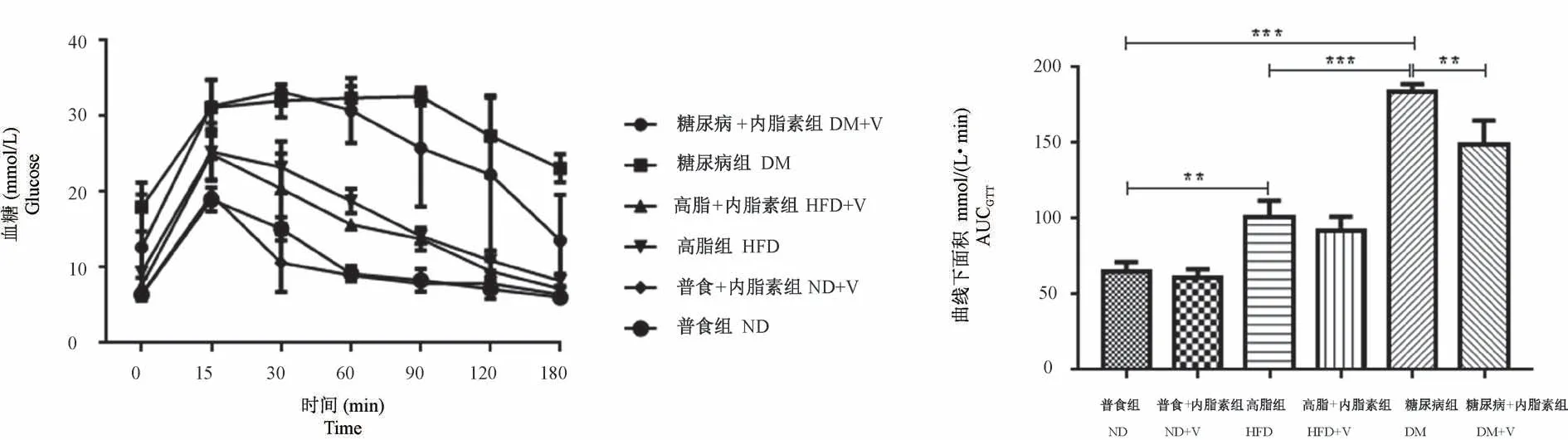
图1 葡萄糖耐量实验和曲线下面积Figure 1 Glucose tolerance test and area under curve
ITT实验中,ND组、ND+V组、HFD组、HFD+V组和DM+V组的血糖均在15~60 min时降至最低点,而DM组血糖先升高后下降,60 min时降至最低。分别与ND组和HFD组比较,DM组AUCITT均显著增高(P<0.001);和DM组相比,DM+V组AUCITT显著降低(P<0.01)。见图2。
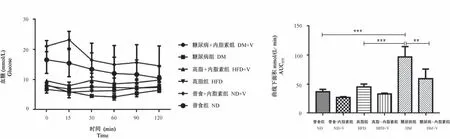
图2 胰岛素耐量实验和曲线下面积Figure 2 Insulin tolerance test and area under curve
2.2.3 RT-qPCR检测PI3K、Akt及FoxO1的mRNA表达
分别与ND组和HFD组比较,DM组PI3K、Akt的mRNA表达水平均显著降低(P<0.001),而FoxO1的mRNA表达水平均显著增高(P<0.05);与ND组相比,ND+V组FoxO1的mRNA表达显著降低(P<0.05);与HFD组比较,ND组Akt的mRNA表达组显著增高(P<0.05);与DM组比较,DM+V组PI3K及Akt的mRNA表达均显著增高,FoxO1的mRNA表达显著降低(P<0.01)。见表3。
表3 各组小鼠骨骼肌PI3K、Akt和FoxO1的mRNA表达(±s,n=5)Table 3 Expressions level of PI3K,Akt and FoxO1 mRNA in skeletal muscle of mice among each group
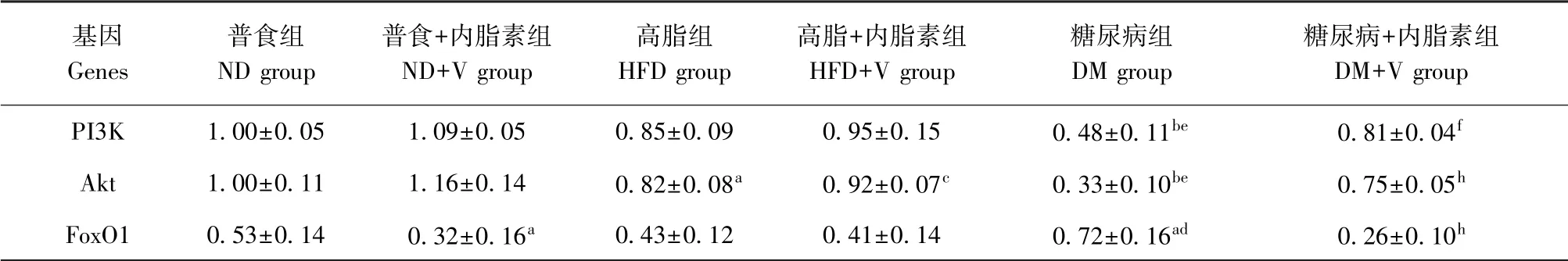
表3 各组小鼠骨骼肌PI3K、Akt和FoxO1的mRNA表达(±s,n=5)Table 3 Expressions level of PI3K,Akt and FoxO1 mRNA in skeletal muscle of mice among each group
注:与ND组相比,a P<0.05,b P<0.001;与HFD组相比,c P<0.05,d P<0.01,e P<0.001;与DM组相比,f P<0.01,h P<0.001。Note.Compared with ND group,a P<0.05,b P<0.001.Compared with HFD group,c P<0.05,d P<0.01,e P<0.001.Compared with DM group,f P<0.01,h P<0.001.
基因Genes普食组ND group普食+内脂素组ND+V group高脂组HFD group高脂+内脂素组HFD+V group糖尿病组DM group糖尿病+内脂素组DM+V group PI3K 1.00±0.05 1.09±0.05 0.85±0.09 0.95±0.15 0.48±0.11be 0.81±0.04f Akt 1.00±0.11 1.16±0.14 0.82±0.08a 0.92±0.07c 0.33±0.10be 0.75±0.05h FoxO1 0.53±0.14 0.32±0.16a 0.43±0.12 0.41±0.14 0.72±0.16ad 0.26±0.10h
2.2.4 Western blot法检测PI3K/Akt信号通路及其下游相关分子的蛋白表达
与ND组比较,DM组PI3K110α、p-Akt蛋白表达水平显著降低,FoxO1、p-FoxO1和PDK4的蛋白表达水平均显著增高(P<0.05);与ND组比较,HFD组FoxO1的蛋白表达显著降低,而p-FoxO1的蛋白表达显著增高(P<0.05);ND+V组FoxO1蛋白表达水平较ND组显著降低(P<0.001)。与HFD组相比,DM组的p-Akt、p-FoxO1的蛋白表达水平均显著降低,FoxO1、PDK4和PEPCK的蛋白表达水平均显著增高(P<0.05)。与DM组比较,DM+V组中PI3K110α、p-Akt及p-FoxO1的蛋白表达均显著增高,而FoxO1、PDK4和PEPCK的蛋白表达水平均显著降低(P<0.05)。见图3~6。
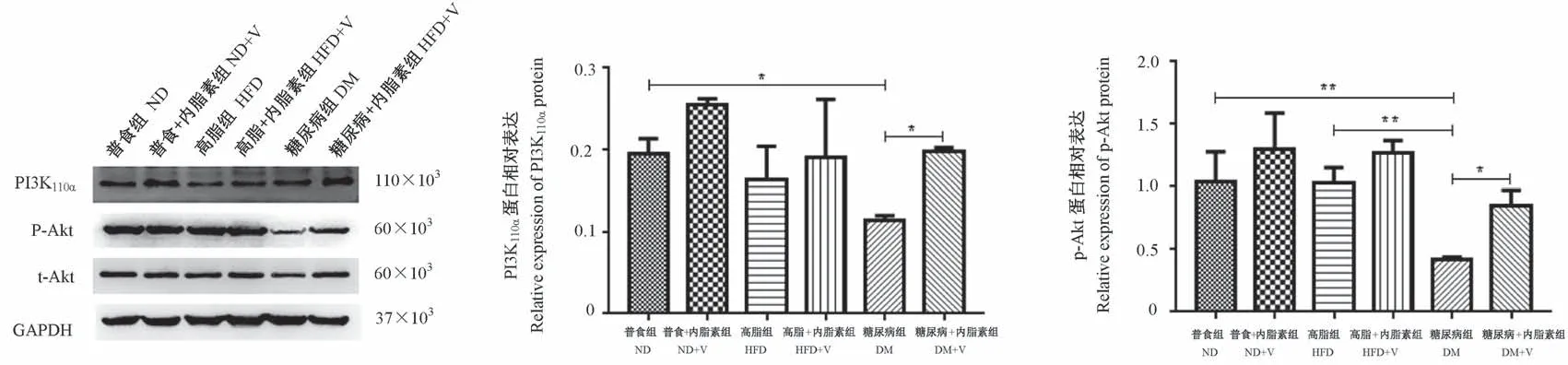
图3 各组小鼠骨骼肌组织PI3K和Akt的活性蛋白表达Figure 3 Active pntein expression of PI3K and Akt in skeletal muscle tissues of mice in each group
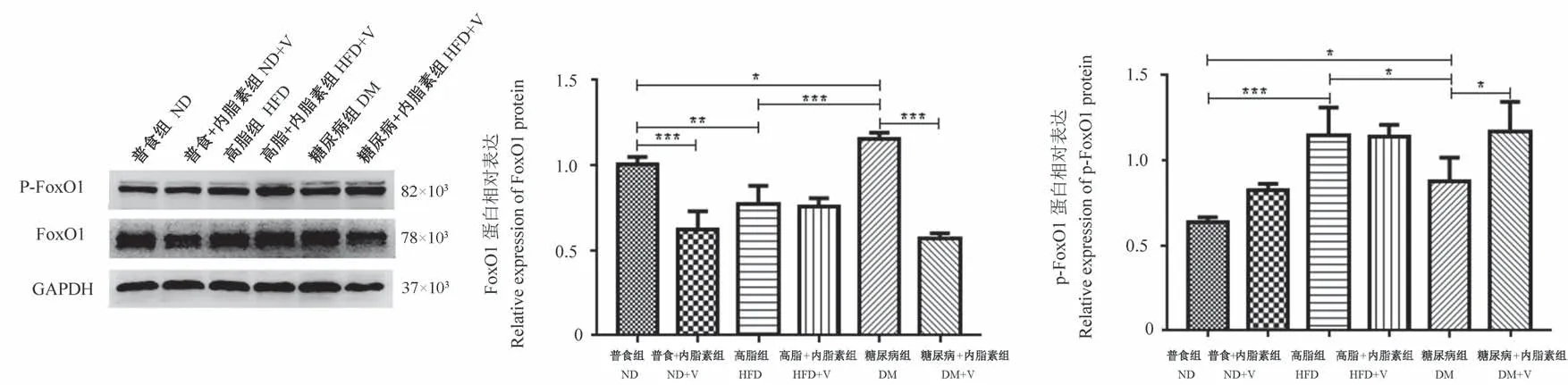
图4 各组小鼠骨骼肌组织FoxO1的蛋白表达Figure 4 Protein expression of FoxO1 in skeletal muscle tissues of mice in each group

图5 各组小鼠骨骼肌组织PDK4的蛋白表达Figure 5 Protein expression of PDK4 in skeletal muscle tissues of mice in each group

图6 各组小鼠骨骼肌组织G6Pase和PEPCK的蛋白表达Figure 6 Protein expression of G6Pase and PEPCK in skeletal muscle tissues of mice in each group
3 讨论
T2DM是一种多基因遗传的慢性代谢紊乱综合征,主要以糖脂代谢紊乱和胰岛素作用受损、同时靶细胞或靶器官对胰岛素刺激的反应能力减弱为特征[12-13]。近年来研究发现Visfatin可作用于胰岛素受体,使胰岛素受体底物酪氨酸磷酸化以激活下游PI3K/Akt等信号通路,具有与胰岛素类似的功能[14]。前期研究也发现Visfatin可以通过PI3K/Akt信号途径上调其下游糖原合成酶激酶3β和葡萄糖转运体4的活性,下调FoxO1的表达,增加L6骨骼肌细胞和KKAy小鼠骨骼肌组织对葡萄糖的摄取,改善IR[7-8,15],并且FoxO1与FBG、TG和HOMA-IR呈正性相关[16]。
骨骼肌是调节糖脂代谢的关键外周组织,Visfatin还可影响骨骼肌的胰岛素敏感性,维持葡萄糖稳态[4]。临床研究表明Visfatin血浆浓度与人体内脏脂肪量密切相关,在肥胖和T2DM人群中Visfatin浓度明显升高,提示其可能参与肥胖相关的IR和糖尿病的发生[17]。FoxO1是能量稳态的关键转录因子,能直接上调骨骼肌组织PDK4的表达,减少葡萄糖的利用[18-19],本实验中KKAy糖尿病小鼠的体重、摄食和血糖显著增高,出现典型的糖代谢紊乱特征[20],分别与ND组和HFD组比较,DM组FBG、TC、TG、FFA、FIns、AUCGTT、AUCITT及HOMA-IR水平均显著增高,HFD组小鼠TC和FFA水平较ND组均显著增高,而注射Visfatin重组蛋白后,DM+V组的FBG、TC、TG、HOMA-IR、AUCGTT和AUCITT水平显著降低,提示Visfatin可改善糖尿病小鼠的胰岛素敏感性及糖脂代谢。糖尿病小鼠骨骼肌PI3K、Akt的基因及蛋白活性表达较ND和HFD组显著降低,而FoxO1及PDK4的基因和蛋白表达水平较ND组和HFD组均明显增高;注射内脂素后DM组骨骼肌PI3K、Akt的基因和蛋白活性表达均显著增高,而FoxO1及PDK4基因和蛋白表达水平均显著降低。本实验证实Visfatin下调了骨骼肌FoxO1和PDK4的表达,但HFD组及DM+V组FoxO1与p-FoxO1蛋白水平表达结果不一致,我们推测:(1)FoxO1不仅由磷酸化修饰,可能还与泛素化及乙酰化等其他蛋白翻译后修饰作用有关,从而影响FoxO1的表达;(2)FoxO1包含三个由Akt控制的磷酸化位点,即Thr24、Ser256和Ser319,而本实验中只检测了FoxO1蛋白磷酸化位点其中之一,不能完全代表p-FoxO1蛋白水平的表达。
FoxO1可诱导其下游靶点PDK4的转录激活,同时,PDK4可使丙酮酸脱氢酶复合物磷酸化失活,减少丙酮酸进入三羧酸循环,从而调节糖异生和糖酵解途径,而葡萄糖-6-磷酸酶(G6Pase)和磷酸烯醇丙酮酸羧激酶(PEPCK)是催化糖异生的关键酶[19,21]。研究发现通过诱导PDK基因,过氧化物酶体增殖物激活受体γ激活因子1α将促进丙酮酸代谢为乙酰辅酶A,进入糖异生途径;相反,抑制PDK4基因后,可降低血糖、改善IR[22]。在肥胖小鼠和IR的肝细胞中PEPCK和G6Pase表达明显增加,而抑制PEPCK和G6Pase的表达可通过减少肝糖异生从而逆转IR[23-24]。本实验中DM+V组小鼠骨骼肌中PEPCK蛋白表达明显低于DM组小鼠,与上述研究结果一致,但G6Pase蛋白表达无明显差异,可能是实验中注射Visfatin的时间较短所致。因此,进一步构建Visfatin过表达腺相关病毒载体,拟研究长时间持续作用的Visfatin对糖脂代谢相关分子基因和蛋白表达的影响,有待于更进一步证实Visfatin在糖尿病及IR中的作用。
总之,在KKAy糖尿病小鼠骨骼肌组织中,Visfatin可能通过PI3K/Akt途径下调FoxO1、PDK4的表达,发挥改善糖脂代谢和IR的作用。本研究也存在一定的局限性,后续将继续完成过表达腺相关病毒实验,同时用腺相关病毒干扰PI3K/Akt/FoxO1信号通路后观察FoxO1及其下游分子的表达变化,以期为糖尿病和IR防治提供潜在的视点。
