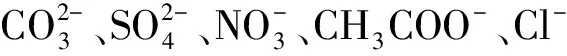基于TiO2纳米颗粒负载Cd2+的光电化学法检测硫化物
2021-10-20朱晓春周志成朱梦周顾子扬王玉萍
周 琦,朱晓春,周志成,梁 伟,朱梦周,顾子扬,王 欣,王玉萍
(1.国网江苏省电力公司电力科学研究院,江苏 南京 211100) (2.南京工程学院自动化学院,江苏 南京 211167) (3.南京师范大学化学与材料科学学院,江苏 南京 210023)
硫化氢是一种易燃危化品和腐蚀性很强的气体,即使较低浓度也可能对环境、设备和人体健康产生危害[1-3]. 含硫化氢的尾气一般采用碱液吸收形成硫化物再进行净化. 目前,已报道硫化氢的检测方法有荧光法[4-5]、电化学法[6-7]、比色法[8]、拉曼法[9]和光学法[10]等,但它们的检测范围通常在微摩尔到毫摩尔之间. 为了提高废气及吸收液中硫化氢检测的选择性和灵敏度,近年来,研究者使用纳米材料制造传感器,利用各种手段检测硫化物[11-14]. 其中,光电电化学(PEC)法是一种新兴的、有发展潜力的传感检测技术[15-17]. 在PEC分析过程中,纳米光电材料和电极间发生电荷转移,引起光电流的增大或减小,光电流的变化可以用来测定物质的浓度[18]. 目前所报道纳米传感器一般采用特定形貌的纳米材料[19-20]. 例如,房家骅[21]等利用碳纳米管掺杂二氧化锡粉末制备了气敏元件,用于有害气体甲醛的检测;Puttharugsa[22]等人选用钛片作为光电化学活性材料,通过电化学成制成二氧化钛纳米管阵列,用于H2O2的传感检测. 电极材料对测定方法的灵敏度及重现性有重要的作用[23]. 而制备方法和制备条件对材料和电极的结构和性能有较大影响.
在本实验中,以商品纳米氧化钛颗粒(P25)和CdSO4为原料,利用化学沉积法制备了TiO2纳米颗粒负载Cd2+的复合材料,并将复合材料制成Cd2+/TiO2电极用于检测溶液中的硫化物. 考察了方法的线性范围、灵敏度、重现性以及可能共存离子的干扰. 为构建快速测定硫化物的化学传感器打下基础.
1 实验部分
1.1 试剂与仪器
本实验主要试剂有硫酸钠、乙酸钠、硝酸钠、氯化钠、碳酸钠、硫化钠(Na2S·9H2O)、硝酸镉(3CdSO4·8H2O)、氯化钾(国药集团化学试剂有限公司);铁氰化钾(上海凌峰化学试剂有限公司);三水亚铁氰化钾(上海阿拉丁公司);纳米二氧化钛粉末(Degussa,德国). 以上试剂均为分析纯,缓冲液为磷酸盐缓冲溶液,实验用水为自制超纯水.
主要仪器设备有CHI660E(上海辰华仪器有限公司);SHZ-88A 型恒温水浴振荡器(太仓市仪器设备厂);WT-100型马弗炉(东南大学四达仪器公司);氧化铟锡(ITO)电极(金坛康达克光电科技有限公司);GZX-9146MBE型电热鼓风干燥箱(上海博讯实业有限公司);HI-4型磁力搅拌器(常州国华电器有限公司);HITACHI S4800型扫描电子显微镜(日本Jeol公司);H-7650型透射电子显微镜(TEM,日本 Hitachi公司);D/max 2500型X射线粉末衍射仪(日本Rigaku公司);Cary 5000紫外/可见/近红外分光光度计(美国Varian公司)
1.2 Cd2+/TiO2纳米材料和PEC电极的制备
将0.4 g的TiO2粉末加入到40 mL 10 mmol/L的CdSO4溶液中,超声30 min后,用磁力搅拌器搅拌 6 h,离心,然后在烘箱里100 ℃干燥6 h,制成 Cd2+/TiO2纳米材料备用.
首先将ITO导电玻璃分别在丙酮、乙醇、去离子水中超声清洗15 min,烘干. 取2 mg的Cd2+/TiO2纳米材料放入1 mL的去离子水中,超声10 min形成均匀的悬浮液. 将10 μL的悬浮液均匀地滴在ITO导电玻璃上,自然风干24 h,然后在马弗炉中450 ℃退火煅30 min,制备Cd2+/TiO2/ITO电极.
1.3 光电化学对硫离子的测定
不同浓度硫化钠溶液的配制:先将硫化钠配制成10 mmol/L的储备液,然后用0.025 mol/L磷酸盐缓冲液(pH=6.8)对10 mmol/L的硫化钠溶液进行10、102、103、104、105、106、107倍的稀释,对应硫离子的浓度分别为1×106、1×105、1×104、1×103、1×102、1×101、1×100nmol/L.
采用自制的光电电化学系统进行了光电测试,350 W的氙灯作为光源,光电流是在CHI660E电化学工作站上进行. 采用三电极体系:以Cd2+/TiO2/ITO电极为工作电极,铂丝为对电极,银氯化银电级为参比电极. 0.025 mol/L的磷酸盐缓冲液(pH=6.8)作为电解液,起始电压为0 V. 将上述不同浓度的S2-的磷酸盐缓冲液倒入电解池内,电解池与光源的距离始终保持10 cm,测量前用蒸馏水润洗含有材料的工作电极,3个电极插入电解液中,连接电化学工作站,打开光源,通开关光源进行测量,所有实验均平行测定3次.
1.4 电化学阻抗图谱(EIS)测定
电化学阻抗测试是以5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1)含0.1 mol/L KCl作为氧化还原探针,在频率范围为0.01 Hz~10 kHz,起始电压0.24 V下进行测试的.
2 结果与讨论
2.1 PEC电极检测硫离子的光电流响应及稳定性
图1为Cd2+/TiO2/ITO电极及其在103nmol/L Na2S溶液中的光电流-时间曲线. 在350 W氙灯的照射下,在0.025 mol/L的磷酸盐缓冲液(pH=6.8)中Cd2+/TiO2/ITO电极的光电流为125 nA;当在0.025 mol/L的磷酸盐缓冲液(pH=6.8)含1×103nmol/L的Na2S的光电流为235 nA,可以看到光电流明显的增大,这可能是溶液中的S2-电极材料中的Cd2+结合形成CdS的缘故.
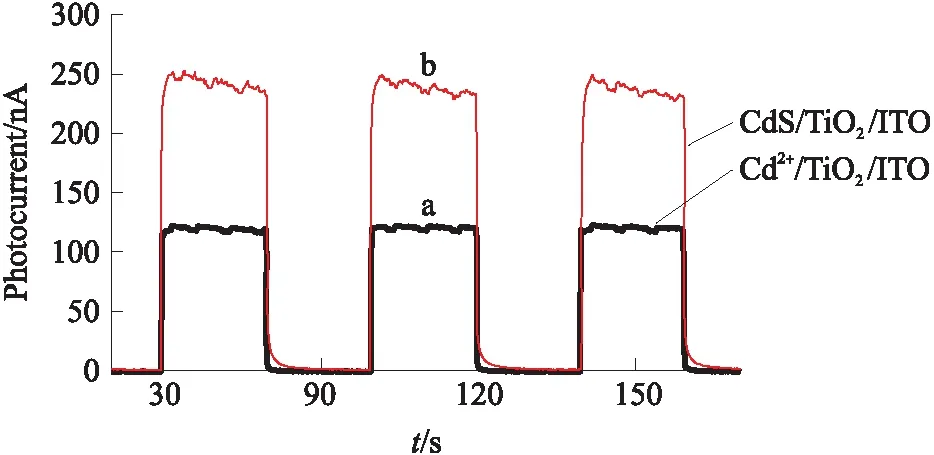
图1 检测前后电极的光电流响应图Fig.1 Photocurrent response of electrodes before and after detection
稳定性是PEC检测中的重要参数. 本实验对含有103nmol/L Na2S的磷酸盐缓冲溶液进行20 s开-关光源,连续11个循环的光电流测试,实验结果如图2所示. 从图2可知,11次循环测定的结果无明显差异,表明该电极具有良好的稳定性.
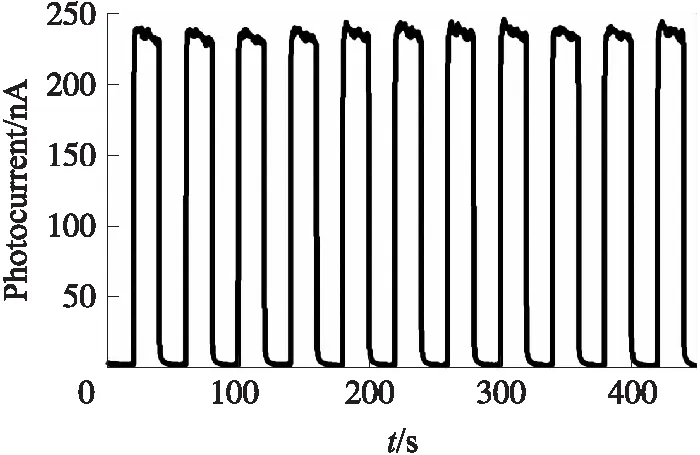
图2 PEC检测硫离子的循环实验Fig.2 Cyclic experiment of detecting sulfur ion by PEC
2.2 PEC电极对硫化物的检测范围和检测限
图3(A)为Cd2+/TiO2/ITO电极在不同浓度Na2S溶液中形成的光电流-时间曲线. 从图3(A)可见,随着Na2S浓度的增加,光电流值逐渐增加. 以光电流值为纵坐标,硫化钠浓度的对数值为横坐标获作图,结果如图3(B)所示. 从图3(B)可见,硫化钠浓度在0.001μmol~1 000 μmol的对数值与电极的光电流有良好的线性关系,根据D=3N/S,取多次平行测定CdS/TiO2的光电流值,计算这些数据的标准偏差,与灵敏度的比值,得出检测限为0.32 nmol/L. 与相关文献所报道H2S检测方法相比(见表1),除了Petruci[10]等的光学法,本方法的检测范围和检测限远优于荧光法、比色法、电化学法和拉曼法;与Cd2+修饰的氧化钛纳米管PEC法相比,本方法检测范围更宽. 由于本法中使用商用氧化钛,材料的性质和性能稳定,所制得的电极材料稳定、重现性好,检测范围和检测限较低,有望成为水中低含量硫化物的快速检测方法.
图3 (A)不同浓度硫离子的光电流响应;(B)光电流与硫离子对数浓度关系曲线Fig.3(A)Photocurrent response of sulfur ions at different concentrations;(B)Relationship between photocurrent and logarithmic concentration of sulfur ions
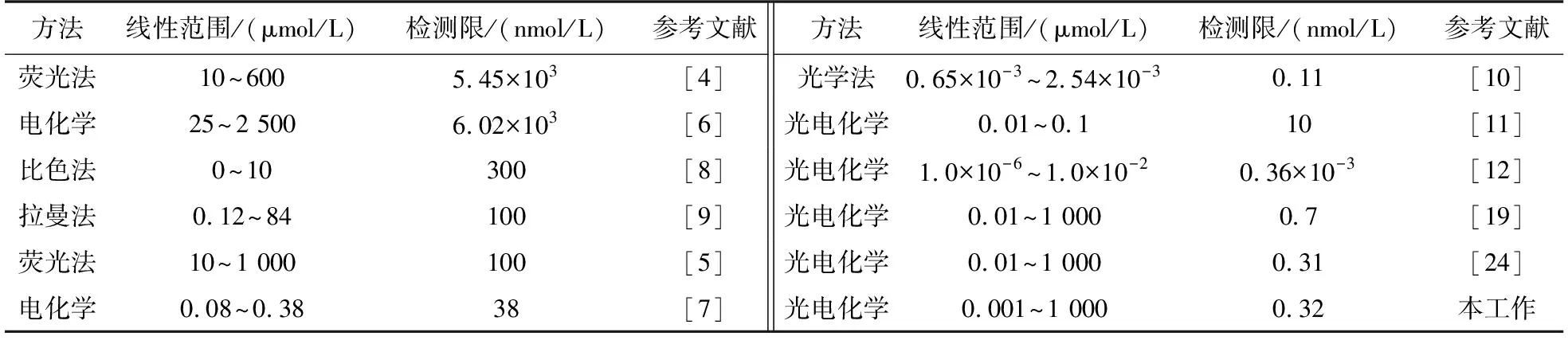
表1 与其他检测H2S的方法比较Table 1 Comparison with other methods for detecting H2S
2.3 Cd2+/TiO2/ITO电极的选择性
从图4可见,与检测103nmol/L的S2-的光电流相比,电极对其他几种阴离子的光电流响应很小,表明Cd2+/TiO2/ITO对硫化物有较好的选择性,这可归因于硫化物中S2-与Cd2+之间具有较高的亲和力. 以上实验表明,利用通过Cd2+负载的TiO2纳米粒子制备的电极,可以选择性检测溶液中较低浓度的硫化物.
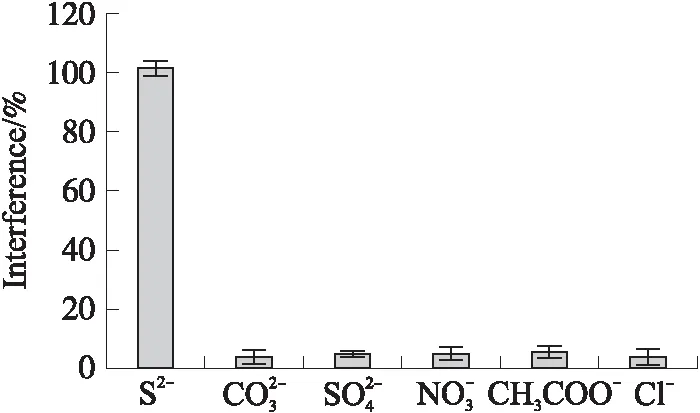
图4 Cd2+/TiO2/ITO电极的选择性实验Fig.4 Selectivity experiment of Cd2+/TiO2/ITO electrode
2.4 材料和电极的表征
图5为将所制备Cd2+/TiO2材料加入含103nmol/L S2-磷酸盐缓冲液,洗涤,烘干获得材料的XRD图谱. 由图可知,负载Cd2+的TiO2在2θ=25.3°、37.8°、48.0°、53.9°、55.1°和62.7°出现的特征峰分别对应于锐钛矿型TiO2的(101)、(004)、(200)、(105)、(211)和(204)晶面的衍射峰,与标准卡片JCPDS 65-5714一致[24]. 与Cd2+/TiO2相比,CdS/TiO2衍射峰强度减弱. 这可能是因为CdS的形成影响了TiO2结晶度. 图中没有出现CdS的特征衍射峰,可能是因为CdS的负载量较少.
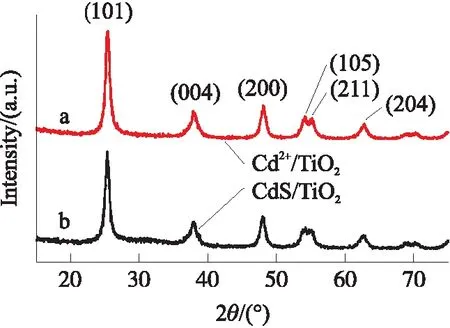
图5 (a)Cd2+/TiO2和(b)CdS/TiO2的XRD图Fig.5 XRD patterns of(a)Cd2+/TiO2 and(b)CdS/TiO2
图6分别是Cd2+/TiO2和CdS/TiO2在扫描电镜和透射电镜下的微观形貌以及CdS/TiO2的EDS图谱. 由图6(a)和6(b)可知,Cd2+/TiO2是20 nm的小颗粒,有团聚的现象. 从图6(c)可知,形成CdS后TiO2的尺寸大于纯Cd2+/TiO2. 从图6(d)可观测到0.35 nm的晶格间距,对应为TiO2锐钛矿相(101)晶面的距离,晶格间距为0.33 nm来自于CdS(JCPDS 10-0454)的(111)面[25]. 这些都表明Cd2+/TiO2/ITO电极经过硫化钠溶液后,在电极上形成了CdS,这与XRD结果一致. 通过EDS图(图6e)进一步分析证明了Cd,S,Ti和O元素的存在,其中Ti和O是主要存在的元素.
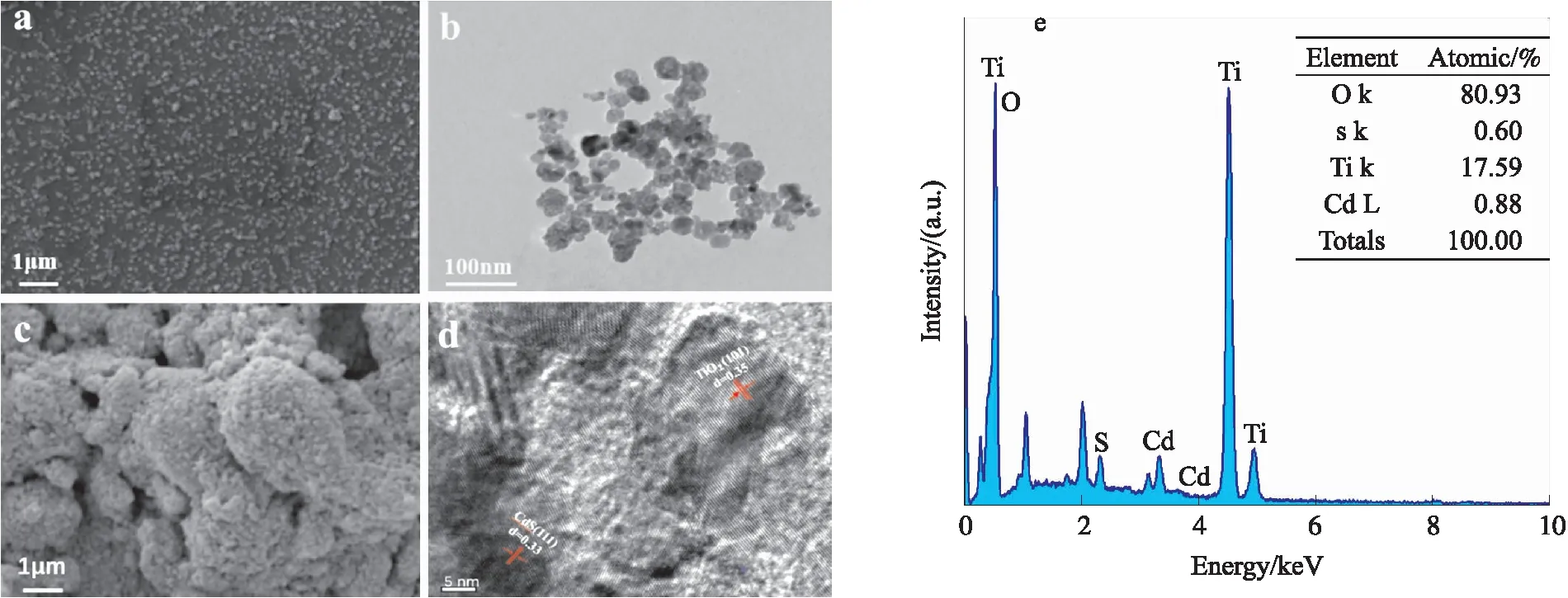
Cd2+/TiO2的(a)SEM和(b)TEM;CdS/TiO2的(c)SEM和(d)TEM;(e)CdS/TiO2的EDS图谱图6 样品的电镜图和EDS图谱Fig.6 Electron microscopy and EDS spectra of the samples
图7是Cd2+/TiO2和CdS/TiO2在波长范围250 nm~800 nm之间的紫外-可见漫反射光谱. 可以发现Cd2+修饰的氧化钛仅对紫外区域有吸收;而CdS修饰后材料在400 nm~530 nm处出现明显的吸收峰,说明CdS可以显著提高TiO2的光响应范围、减小材料的带隙,提高其对可见光的响应,这与文献的报道一致[26-27].
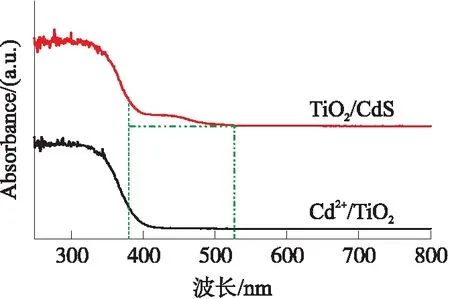
图7 样品的紫外-可见漫反射光谱Fig.7 UV-Vis diffuse reflection spectrum of samples
图8为Cd2+/TiO2/ITO电极在检测硫离子前后的EIS图. EIS测试可以用来表征PEC电极的界面电子传递速率[28]. 一般来说,EIS图中弧半径越小,表明界面电荷转移越快,电荷分离效率越高[29]. 图8的结果可见,Cd2+/TiO2/ITO电极检测103nM硫离子后,高频区半圆直径明减小. 这可能是在电极上形成CdS,而CdS具有较好的电荷转移速率,可以加速光生电子-空穴对的分离,抑制光生电荷的快速复合,从而增强了电极与溶液间电子的传递,导致电子转移阻抗明显减小[30]. 因而,CdS负载的TiO2具有更强的导电能力.
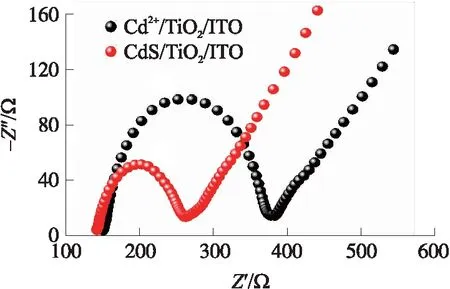
图8 PEC电极检测前后的电化学阻抗图谱Fig.8 Electrochemical impedance spectra before and after PEC electrode detection
2.5 Cd2+/TiO2/ITO电极检测S2-的机理分析
图9是Cd2+/TiO2/ITO电极对S2-的检测机理示意图. 由于TiO2较宽的带隙(3.2 eV),仅对紫外光有较强的吸收能力;而CdS带隙较窄(2.4 eV),导电能力较高,是提高TiO2光电性能的合适敏化剂之一[31]. 当CdS纳米颗粒作为敏化剂,CdS导带(CB)的激发电子注入到 TiO2晶体中. TiO2带隙较大,对于紫外光的吸收能力较强. 在350 W氙灯的光照下,Cd2+/TiO2/ITO电极在含有S2-的磷酸盐溶液中形成CdS,负载在TiO2上的CdS会发生电荷分离,产生电子空穴(e--h+)对. 由于CdS的CB比TiO2的负电荷多,所以CdS的光电子可以快速注入TiO2中,从而减少电子空穴的复合过程,引起光电流的增大.
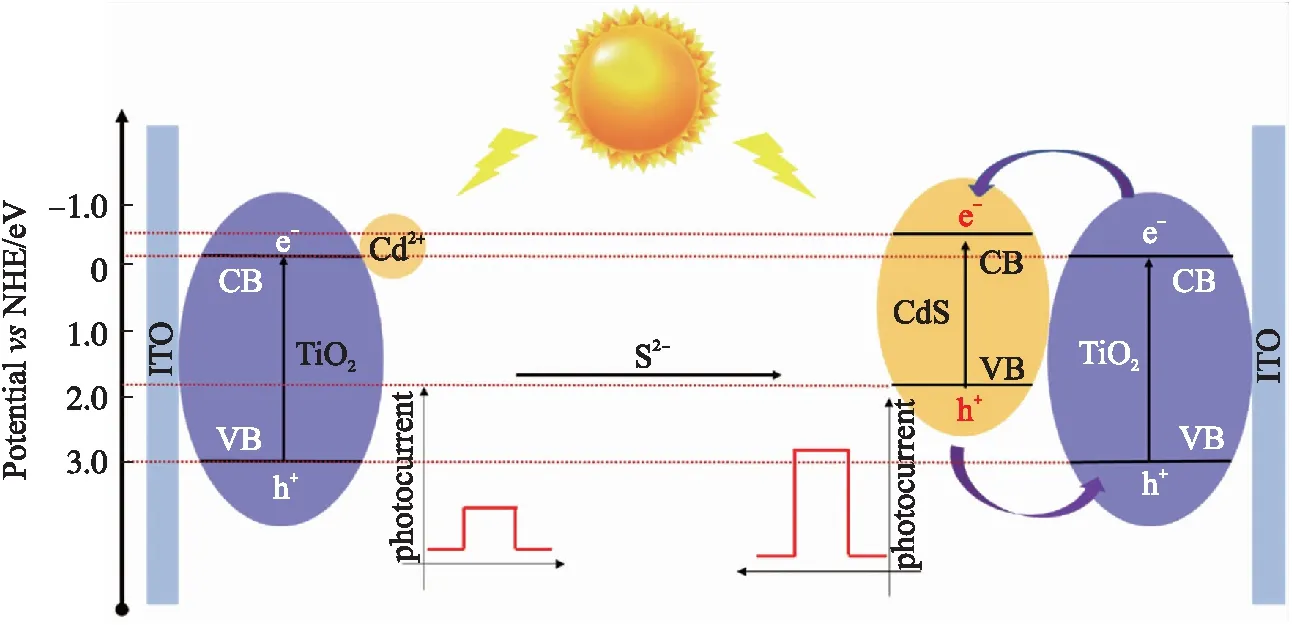
图9 Cd2+/TiO2/ITO电极对硫化物的传感机理Fig.9 Cd2+/TiO2/ITO electrode sensing mechanism for sulfide
3 结论