NCAPD3激活AKT-FOXO信号通路抑制前列腺癌细胞的凋亡
2021-10-20贺稳政吴庆新
贺稳政,吴庆新,刘 平
(南京师范大学生命科学学院,生物化学与生物制品研究所,江苏 南京 210023)
前列腺癌(PCa)在世界范围内是仅次于肺癌的第二大最常见的男性癌症,是癌症死亡的主要原因之一[1]. PCa是一种常见的疾病,平均每七个北美男性中就有一人会受到前列腺癌症的影响[2]. 随着预期寿命的增加,老年前列腺癌患者的数量逐年增加[3]. 近年来,尽管前列腺癌的基础研究和临床应用水平不断提高,但前列腺癌的治疗效果仍不理想.
凝缩蛋白(condensin)复合物在细胞中的主要功能是调控有丝分裂时期染色质的凝缩和稳定[4]. 凝缩蛋白复合物以SMC(structural maintenance of chromosomes)为核心亚单位显示出高度特征性的棒状结构,并通过主动机制组织大规模的染色体组装[5]. 凝缩蛋白复合物对于生命的正常繁衍必不可少[6]. 大多数真核生物有两种凝缩蛋白复合物:凝缩蛋白复合物I和II. NCAPD3(non-SMC condensin II complex subunit D3)是condensin II的亚基,在真核细胞有丝分裂过程中起关键作用[7]. 当NCAPD3功能异常时,染色体结构会发生异常,导致有丝分裂细胞异常[8]. 而NCAPD3的突变会引起小头症,说明有丝分裂染色体浓缩是确保哺乳动物大脑皮层大小的关键过程[9]. 有研究表明NCAPD3可能通过激活IKK/NF-κB通路刺激炎症因子IL-1β、IL-6和TNF-α的分泌,从而促进炎症的进展[8]. 在胰腺导管腺癌中,NCAPD3可以作为一个新的预后预测因子[10].
丝氨酸/苏氨酸激酶AKT,也称为蛋白激酶B(PKB),作为PI3K的直接下游靶标,AKT在细胞增殖、分化、凋亡及迁移中充当重要的角色. AKT的典型底物之一是FOXO转录因子家族的FOXO1和FOXO3A. FOXOs作为转录因子,主要在核中调控凋亡相关因子的表达,如FasL、Bim等. FasL引发外源性途径的细胞凋亡,而Bim引发线粒体依赖性途径的细胞凋亡[11]. AKT磷酸化FOXOs的丝氨酸/苏氨酸残基,如FOXO1的Ser256位点、FOXO3A的Ser253位点[12],磷酸化的FOXOs与伴侣蛋白14-3-3结合,从细胞核转移到细胞质且失去转录活性[13]. 此外,AKT还通过调控FOXOs影响细胞的诸多功能,包括细胞分化、细胞增殖、DNA损伤和修复及氧化应激等.
本实验室前期实验结果发现,NCAPD3在前列腺癌的发展中发挥促癌的作用. 但是,NCAPD3在前列腺癌中发挥功能的分子机制尚未见报道. 本实验NCAPD3在前列腺癌中作为一种促癌因子抑制细胞凋亡的机制,为前列腺癌分子病因学的进一步完善提供实验依据,也为未来治疗前列腺癌提供新的药物靶点.
1 材料和方法
1.1 实验材料
NCAPD3表达质粒(pcDNA3.1/NCAPD3)由本实验室构建并保存;小干扰RNA(siNCAPD3)购自通用生物;DNA Marker购自上海捷瑞生物公司;蛋白质Marker购自赛默飞公司;ECL试剂购自Tanon公司;细胞凋亡试剂盒购自凯基生物;质粒小提试剂盒购自天根生物有限公司;FOXO1、p-FOXO3A(S253)、Fasl抗体均购自Affinity公司;p-AKT(S473)抗体购自CST公司;NCAPD3、AKT、p-FOXO1(S256)、FOXO3A、BCL-2 抗体均购自Proteintech公司;β-actin、p-AKT(T308)抗体均购自ABclonal公司;胰蛋白酶、RIPA裂解液均购自碧云天生物技术有限公司;RPMI 1640培养基购自维森特生物技术有限公司;胎牛血清购自美国Gibco公司;胰蛋白酶(Trypsin)购自Biosharp生物科技公司;Lipofectamine®2000转染试剂购自美国Invitrogen公司;实验所用细胞正常前列腺基质细胞WPMY-1、前列腺增生细胞BPH-1、前列腺癌细胞 PC-3、DU145、CWR22RV1和LNCaP购自中国科学院上海细胞库.
1.2 实验方法
1.2.1 细胞培养及细胞传代
正常前列腺基质细胞WPMY-1、前列腺增生细胞BPH-1、前列腺癌细胞PC-3、DU145、CWR22RV1和LNCaP. 使用RPMI 1640完全培养基,37 ℃、5% CO2恒温培养箱中进行培养. 培养适当时间后显微镜下观察细胞形态和密度,确定细胞生长状况,待细胞密度生长至80%左右,用0.25%的胰蛋白酶消化,按合适比例进行细胞传代.
1.2.2 细胞转染
细胞密度长至80%后胰酶消化细胞,进行细胞计数、铺板,待细胞密度达到60%~70%时进行转染,使用无血清培养基分别按一定比例稀释实验相关质粒DNA或siRNA,混匀后,将lipofectmine®2000试剂加入到质粒DNA或siRNA稀释液中,再次混匀后,室温静置15 min~20 min. 然后在转染细胞中加入相应体积无血清培养基,将转染复合物加至细胞培养基中孵育4 h~6 h后更换为完全培养基,继续培养48 h.
1.2.3 细胞总RNA的提取
细胞转染48 h后,吸去旧培养基后,加入预冷的PBS洗1~2次;向培养皿中加入400 μL预冷的Trizol,在冰上静置5 min后,用移液枪轻轻吹打,收集至1.5 mL RNase-free EP管中,再次冰上静置5 min,按氯仿/Trizol=1∶5体积加入氯仿,涡旋振荡30 s,充分混匀,冰上放置3 min;随后4 ℃ 12 000 rpm 离心 12 min,吸取含上层无色水相转移至新的EP管中;按异丙醇/Trizol=1∶2体积加入异丙醇,轻轻颠倒混匀,-20 ℃放置1 h;4 ℃ 12 000 rpm离心10 min,弃上清,沉淀可见于管底;沉淀中加入1 mL 75%乙醇溶液,上下颠倒翻转,4 ℃ 7 500 rpm离心5 min;弃上清,室温开盖干燥10 min;沉淀中加入25 μL RNase-free ddH2O溶解沉淀,紫外分光光度计测定RNA浓度,随后置于-80 ℃冰箱保存.
1.2.4 细胞总蛋白提取与定量
细胞转染48 h后,吸去旧培养基,加入预冷的PBS洗1~2次;每孔加入新配制120 μL 细胞裂解液(RIPA:PMSF:磷酸酶抑制剂=9∶1∶0.1,V/V);静置2 min后将细胞刮下并将细胞裂解液收集至1.5 mL的离心管中,冰上静置,每隔10 min涡旋一次,共40 min,使细胞充分裂解;12 000 r/min离心15 min,取上清;DC法对上清样品进行总蛋白定量并将提取的细胞总蛋白、ddH2O、5×loading buffer按一定比例混匀,在95 ℃的金属浴中煮样变性配制成上样液,置于-20 ℃冰箱中保存待用.
1.2.5 免疫印迹分析
根据蛋白定量的结果,每次上样取20 μg总蛋白样品进行SDS-PAGE电泳,电泳结束后,将蛋白质转移至PVDF膜上(转膜时间根据蛋白条带大小),转膜结束后用新配制的5%脱脂奶粉的PBS室温封闭 1 h;PBST清洗3次后,4 ℃孵育一抗过夜,洗膜3次,室温孵育二抗1 h;孵育结束后,PBST清洗3次;取适量ECL试剂A、B液等体积混合后滴于PVDF膜上,进行化学发光显影拍照,并对条带进行灰度分析.
1.2.6 流式细胞术检测细胞凋亡
用不含 EDTA 的胰酶消化细胞3 min,弃去胰酶,加入新鲜培养基轻柔吹打,并转移至1.5 mL离心管中;用PBS洗涤细胞1~2 次(2000 rpm 离心5 min),收集1×105~5×105细胞;细胞沉淀中加入500 μL的Binding Buffer 轻柔悬浮;加入5 μL Annexin V-FITC 混匀后,加入5 μL Propidium Iodide,混匀;室温、避光、反应 5 min~15 min后,进行流式细胞仪的检测和观察.
1.2.7 数据库分析
利用The-Human-Protein-Atlas(https://www.proteinatlas.org/)数据库的转录组学数据分析NCAPD3在各种癌症组织样本中的表达水平;利用GEPIA数据库对不同癌症以及相同癌症中相对于正常组织表达分析(http://gepia.cancer-pku.cn/).
1.2.8 统计分析
使用Excel和GraphPad软件进行统计分析和作图,使用t检验(ttest)分析数据以确定不同组之间的显著性差异. *P<0.05;**P<0.01;***P<0.001.
2 结果与讨论
2.1 前列腺癌组织样本中,NCAPD3显著提高
有研究表明,NCAPD3的异常表达与肿瘤的发生发展密切相关[14]. 在前列腺癌中,NCAPD3的表达与前列腺癌根治术后肿瘤复发率有关[15]. 利用The-Human-Protein-Atlas数据库的转录组学数据分析NCAPD3在各种癌症组织样本中的表达水平,分析显示在前列腺癌组织样本中,NCAPD3的表达水平显著高于其他类型的癌症组织样本(如图1A所示). 此外,利用GEPIA数据库的转录组学数据进行分析,结果表明NCAPD3在前列腺癌组织样本中的表达水平显著高于正常前列腺组织样本(如图1B所示).
2.2 前列腺癌细胞中,NCAPD3促进AKT的磷酸化
AKT及其下游相关信号通路的异常激活会显著促进前列腺癌的发展进程[16]. 为探究在前列腺癌细胞中NCAPD3与AKT激活之间的相关性,选取正常前列腺基质永生化细胞WPMY-1、前列腺增生细胞BPH-1以及4种前列腺癌细胞PC-3、DU145、22RV1和LNCaP,利用RT-PCR和Western-blot检测NCAPD3在各种细胞中mRNA水平和蛋白水平,p-AKT(Ser473)的蛋白磷酸化水平. 结果显示NCAPD3在前列腺癌细胞中的表达水平(包括mRNA水平和蛋白水平)明显高于正常前列腺细胞和前列腺增生细胞;p-AKT(Ser473)磷酸化水平在前列腺癌细胞表达上升(图2A、B). 进一步在前列腺癌细胞DU145和LNCaP中过表达或敲低NCAPD3,Western-blot检测AKT(Thr308和Ser473)的磷酸化水平和总AKT蛋白水平,发现DU145细胞中过表达NCAPD3后,AKT的磷酸化水平上升;反之,在LNCaP中使用siNCAPD3敲低NCAPD3后,AKT的磷酸化水平下调;而AKT总蛋白水平没有明显变化(图2C、D). 以上结果表明NCAPD3促进AKT的磷酸化修饰.
2.3 NCAPD3促进FOXO1和FOXO3A的磷酸化
在前列腺癌细胞中,AKT下游靶基因FOXO1和FOXO3A转录因子在癌细胞的凋亡、代谢、周期阻滞以及免疫调节中起着关键作用[17-18]. 为探究NCAPD3是否能调控FOXO1和FOXO3A活性,进而影响前列腺癌细胞的凋亡,分别在LNCaP中siRNA敲低NCAPD3和DU145中过表达NCAPD3,Western blot检测相关蛋白水平,结果如图3所示. 在DU145中过表达NCAPD3后,FOXO1(S256)和FOXO3A(S253)的磷酸化水平明显上调;敲低NCAPD3的LNCaP细胞中,FOXO1(S256)和FOXO3A(S253)的磷酸化水平明显下降(图3A). 进一步检测FOXO1和FOXO3A下游凋亡相关因子的水平,结果发现在DU145中过表达NCAPD3后,凋亡相关因子FasL的蛋白水平下降,而抗凋亡蛋白BCL-2的蛋白水平明显升高;敲低NCAPD3的LNCaP细胞中,则结果恰好相反(图3A). 以上结果表明,NCAPD3促进FOXO1、FOXO3A相应位点的磷酸化,而文献报道FOXO1(S256)和FOXO3A(S253)的磷酸化会促进其蛋白质出核,进而使其转录活性降低,最终抑制前列腺癌细胞发生凋亡.
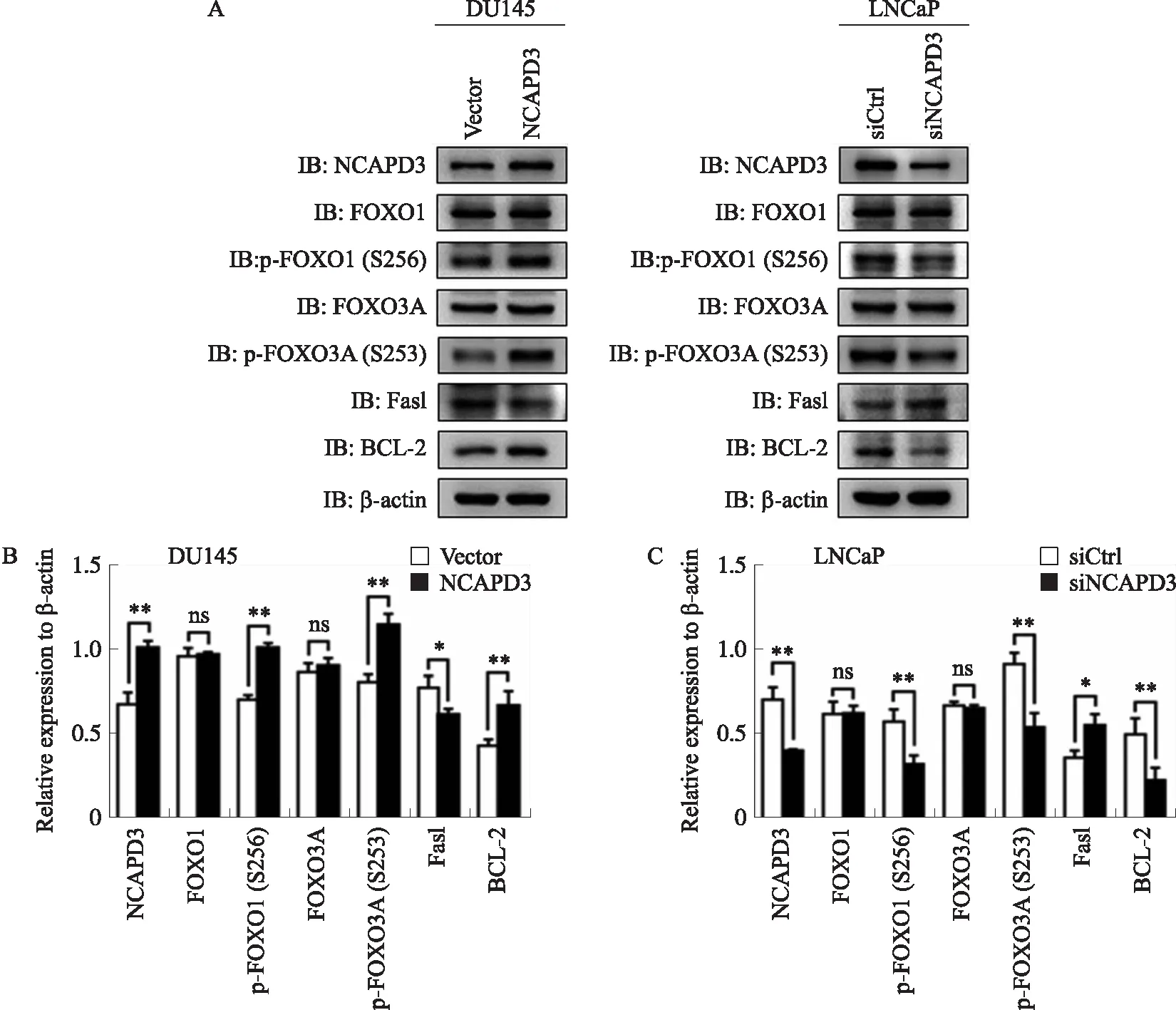
A:DU145、LNCaP细胞分别转染NCAPD3质粒、NCAPD3 siRNA,48 h后提取细胞总蛋白,Western blotting检测NCAPD3、FOXO1、p-FOXO1(Ser 256)、FOXO3A、p-FOXO3A(Ser 253)、FasL、BCL-2的表达情况;B:图A蛋白条带灰度分析结果;*P<0.05;**P<0.01;ns是无显著性差异.图3 NCAPD3通过磷酸化FOXO1和FOXO3A降低其转录活性,进而抑制前列腺癌细胞发生凋亡Fig.3 NCAPD3 inhibits apoptosis of prostate cancer by regulating the activity of FOXO1 and FOXO3A

A:LNCaP细胞转染NCAPD3 siRNA,48 h后收集细胞用流式细胞仪分析细胞凋亡情况;B:图A中凋亡细胞比例统计分析结果;***P<0.001.图4 敲低NCAPD3促进前列腺癌细胞发生凋亡Fig.4 Knockdown of NCAPD3 promotes apoptosis of prostate cancer cells
2.4 敲低NCAPD3促进前列腺癌细胞发生细胞凋亡
由于在野生型前列腺癌细胞中的凋亡率就极低,因此即使过表达NCAPD3也难以再明显降低前列腺癌细胞的凋亡比率. 为此,本研究在高表达NCAPD3的LNCaP细胞中用siRNA敲低NCAPD3,检测细胞凋亡情况,以此证明NCAPD3的敲低可以促进前列腺癌细胞发生凋亡,进而证明NCAPD3可以抑制前列腺癌细胞的凋亡作用. LNCaP细胞用siRNA敲除NCAPD3 48 h后,收集细胞进行流式细胞术检测细胞凋亡情况,结果如图4所示. 在敲低NCAPD3后,前列腺癌细胞LNCaP的凋亡细胞数目增加,凋亡细胞比例升高.
3 结论
NCAPD3作为凝缩蛋白复合物II的一个亚基,在细胞的有丝分裂中起到重要的作用,但是有关NCAPD3与前列腺癌的相关性及其分子机制尚未见报道. AKT信号通路是癌症研究中众所关注的重点,AKT信号通路能够调控各种不同的细胞功能,如代谢、生长、增殖、迁移、转录以及蛋白质合成[19]. 而在癌症中,由于该信号通路的异常激活,使得这些细胞功能往往处于失调状态. 因此,在大部分的癌症中,AKT通路是被异常激活的. 大量文献报道,AKT通路在前列腺癌被异常磷酸化而激活,并在前列腺癌的发生、发展中发挥重要的作用[20]. 本研究通过数据库相关数据分析相对于其他癌症,NCAPD3在前列腺癌中表达更加显著,并且比较前列腺正常组织与癌症组织中NCAPD3的表达情况,可以发现NCAPD3的表达水平在前列腺癌组织中明显高于正常组织,说明NCAPD3在前列腺癌中是异常高表达的. 通过蛋白质免疫印迹实验证明NCAPD3在前列腺癌中可以促进AKT的磷酸化,AKT被磷酸化激活后,一方面可以进一步激活下游相关促癌分子信号通路,促进前列腺癌细胞的生长、增殖和转移;另一方面,NCAPD3通过促进转录因子FOXO1和FOXO3A的磷酸化,促使其从细胞核转移到细胞质中,抑制FOXO1和FOXO3A引起的细胞凋亡相关的蛋白因子(如FasL和Bcl-2等)的表达,抑制前列腺癌细胞发生凋亡.
有文献报道,在小鼠结直肠癌中,NCAPD3高表达导致染色体不稳定,进而促进结直肠癌的进展[21];在胰腺癌中,NCAPD3可以作为临床患者的预后因子[22]. 这些结果均表明NCAPD3在癌症的发生发展中可能发挥促癌的作用. 在本实验中,首次发现NCAPD3通过激活AKT信号通路促进前列腺癌的恶性进展. NCAPD3可以调节AKT磷酸化修饰,但NCAPD3是染色质凝缩蛋白复合物II的一个亚基,又是如何调节AKT磷酸化修饰水平的呢?AKT经典的上游磷酸化激酶是PI3K,那么,NCAPD3是否是通过激活PI3K,进而磷酸化激活AKT的呢?其中具体的分子机制需要进一步探究.
本实验首次发现NCAPD3通过磷酸化激活AKT,进而激活AKT下游一系列促进前列腺癌细胞生长、增殖的信号通路,促进前列腺癌的发生发展;同时,磷酸化激活的AKT通过调控FOXO1和FOXO3A的转录活性,抑制前列腺癌细胞发生凋亡作用,有利于癌细胞的生长;最终导致促进前列腺癌的总效应. 可见,NCAPD3在前列腺癌中是一个促癌基因,有可能成为前列腺癌的一个新的临床诊断和治疗的靶基因.
