多汁乳菇多糖的分离纯化及三种食用菌多糖的抗氧化研究
2021-10-20丁慧敏朱亚男王秋艳黄馨阅陶明煊
丁慧敏,朱亚男,王秋艳,黄馨阅,陶明煊
(南京师范大学食品与制药工程学院,江苏 南京 210023)
人体内的自由基主要包括羟基自由基、氢过氧化物、超氧阴离子等活性氧自由基[1],这些自由基的氧化性极强,一旦过量就会攻击核酸、蛋白质等生物大分子,发生超氧化反应,破坏人体正常生长发育,加快衰老速度,诱发各种疾病.
多糖是一类由糖苷键连接而成的生物大分子,是食用菌中的主要活性物质,在保健品和医疗上有着广泛应用[2-4]. 目前,国内外已有许多研究证实了食用菌多糖具有抗氧化、抑制肿瘤、提高免疫等性能,在一些疾病的预防与治疗上表现出积极的效果[5-6].
多汁乳菇(LactariusvolemusFr.)又称奶浆菌、奶汁菇等[7],属伞菌目、红菇科、乳菇属,富含人体所需的氨基酸如赖氨酸、苏氨酸等,是一种营养保健性能兼佳的食用真菌.

1 材料与方法
1.1 材料、试剂与仪器
材料:多汁乳菇采购于麽麽特产店;白玉菇多糖(RPHM)、姬菇多糖(RPPC)由实验室前期制得.
试剂:水杨酸、无水乙醇、邻苯三酚、三羟甲基氨基甲烷(Tris)、FeSO4、铁氰化钾、维生素C均为国产分析纯,购买于上海凌峰化学试剂有限公司.
仪器:MCFD5005冷冻真空干燥机,上海优浦科学仪器有限公司;754紫外可见分光光度计,上海光谱仪器有限公司;GL-22M高速冷冻离心机,上海赵迪生物科技有限公司.
1.2 实验方法
1.2.1 多汁乳菇子实体多糖的提取
将多汁乳菇子实体粉碎过筛,保存于干燥器中. 准确称取干粉25 g,按料液比1∶20加入蒸馏水超声破碎后进行热水浸提,6 000 g离心15 min,合并上清液,浓缩至一定体积后加入其体积4倍量的95%乙醇进行醇沉,于4 ℃静置12 h后,离心取沉淀,60 ℃恒温烘干得多汁乳菇粗多糖(CPLV)[8-9].
1.2.2 多汁乳菇子实体多糖的纯化
根据文献[10]中除蛋白方法略作修改,取10%多汁乳菇粗多糖溶液,按体积比5∶1加入Sevage(氯仿∶正丁醇=4∶1)试剂,摇床振荡30 min,6 000 g离心15 min,取上层多糖溶液重复多次直至无明显蛋白层,旋蒸除去有机试剂,透析浓缩冻干,得多汁乳菇多糖(RPLV).
1.2.3 RPLV、RPHM、RPPC化学组分的测定
(1)总糖含量的测定
采用苯酚-硫酸显色法[11],分别移取0.05 mg/mL葡萄糖标准液0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL于试管中,补加蒸馏水至1.0 mL,加入5%苯酚溶液0.5 mL,再加入2.5 mL浓硫酸,静置30 min,取出,以第一管作空白对照,测定490 nm处的吸光度.
(2)总酚含量的测定
采用福林酚试剂还原比色法[12],分别移取0.1 mg/mL的没食子酸标准溶液0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL于25 mL棕色容量瓶中,补加蒸馏水至6 mL,加入0.5 mL福林酚试剂、1 mL饱和Na2CO3溶液,用蒸馏水定容至25 mL,于室温下避光反应30 min,测定760 nm处的吸光度.
(3)总黄酮含量的测定
采用NaNO2-Al(NO3)3·9H2O-NaOH比色法[13],分别准确移取0.1 mg/mL芦丁标准溶液0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL于试管中,补加60%乙醇溶液至5 mL,加入5% NaNO2溶液0.3 mL,混匀后静置6 min,再加入10%硝酸铝溶液0.5 mL,静置6 min,加入1 mol/L NaOH溶液4 mL,混匀后室温反应15 min,以第一管为空白对照,测定510 nm处的吸光度.
(4)硫酸基含量测定
采用氯化钡-明胶比色法[14],分别移取0.2 mg/mL K2SO4标准溶液0、0.2、0.4、0.6、0.8、1.0 mL于试管中,补加蒸馏水至1 mL,加入0.8%三氯乙酸溶液0.7 mL和0.5% BaCl2-明胶溶液0.5 mL,静置15 min后测定360 nm处的吸光度.
(5)糖醛酸含量测定
采用硫酸-咔唑比色法[15],分别准确移取0.1 mg/mL葡萄糖醛酸标准溶液0、0.1、0.2、0.3、0.4、0.5、0.6 mL于具塞试管中,补加超纯水至1 mL,在冰浴条件下加入四硼酸钠-硫酸溶液5 mL,100 ℃水浴10 min,在冰水浴条件下加入咔唑-乙醇溶液0.2 mL,摇匀后沸水浴15 min,冷却至室温后,测定523 nm处的吸光度.
(6)蛋白质含量测定
采用考马斯亮蓝法[16],分别移取1 mg/mL BSA溶液0、10、20、40、60、80、100 μL于试管中,补加蒸馏水至100 μL,充分混合,加入5 mL考马斯亮蓝G-250试剂,混合均匀,静置20 min后测定595 nm处的吸光度.
1.2.4 RPLV、RPHM、RPPC体外抗氧化活性测定
(1)清除羟基自由基(·OH)活性的测定
H2O2和Fe2+混合会发生Fenton反应[17],生成·OH. ·OH被水杨酸捕获生成的有色物质在510 nm处有特征吸收峰. 本实验在水杨酸法[18]的基础上进行了改进,分别移取1 mL不同浓度的多糖溶液,各加入1 mL的9 mmol/L FeSO4、9 mmol/L水杨酸-乙醇、8.8 mmol/L H2O2,于37 ℃反应30 min,以蒸馏水作为空白对照. 多糖的本底吸光度以1 mL蒸馏水代替H2O2进行测定,以相同浓度的维生素C作为阳性对照,测量510 nm处的吸光度.
清除率(%)=[A0-(Ax-Ax0)]/A0×100%,
(1)
式中,A0为空白对照的吸光度;Ax为加入多糖溶液后的吸光度;Ax0为多糖溶液的本底吸光度.
采用邻苯三酚自氧化法[19],此反应在25 ℃水浴下进行,分别移取1 mL不同浓度的多糖溶液,加入0.05 mol/L Tris-HCl缓冲液4 mL,再加入25 mmol/L邻苯三酚溶液0.5 mL,摇匀,静置5 min,最后以0.1 mL 8%盐酸溶液来终止反应,在325 nm处测定吸光度. 多糖的本底吸收值用蒸馏水代替邻苯三酚,空白对照用蒸馏水代替多糖溶液,阳性对照用相同浓度的维生素C进行测定.超氧阴离子自由基的清除率按式(1)进行计算.
(3)清除DPPH自由基活性的测定
DPPH溶于乙醇后呈深紫色,于517 nm出现最强吸收峰[20]. 当DPPH被清除时,由于DPPH醇溶液中单电子的含氮自由基被清除自由基的物质配对[12-13],会出现一个明显的颜色特征即溶液颜色变浅. 本文按于海洋[21]的方法稍作修改后进行测定,测定管中加入2 mL不同浓度的样品溶液、0.2 mmol/L DPPH溶液,混匀,避光静置30 min后测量517 nm处下各浓度的吸光度. 以相同浓度的维生素C作为阳性对照,以蒸馏水为空白对照,以多糖溶液与95%乙醇为本底吸光度,DPPH自由基的清除率按式(1)计算.
(4)还原力的测定
多糖的抗氧化能力可通过Fe3+被还原的数量来测定[22],分别移取2.5 mL不同浓度的样品溶液、0.2 mol/L pH6.6磷酸缓冲溶液和1%铁氰化钾溶液,摇匀,于50 ℃水浴20 min,冷却至室温,加入2.5 mL 10%三氯乙酸溶液,离心取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL 0.1%三氯化铁溶液,10 min后测定700 nm处的吸光度. 空白对照组以蒸馏水进行测定,阳性对照组以相同浓度的维生素C进行测定.
1.3 数据统计分析
重复3次实验,利用DPS13.50统计软件分析实验数据.
2 结果与分析
2.1 RPLV的提取得率
多汁乳菇子实体经3次超声破碎辅助热水浸提后,获得多汁乳菇粗多糖(CPLV),得率为6.17%. 多汁乳菇粗多糖经Sevage法脱蛋白后得多汁乳菇多糖(RPLV),得率为3.21%.
2.2 RPLV、RPHM、RPPC的化学组分
RPLV、RPHM、RPPC的化学组分如表1所示.
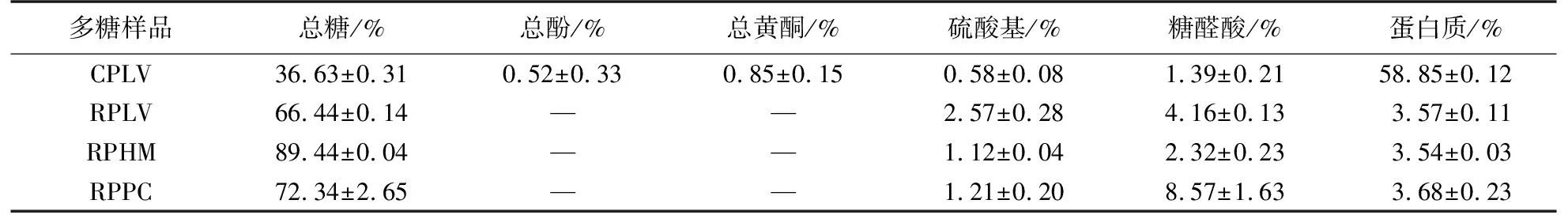
表1 RPLV、RPHM、RPPC的化学组分Table 1 Chemical composition of various polysaccharides from RPLV,RPHM,RPPC
2.3 RPLV、RPHM、RPPC的体外抗氧化活性
2.3.1 清除羟基自由基(·OH)能力
由图1可知,在0~10 mg/mL之间,RPLV、RPHM、RPPC清除羟基自由基的能力与其质量浓度呈现依赖性. 在2 mg/mL以下,RPLV、RPHM、RPPC清除羟基自由基的能力相差不大,都远低于维生素C;当浓度在 2~10 mg/mL时,RPLV、RPHM、RPPC对羟基自由基的清除率的差异比较明显,以RPPC的清除效果更好;当浓度为10 mg/mL时,RPLV、RPHM、RPPC对羟基自由基的清除率分别达到77.6%、78.9%和86.9%,RPLV与RPHM之间无显著性关系(P>0.05),RPLV与RPPC差异极显著(P<0.01),RPHM与RPPC之间差异显著(P<0.05). 由此可见,RPLV、RPHM、RPPC 3种多糖均可较好地清除羟基自由基,RPPC的清除效果最佳.

图1 RPLV、RPHM、RPPC对羟基自由基的清除率Fig.1 The scavening ability on ·OH of RPLV,RPHM,RPPC
图2显示,随着多糖浓度的增加,RPLV、RPHM、RPPC清除超氧自由基的能力呈一定的剂量-效应关系,且在这3种多糖中,RPPC的清除效果更好,但不及维生素C. 在浓度为1 mg/mL时,RPLV、RPHM、RPPC对超氧自由基的清除率分别为51.8%、58.0%和63.0%,RPLV、RPHM、RPPC三者间两两差异极显著(P<0.01). 由此可见,RPLV、RPHM、RPPC均可较好地清除超氧自由基,RPPC的清除效果最佳.

图2 RPLV、RPHM、RPPC对超氧阴离子自由基的清除率Fig.2 The scavening ability on of RPLV,RPHM,RPPC
2.3.3 清除DPPH自由基能力
由图3可知,在0~25 mg/mL范围内,随着样品的浓度增加,RPLV、RPHM、RPPC对DPPH自由基的清除能力也随之增大. 在20~25 mg/mL之间,RPHM、RPLV、RPPC清除率增加趋势放缓. 当浓度为25 mg/mL时,RPLV、RPHM、RPPC对DPPH自由基的清除率分别为51.90%、54.30%和70.63%,RPLV与RPHM差异显著(P<0.05),RPPC与RPLV、RPHM差异极显著(P<0.01). 由此可见,RPLV、RPHM、RPPC均可较好地清除DPPH自由基,以RPPC的清除效果最佳,但不及维生素C.

图3 RPLV、RPHM、RPPC对DPPH自由基的清除率Fig.3 The reducing power on ·DPPH of RPLV,RPHM,RPPC
2.3.4 还原力
由图4可知,RPLV、RPHM、RPPC的还原力与样品的质量浓度呈一定的依赖性. 在1 mg/mL以下,多糖的还原能力RPLV
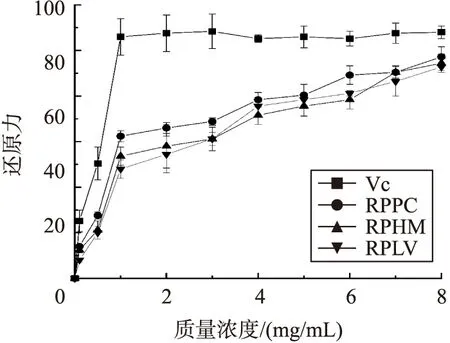
图4 RPLV、RPHM、RPPC的还原能力Fig.4 The reducing power of of RPLV,RPHM,RPPC
3 结论
自由基过多可诱发多种疾病,从而影响人体健康[23]. 清除体内过多的自由基除了靠自身条件外,还可通过摄入含有抗氧化剂的营养物质. 当前市场上出现的抗氧化剂基本上是合成药物,长期摄入可能会对人体造成伤害. 有研究表明食用菌多糖具有抗氧化[24]的功效,因此食用菌多糖在天然无毒抗氧化剂方面的应用显得日益重要,已成为当下的研究热点.

