籽瓜、黏籽和普通西瓜的果实代谢组比较
2021-10-20袁平丽何楠赵胜杰路绪强朱红菊刁卫楠龚成胜MuhammadJawadUmer刘文革
袁平丽,何楠,赵胜杰,路绪强,朱红菊,刁卫楠,龚成胜,Muhammad Jawad Umer,刘文革
籽瓜、黏籽和普通西瓜的果实代谢组比较
袁平丽,何楠,赵胜杰,路绪强,朱红菊,刁卫楠,龚成胜,Muhammad Jawad Umer,刘文革
中国农业科学院郑州果树研究所/河南省果树瓜类生物学重点实验室,郑州 450009
【】西瓜是一种广受欢迎的夏季水果,籽用西瓜(籽瓜)、黏籽西瓜和普通西瓜是3种重要的栽培类型,但对其果实中代谢物全面鉴定的研究很少,比较这3种西瓜果实的代谢组学差异,为明确驯化改良对不同类型西瓜代谢组的影响提供新见解。试验以5份籽用西瓜、5份黏籽西瓜和6份普通西瓜为材料,对成熟期果肉进行广泛靶向代谢组学检测,采用SIMCA-P、MetaboAnalyst 5.0、Origin等软件对代谢组数据进行分析。LC-MS分析共检测到323种代谢物,包括51种氨基酸及其衍生物、21种核苷酸及其衍生物、14种碳水化合物、32种有机酸、52种脂质、36种类黄酮、32种羟基肉桂酰衍生物等。PCA和聚类分析显示,籽用西瓜和黏籽西瓜的代谢组学轮廓差异较小,籽用西瓜的代谢组轮廓介于黏籽西瓜和普通西瓜之间。对分类贡献率较大的代谢物是蔗糖、柠檬酸、L-谷氨酸、L-苏氨酸、葫芦素类、香草酸糖苷异构体、脂质类等。聚类热图分析显示黏籽西瓜中特有的代谢物是葫芦素及其衍生物等,籽用西瓜中的绿原酸、LysoPE脂质类等化合物含量较高,普通西瓜中的糖类、精氨酸、阿魏酸及C18-2和C18-3不饱和脂肪酸等物质含量较高。比较分析共鉴定出156种差异代谢物,籽用西瓜与黏籽西瓜的主要差异代谢物有对香豆醛、阿魏酸、肉桂酸、蔗糖、葫芦素D O-葡萄糖苷、葫芦素E异构体、牡荆素、松柏醇等。籽用西瓜与普通西瓜的主要差异代谢物有脂质类、类黄酮类、有机酸类和糖类等。随着作物进化的程度增加,营养类代谢物质含量增加,抗性相关的代谢物质含量减少。籽用西瓜和黏籽西瓜的果实代谢组差异比籽用西瓜和普通西瓜的差异小,籽用西瓜的代谢轮廓介于黏籽西瓜和普通西瓜之间。除了表型和基因组差异外,代谢组差异也可以作为区分品种的重要依据。本研究首次在代谢组学水平比较了3种类型西瓜果实的差异,对深入理解西瓜种质资源,培育保健型西瓜新品种有重要的指导意义。
黏籽西瓜;籽用西瓜;普通西瓜;代谢组学;差异代谢物;驯化改良
0 引言
【研究意义】西瓜()原产非洲,属于葫芦科一年生蔓生作物。西瓜在中国的栽培面积和产量均居世界第一[1]。普通西瓜果实中富含水分、类胡萝卜素、维生素C、瓜氨酸等多种有益健康的物质[2]。西瓜属包括7个种,属内栽培类型繁多[3-4],具有一定栽培规模的有黏籽西瓜、籽用西瓜和普通西瓜。普通西瓜即日常消费的鲜食甜西瓜,黏籽西瓜是西非国家的重要经济作物[5]。籽用西瓜是我国西北旱区的主要经济作物[6-7],籽瓜籽具有很高的营养价值和经济价值,籽瓜瓤有利尿、润肺、益肝、健脾等疗效[8-10]。对这3种类型的西瓜果肉进行代谢组学检测,可以全面掌握其果实中的代谢物构成,充分利用西瓜种质资源。【前人研究进展】植物代谢组学是对植物特定组织中整体代谢水平的检测,已在水稻[11-12]、玉米[13]、拟南芥[14]、番茄[15]、生菜[16]、大豆[17]和甜瓜[18]等作物上开展了大量试验,可用于代谢物的积累模式及其遗传基础研究。崔霞霞等[19]对5份西瓜材料的果实代谢产物进行分析,从高糖和低糖材料中鉴定出58种代谢物,其中22种代谢物存在显著差异。Aslam等[20]对以南瓜为砧木嫁接的西瓜果实发育过程中的56种初生代谢物进行了分析,发现鸟氨酸、精氨酸、赖氨酸、葡萄糖、蔗糖、葡萄糖胺、苹果酸、富马酸和琥珀酸是影响果实品质的主要代谢物。Sulaiman等[21]利用H-NMR技术在红、黄果肉的西瓜中鉴定了36种代谢物,其中番茄红素、-胡萝卜素、叶黄素和前番茄红素为西瓜红色和黄色果肉的主要差异代谢物。此外,还对西瓜果实中的糖类、有机酸类、瓜氨酸、维生素C、番茄红素等物质进行了靶向检测和比较分析[2,22-24]。【本研究切入点】黏籽西瓜、籽用西瓜和普通西瓜的果实表型差异明显,其果实中的代谢物组成和含量并未被完全揭示和利用,目前还未见关于这3种类型西瓜代谢组学差异研究的详细报道。【拟解决的关键问题】本研究利用广泛靶向代谢组学技术对黏籽西瓜、籽用西瓜和普通西瓜的果实代谢组进行测定,分析其整体代谢组轮廓并筛选差异代谢物,比较具体代谢物在3种类型西瓜中的积累模式,为明确这3种类型西瓜的果实代谢组学差异和充分利用西瓜种质资源提供依据。
1 材料与方法
1.1 试验材料
所有供试材料的种子由中国农业科学院郑州果树研究所国家西瓜甜瓜中期库和多倍体西瓜遗传育种课题组保存。根据种质特点挑选具代表性的5份黏籽西瓜、5份籽用西瓜和6份普通西瓜(表1),均为纯种自交系。2018年春季在中国农业科学院郑州果树研究所新乡综合实验基地种植。种子统一破壳处理,浸泡2.5 h后,用棉布包好,于培养箱中32℃条件下催芽,芽长0.5 cm时播种于营养钵中,苗期统一管理。实生苗播种后35 d移栽至大棚,随机区组设计,行间距1.6 m,株间距0.8 m,地膜覆盖,浇水、施肥、除草等所有田间栽培管理措施一致。开花期人工授粉,在第二雌花节位留单瓜。于开花前1 d将雌雄花分别套上纸帽,次日开花后自交授粉,并标记授粉日期。
1.2 果实表型调查及取样
根据授粉日期,西瓜果实在成熟期采收,每个品种选均匀一致的9个果实,纵切后每3个西瓜果实的果肉混合取样作为一个生物学重复。每个品种设置3个生物学重复。样品装在50 mL离心管中,立即用液氮速冻,然后带回实验室存放于-80℃超低温冰箱保存,待用。肉眼观察果肉颜色并拍照,手持糖度计(SCTDJ-020)测量可溶性固形物含量,硬度计(GY4)测量果肉硬度,酸度计(PHS-3C)测量果肉pH,普通直尺测量果皮厚度,普通电子秤测量果实的重量。
1.3 广泛靶向代谢组学检测
从超低温冰箱取出的果肉样品,经过真空冷冻干燥后,利用研磨仪(MM 400,Retsch)在50 Hz条件下研磨1 min;称取100 mg的粉末,用含有内标的70%甲醇1.0 mL于4℃过夜提取,其间涡旋混匀。提取后,10 000×离心10 min,吸取上清液,用微孔滤膜(0.22 μm pore size)过滤样品,随后用于液相色谱串联质谱(LC-MS)分析。广泛靶向代谢组学检测在武汉迈特维尔生物科技有限公司开展。
1.4 统计分析
Excel进行数据整理,Origin 2020b软件进行统计分析和作图,SIMCA-P 14.1软件对代谢组数据进行Par标准化处理,再进行主成分分析(PCA)和正交偏最小二乘法判别分析(OPLS-DA),TBtools(v1.082)进行热图绘制,MetaboAnalyst 5.0进行相关模式分析。Photoshop CS6进行图片处理。
2 结果
2.1 籽用西瓜、黏籽西瓜和普通西瓜的果实表型特征
籽用西瓜与黏籽西瓜的果实表型差异相对较小,但二者和普通西瓜果实有明显的表型差异。主要体现在果肉颜色、糖度、酸度、硬度、皮厚及果实大小等性状上(表1)。黏籽西瓜和籽用西瓜的果肉均为白色(除‘红瓜子’外),普通西瓜果肉更鲜艳,表现为红色或者黄色;黏籽西瓜和籽用西瓜的果肉糖含量低,平均可溶性固形物含量(Brix%)分别为3.06和4.70,但是普通西瓜的含糖量较高,平均为8.64;黏籽西瓜和籽用西瓜的果肉较硬,平均硬度分别是6.01和4.15 kg∙cm-2,普通西瓜的果肉较酥脆,平均硬度为0.90 kg∙cm-2;黏籽西瓜和籽用西瓜的果肉稍酸,平均pH分别是4.68和4.79,普通西瓜果肉无酸味,平均pH为5.56。另外,黏籽西瓜和籽用西瓜的果皮比普通西瓜要厚;普通西瓜和籽用西瓜作为中国主要的经济作物,果实重量比黏籽西瓜大。
2.2 籽用西瓜、黏籽西瓜和普通西瓜的果实代谢组轮廓
西瓜果实是人类食用的重要部分,集中了主要的育种目标。通过对黏籽西瓜、籽用西瓜和普通西瓜的果肉组织进行广泛靶向代谢组学检测,共得到323种已知代谢物,包括51种氨基酸及其衍生物、21种核苷酸及其衍生物、14种碳水化合物、32种有机酸、52种脂质、7种维生素、36种类黄酮、32种羟基肉桂酰衍生物、9种苯甲酸衍生物、9种三萜葫芦素等。无监督的PCA分析可以同时反映组内和组间的差异,因此对所有样本的代谢组数据进行PCA分析(图1),发现3种类型西瓜的果肉代谢物轮廓有明显的分离趋势,各自聚类在一起,即3种类型的西瓜果肉代谢谱差异明显。其中主成分1可以将普通西瓜和其他两种类型西瓜区分开,主成分2可以将籽用西瓜和其他两种类型西瓜区分开。黏籽西瓜和籽用西瓜被主成分1划分在一起,他们之间的代谢组差异比籽用西瓜和普通西瓜的代谢组差异小,籽用西瓜的代谢组轮廓介于黏籽西瓜和普通西瓜之间,并且有一定的品种特异性。PCA的载荷图(loading plot)可以用来寻找差异变量,距离原点越远的代谢物被认为对样本的分类贡献率越大。从载荷图(图2)可以看出,对分类贡献率较大的代谢物是蔗糖、柠檬酸、L-谷氨酸、L-苏氨酸、葫芦素类、香草酸糖苷异构体、脂肪酸类等。这些差异代谢物可以作为标记性代谢物来区分不同类型的西瓜品种。
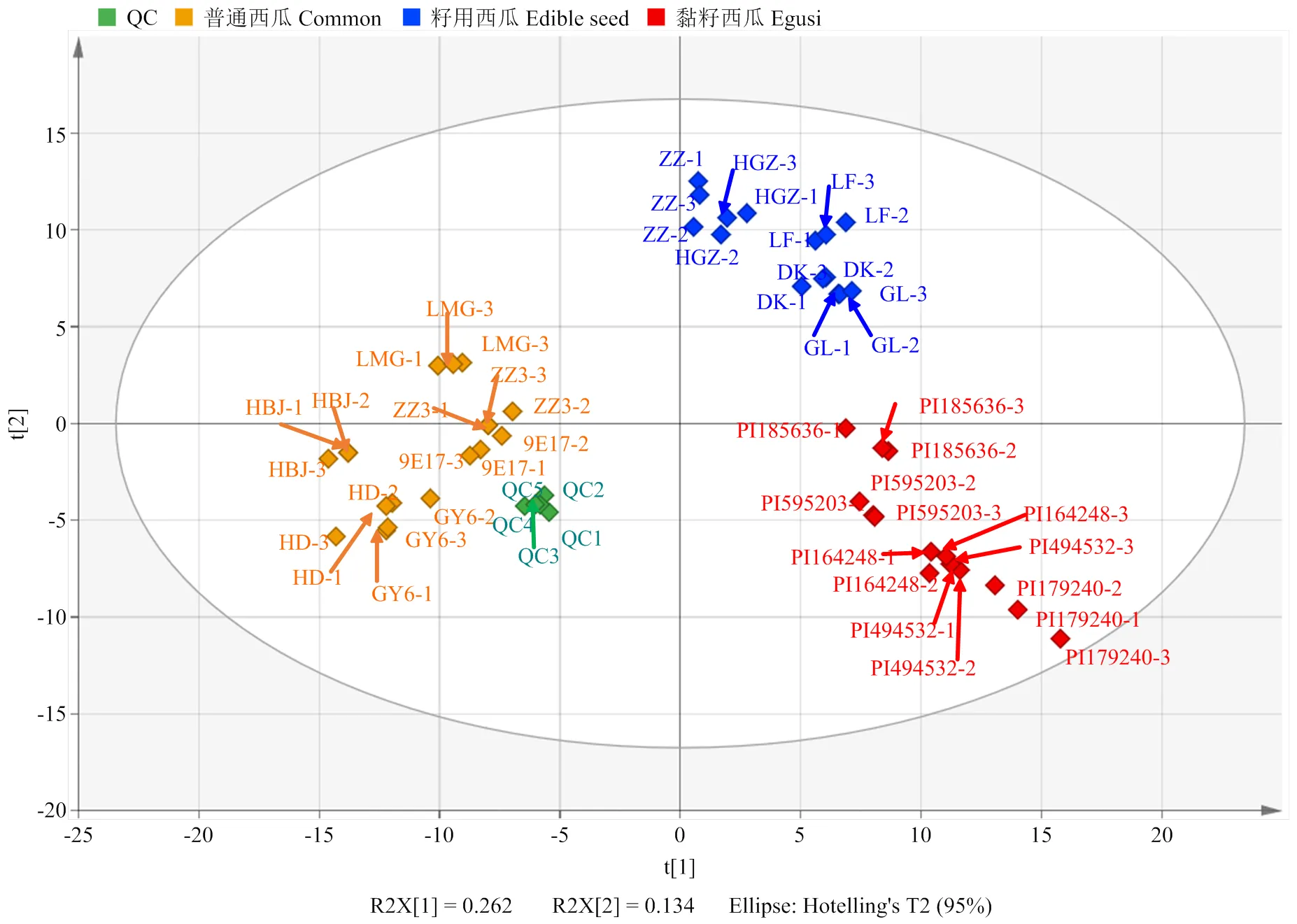
QC:质控样品 QC: Quality control samples
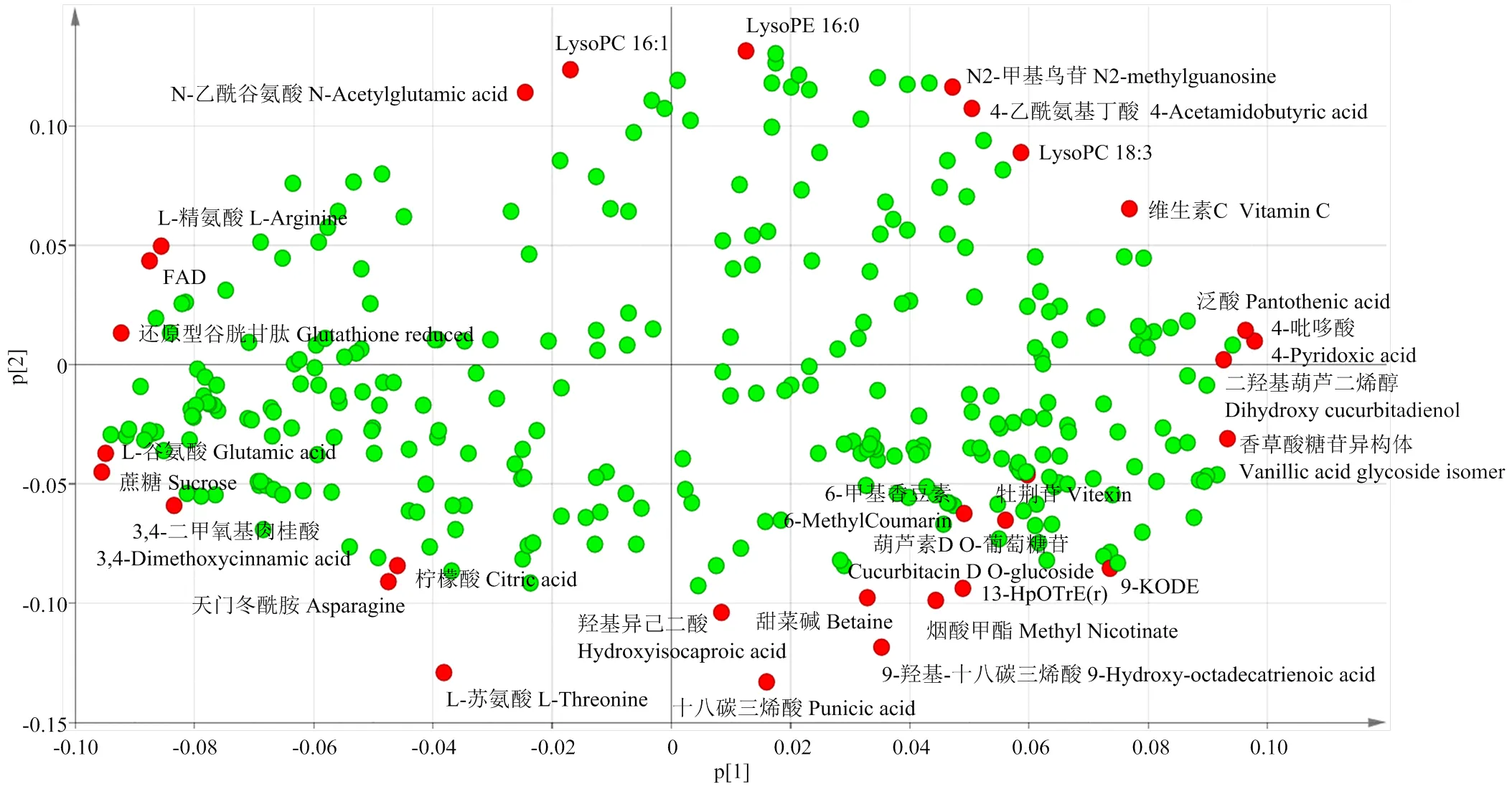
图2 3种类型西瓜果实代谢组的PCA载荷图
从聚类热图的结果可以看出(图3),籽瓜和黏籽西瓜的代谢谱特征更为相似,普通西瓜单独聚为一类。普通西瓜中含量明显较高的有蔗糖、单糖、组氨酸、L-精氨酸、L-瓜氨酸、L-谷氨酸、阿魏酸、对香豆酸、柠檬酸、肉桂酸、C18-2和C18-3不饱和脂肪酸等,显示在热图的左上角区域(红色框)。籽瓜中含量较高的是绿原酸、L-色氨酸、左旋肉碱、木犀草素、氨基葡萄糖、LysoPE16:0和LysoPC17:0等代谢物(黑色框)。黏籽中特有含量较高的是葫芦素糖苷类物质或异构体、葫芦巴碱、木犀草素-O-葡萄糖苷、木犀草素-C-葡萄糖苷、亚麻酸、牡荆素等代谢物(黄色框)。黏籽和籽用西瓜中含量都高而在普通西瓜中含量低的代谢物有维生素C、橙皮苷、犬尿喹啉酸、D-泛酸等有机酸、香兰素苷异构体、对氨基苯甲酸盐等苯甲酸衍生物、二羟基葫芦二烯醇、原儿茶酸、4-吡哆醇酸等(绿色框)。
2.3 黏籽西瓜-籽用西瓜和籽用西瓜-普通西瓜的差异代谢物
为了成对比较两种栽培类型之间的代谢物差异,对黏籽西瓜-籽用西瓜,籽用西瓜-普通西瓜分别进行OPLS-DA模型分析,图4显示两组中不同类型的西瓜可以被明显区分开来,表明OPLS-DA构建的模型参数拟合效果较好(表2)。
在OPLS-DA分析中,模型变量的变量权重值(variable important in projection,VIP)可以衡量各代谢物积累差异对各组样本分类判别的影响强度和解释能力,挖掘具有生物学意义的差异代谢物。VIP≥1为常见的差异代谢物筛选标准,本研究结合变化倍数(FC,fold change)进行差异代谢物筛选(VIP≥1,FC>2或FC<0.5)。结果显示黏籽西瓜和籽用西瓜的差异代谢物有75种(表3),主要是脂质、羟基肉桂酰衍生物、有机酸、碳水化合物、黄酮类等。与黏籽相比,籽瓜中上调的代谢物有31种,下调的代谢物有44种。对香豆醛、阿魏酸、肉桂酸、蔗糖、L-蛋氨酸、胆固醇、LysoPC16:1、MGMG(18:2)异构体、丁二醇乙酸酯等代谢物表现为上调;6-甲基香豆素、葫芦素D O-葡萄糖苷、葫芦素E异构体、牡荆素、松柏醇、D-苏氨酸、组氨酸等代谢物表现为下调。籽用西瓜和普通西瓜的差异代谢物有115种(表4),主要是脂质、有机酸、碳水化合物、黄酮、氨基酸类。与籽瓜相比,普通西瓜中上调的代谢物有45种,下调的代谢物有70种。对香豆酸苷异构体、MAG(18:1)、DGMG(18:2)异构体、D-松三糖、-异丙基苹果酸、5-羟基己酸、琥珀酸、精氨酸、柠檬酸、组氨酸、L-谷氨酸、L-苏氨酸、UDP-D-葡萄糖、D-葡萄糖醛、蔗糖、吡哆醇(维生素B7)等代谢物表现为上调,Lyso PC14:0、Lyso PC16:2、Lyso PC18:3、牡荆素、木犀草素C-己糖苷、木犀草素O-己糖苷、D-泛酸、反式玉米素N-葡萄糖苷、4-乙酰氨基丁酸、犬尿喹啉酸、原儿茶酸等代谢物表现为下调。
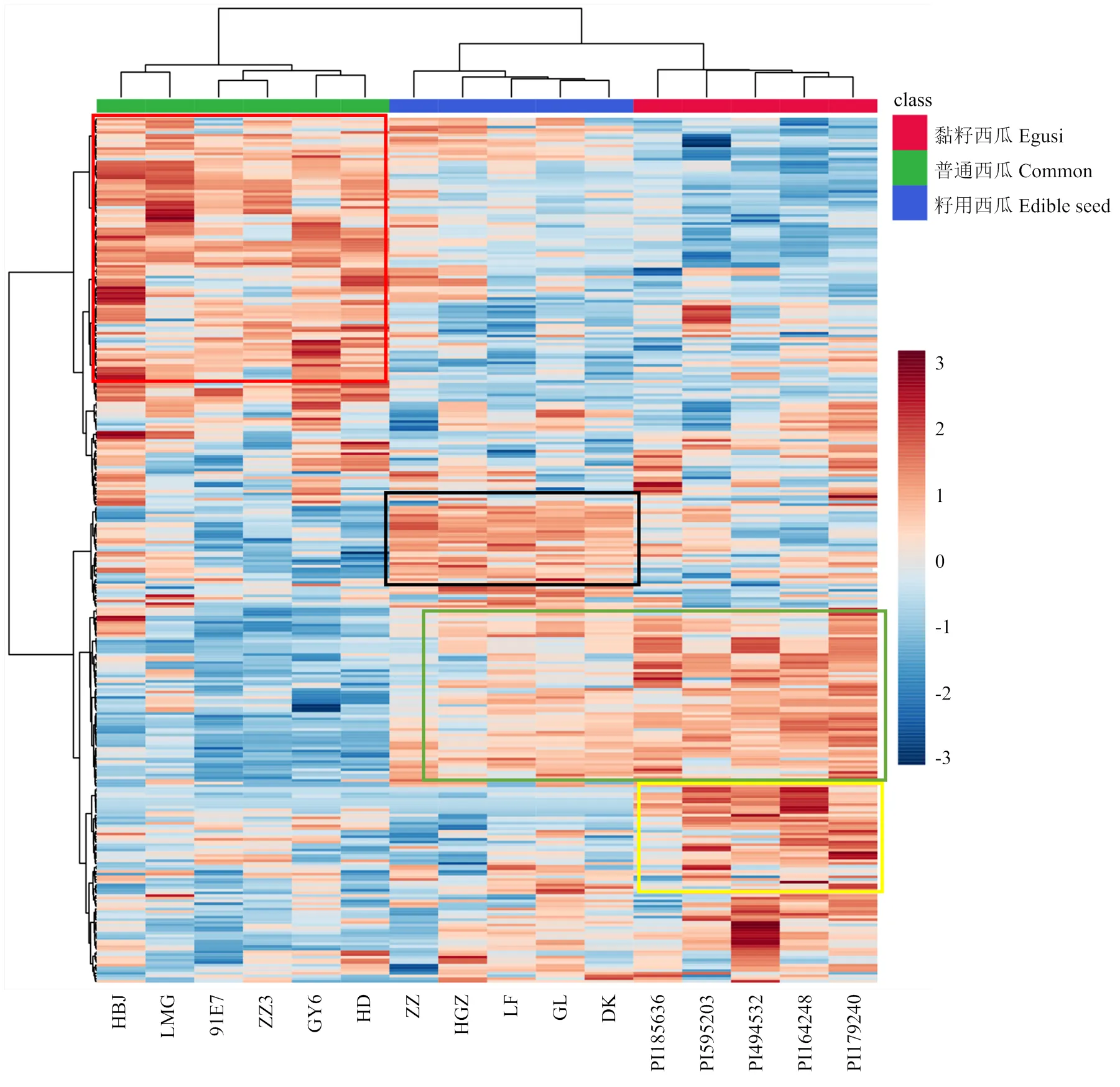
图3 3种类型西瓜代谢组数据聚类分析

表2 黏籽西瓜-籽用籽瓜和籽用西瓜-普通西瓜的OPLS-DA模型的评价参数
A:主成分数,1+4(1代表主成分t1,4代表正交主成分数目);R2X、R2Y:模型解释率;Q2:模型预测能力。R2Y和Q2越接近1表明模型越稳定可靠
A: The principal components number, 1+4 (1 represents the principal component t1, 4 represents the number of orthogonal principal components); R2X, R2Y: The model interpretation rate; Q2: The model predictive ability. R2Y and Q2closer to 1 indicates that the model more stable and reliable

表3 籽用西瓜-黏籽西瓜的差异代谢物
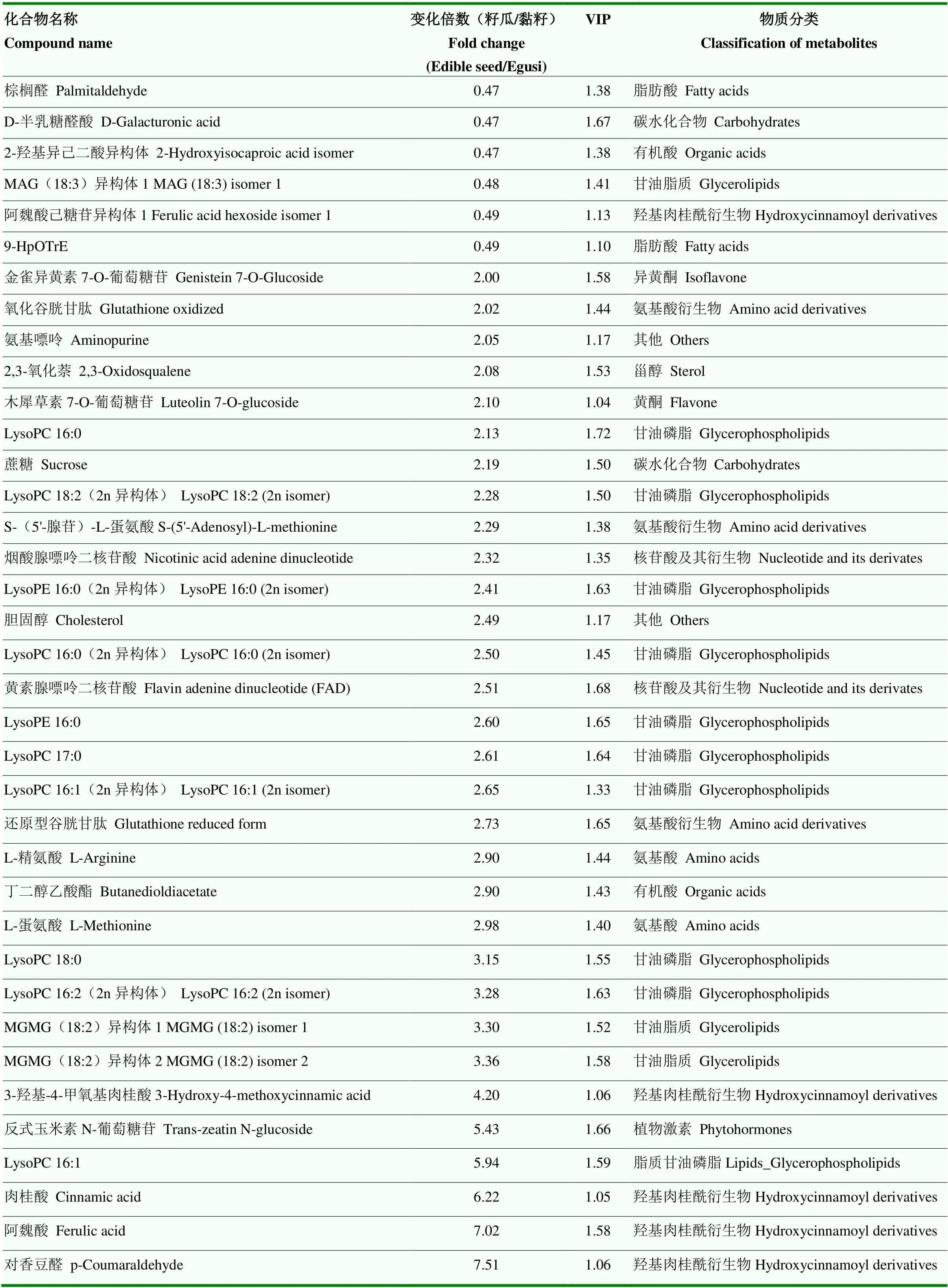
续表3 Continued table 3

表4 籽用西瓜-普通西瓜的差异代谢物

续表4 Continued table 4

续表4 Continued table 4
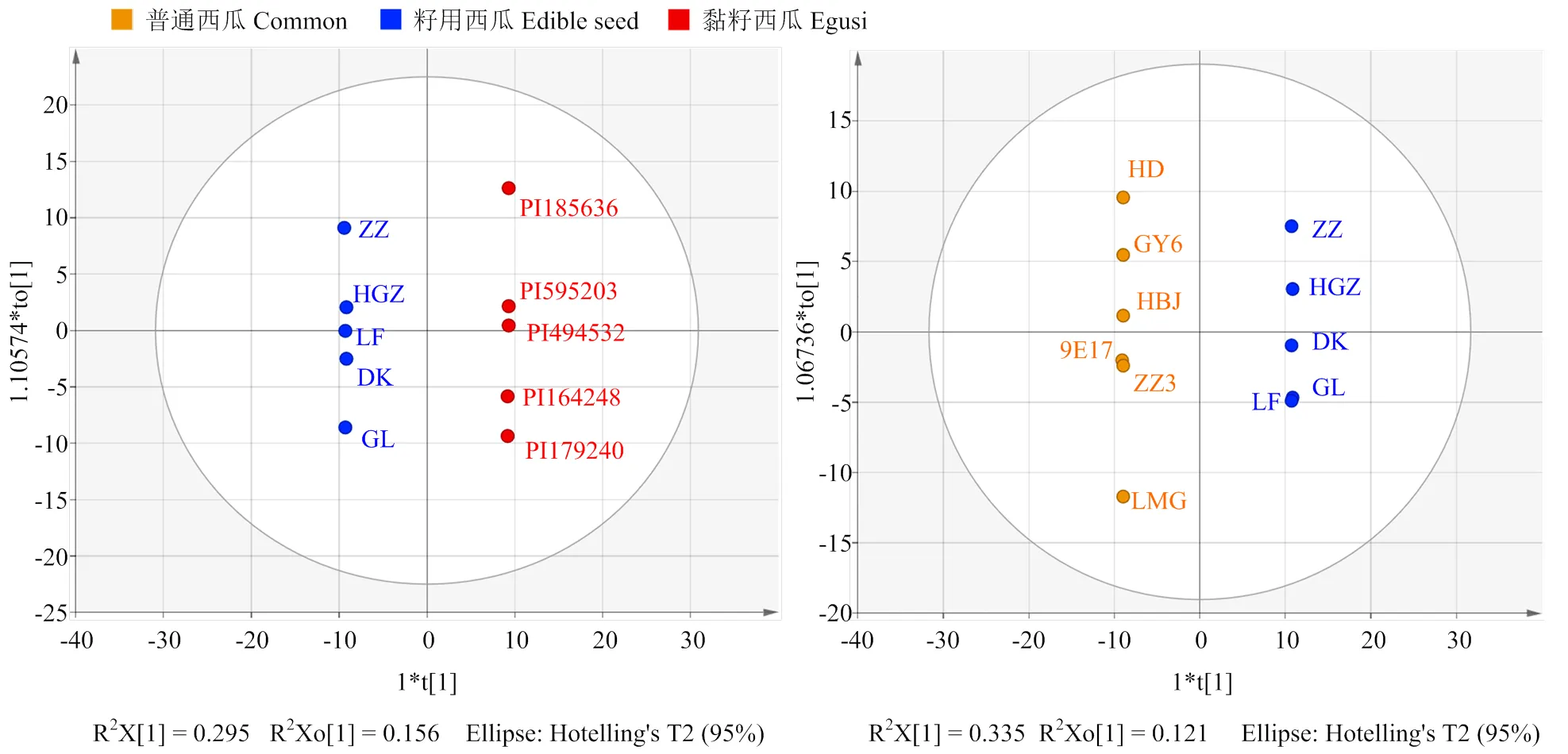
图4 OPLS-DA分析得分图
2.4 黏籽西瓜-籽用西瓜-普通西瓜的代谢物积累相关模式
根据西瓜驯化和被栽培的程度以及果实的可食性程度,假定从黏籽西瓜到籽用西瓜再到普通西瓜的驯化过程,通过代谢物积累相关模式分析(correlation>0.6,FDR<0.1)(图5),发现在黏籽西瓜-籽用西瓜-普通西瓜模式中,呈逐渐上升趋势的代谢物有蔗糖、MGMG (18:2)异构体、MAG (18:1)异构体、LysoPC 18:0、LysoPC 18:1及其异构体、丁二醇乙酸酯、L-谷氨酸、L-精氨酸、L-蛋氨酸、半胱氨酰甘氨酸、还原型谷胱甘肽、S(甲基)-谷胱甘肽、烟酸腺嘌呤二核苷酸、尿苷5′-二磷酸葡萄糖二钠盐和UDP-α-D-葡萄糖,其参与植物的各种代谢途径,并且对人体健康有益。呈逐渐下降趋势的代谢物有异亮氨酸己糖异构体、5-甲氧基-N,N-二甲基色氨、小麦黄素糖酸、香兰酸苷异构体、金圣草素8-C-己糖苷、2-O-戊糖基-6木犀草素、犬尿喹啉酸、芹菜素C-葡萄糖苷、7-甲基黄嘌呤、4-吡哆醇酸、牡荆素、异牡荆素、D-泛酸、松柏醛、黄柏红素F、松柏醇(阿魏醇)、邻苯二甲酸酐、香兰素、葫芦素E异构体、二羟基葫芦二醇、木犀草素C-己糖苷、异半皮桉苷、3,4-二羟基苯乙酸、枸橼苦素A异构体1、Lysoc 14:0(2n异构体)等。这些多是黄酮类物质,可以提高植物的抗逆、抗病性,但是对消费者的口感有负面影响。
2.5 主要代谢物的含量分析
西瓜果实中有很多被广泛关注的代谢物,其与果实的口感、人体健康或作物抗病性相关。对这些关注度较高的代谢物进行比较分析(图6),结果显示,普通西瓜中的瓜氨酸、柠檬酸、琥珀酸、肉桂酸、阿魏酸、L-蛋氨酸、蔗糖、单糖、谷胱甘肽含量显著高于其他两种西瓜,这些代谢物与营养、口感和风味相关。绿原酸、维生素C、苹果酸、L-色氨酸、L-亮氨酸在籽用西瓜中的含量最高,其中绿原酸与植株生长或抗性相关。黏籽西瓜中含量较高的有D-松三糖O-鼠李糖苷、木犀草素-O-己糖苷、葫芦素B O-葡萄糖苷,这些代谢物在黏籽西瓜中可以增强植物的抗逆及抗病能力。不同类型的西瓜所积累的代谢物含量有明显差异,这与其自身生长的生态环境和人类的选育方向相关。
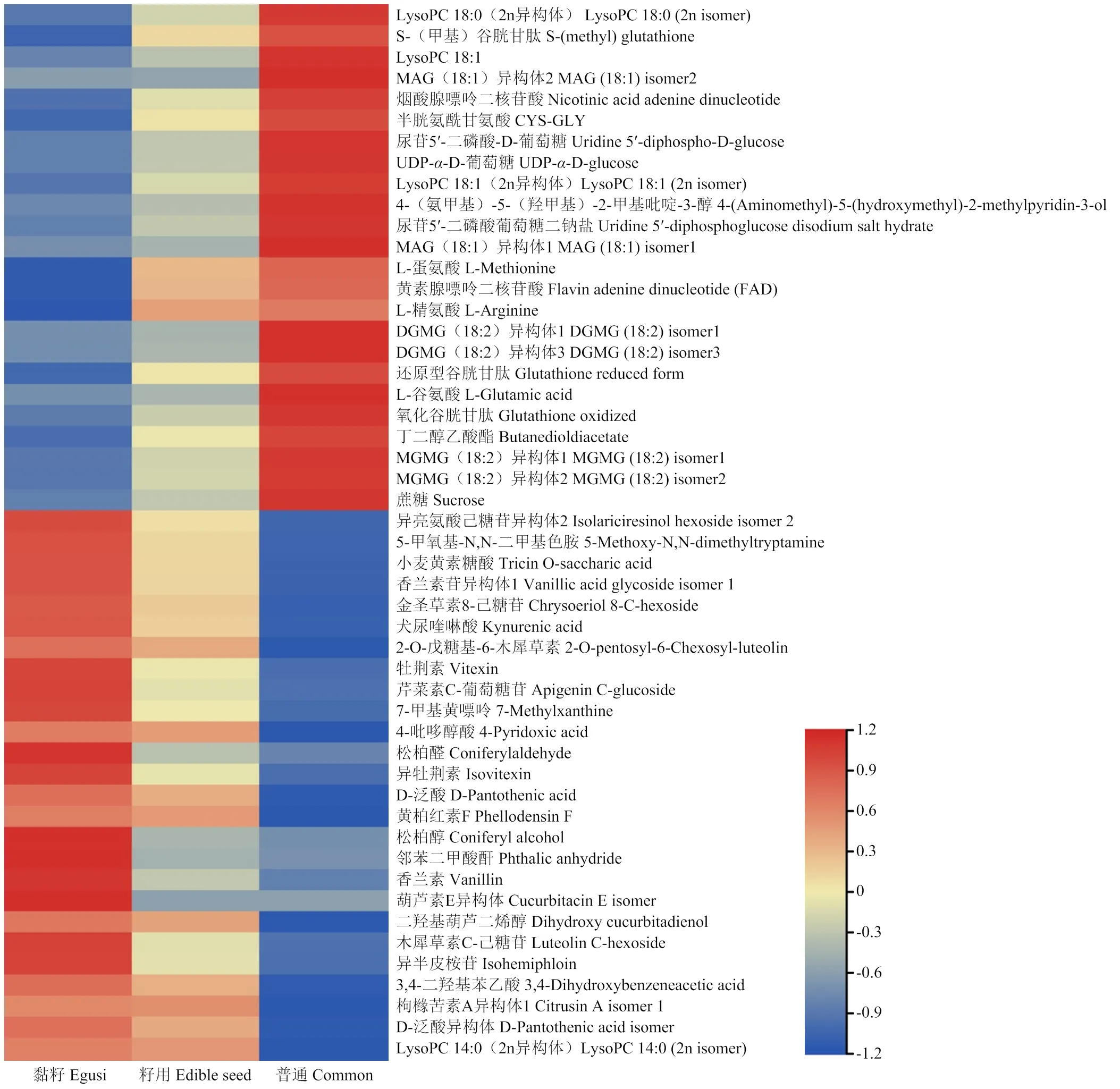
图5 黏籽-籽用-普通西瓜代谢物积累模式分析
3 讨论
籽用西瓜是中国西北旱区的主要经济作物,种植面积约32万hm2[6]。但是其副产品瓜瓤的丢弃也越来越多,如何使瓜瓤变废为宝,理解籽瓜果肉的代谢组构成是第一步。本草纲目记载“籽瓜性味甘,籽瓜入心脾胃,肉有降心脾胃热,止消渴”。籽瓜瓤中含有多种氨基酸、矿物质和维生素等营养物质[25-27]。籽瓜糖度低,适合糖尿病病人食用,本研究也发现籽瓜中多种活性成分的含量较高,如D-松三糖O-鼠李糖苷、绿原酸、L-色氨酸、维生素C、苹果酸、L-亮氨酸、左旋肉碱、木犀草素、氨基葡萄糖等代谢物的含量比普通西瓜高,籽用西瓜的代谢组轮廓介于黏籽西瓜和普通西瓜之间,可以看作一种过渡类型,育种家可以用黏籽西瓜和普通西瓜中的优良基因改良籽用西瓜,培育抗病性强、低糖保健型籽用西瓜新品种,并综合开发籽用西瓜瓜瓤的医疗、保健、美容功能,促进籽用西瓜的综合利用效率。
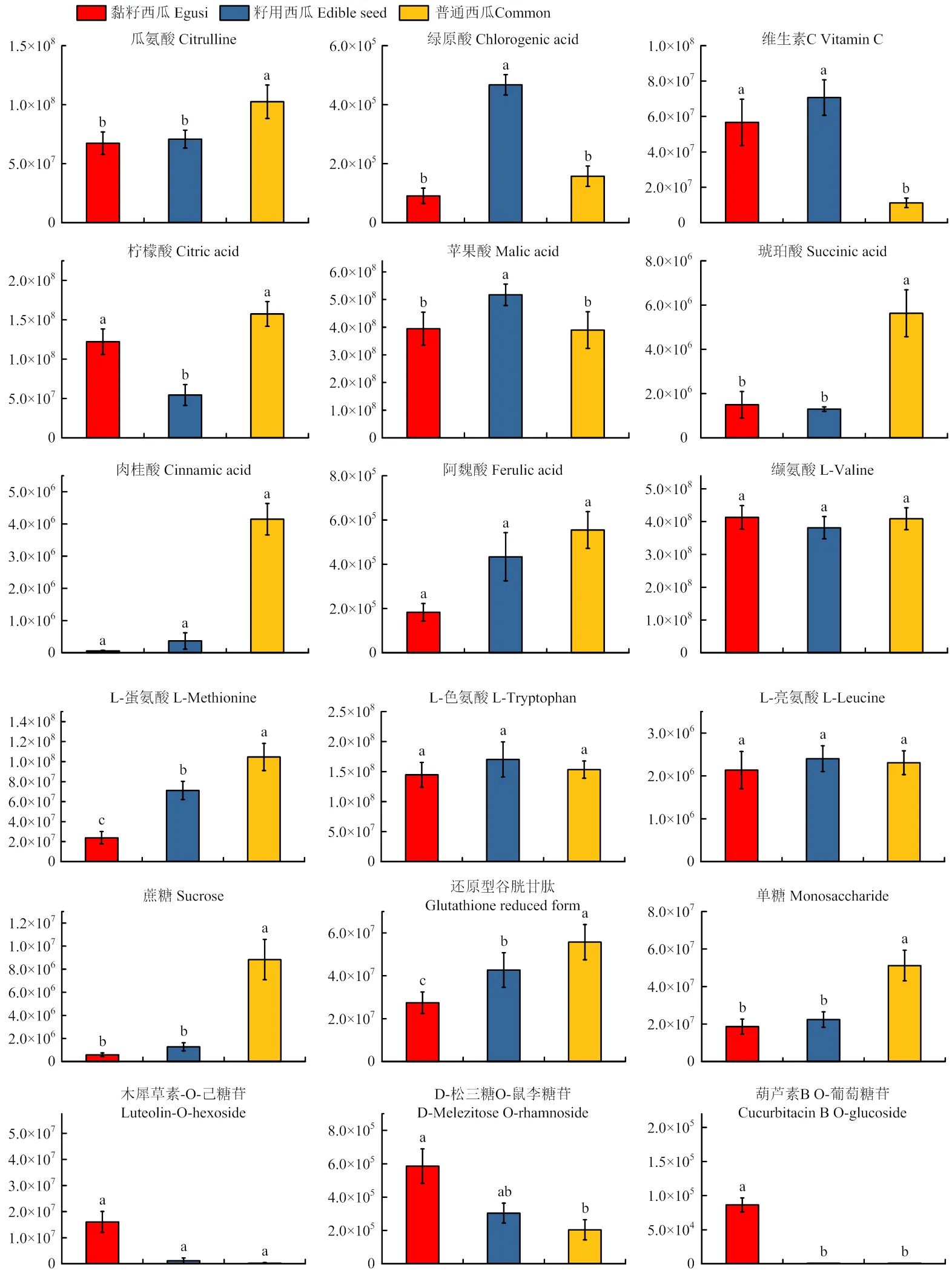
不同小写字母表示在P<0.05水平差异显著(最小显著性差异法) Different lowercase letters indicate significant difference (P<0.05) (Fisher LSD test)
育种家在选择果肉颜色、口感或果重等主要育种目标的同时,其整个代谢组都会发生协同变化,这个概念类似于番茄上的“搭车效应(hitchhiking)”[28]。同一物种内的不同品种,少数几个基因,甚至一个基因的变化,都会导致代谢物的巨大变化。例如番茄果重、甜瓜成熟的遗传机制都较简单[28-29],但是其初生和次生代谢物都发生了重要变化[18]。本研究基于广泛靶向代谢组学方法得出3种类型西瓜的果实代谢组轮廓差异明显。特别是籽用西瓜和普通西瓜都属于西瓜种,分子标记显示其亲缘关系近,遗传基础狭窄[30-31],由于育种目标的不同(籽用、鲜食)造成其果实表型的差异,本研究基于广泛靶向的代谢组学数据也显示籽用西瓜和普通西瓜在代谢组学方面的明显差异。该结果进一步说明,代谢组学作为表型和基因组的桥梁[32],可以放大表型或者基因组差异,帮助找到不同种质之间表型和基因差异之外更多的差异性状,深入理解不同种质间的区别。
基于代谢组学的系统发育分析,或称化学分类系统学,从上个世纪初就开始有人尝试[33],尤其在70年代特别流行,化学系统分类与分子多态性系统分类的结果总体上一致[34],而且这些分析主要针对同属内不同种作物之间的差异比较。基于少数或部分代谢物的数据不足以支撑同种内的分类关系,大规模代谢组数据的整合才能分析种内各品种的关系[35-36]。Moing等[18]认为广泛的非靶向代谢组学/化合物特征数据集可以强烈反应(不是全部)品种间的遗传分类。本研究中,利用广泛靶向方法得到的代谢组学数据,代表着一种广泛性的变化,既有对育种选择价值较高的靶向代谢物(糖、酸等),还有很多具有较低育种选择价值的代谢物(氨基酸、核苷酸、类黄酮、脂质、羟基肉桂酰类代谢物等),这些育种选择价值低的代谢物代表着趋同育种性状(convergent traits),认为这些代谢物和基因组数据中的四倍简并位点(fourfold degenerate synonymous site,4DTv)具有一定的相似性,其受到自然或人工选择的纠正少,更为中性,可以更好地展示不同材料之间的真实差异,揭示品种间的亲缘关系。综上,得到3种西瓜类型之间的代谢组学差异,可以与基于植株表型和DNA分子标记的植物分类鉴定相互补充,用来辅助植物分类,进一步明晰西瓜驯化育种历程。
植物中的初生和次生代谢物可达20万至100万种[37-38],任何单一的检测平台都不能够得到所有的代谢物。因此,下一步工作可以联合多个检测平台得到更全面的代谢组数据;可以结合基因组、转录组数据分析西瓜不同栽培类群的关系;可以开展基于代谢组的全基因组关联分析(mGWAS),挖掘调控代谢物积累的关键候选基因。逐步解析西瓜果实代谢组学的生化和遗传基础,为代谢组学辅助西瓜育种奠定基础。
4 结论
本研究通过对黏籽西瓜、籽用西瓜和普通西瓜成熟期果肉的广泛靶向代谢组学分析,共检测到323种代谢物,不同类型西瓜的果肉代谢组差异明显,籽用西瓜的代谢轮廓介于黏籽西瓜和普通西瓜之间。蔗糖、柠檬酸、L-谷氨酸、葫芦素、脂质等差异代谢物可以作为标记性物质来区分不同类型的西瓜品种。随着西瓜进化的程度不断增加,蔗糖、L-谷氨酸、L-精氨酸、谷胱甘肽等对人体有益的营养类代谢物质含量逐渐增加,麦黄酮O-葡糖酸、芹菜素C-葡萄糖苷、7-甲基黄嘌呤、4-吡哆醇酸、牡荆素、葫芦素E异构体等,与植物抗性相关但不利于口感的代谢物质含量逐渐减少。
[1] 刘文革, 何楠, 赵胜杰, 路绪强. 我国西瓜品种选育研究进展. 中国瓜菜, 2016, 29(1): 1-7.
LIU W G, HE N, ZHAO S J, LU X Q. Advances in watermelon breeding in China. China Cucurbits and Vegetables, 2016, 29(1): 1-7. (in Chinese)
[2] 万学闪, 刘文革, 阎志红, 赵胜杰, 何楠, 刘鹏, 代军委. 西瓜果实发育过程中番茄红素、瓜氨酸和Vc等功能物质含量的变化. 中国农业科学, 2011, 44(13): 2738-2747.
WAN X S, LIU W G, YAN Z H, ZHAO S J, HE N, LIU P, DAI J W. Changes of the contents of functional substances including lycopene, citrulline and ascorbic acid during watermelon fruits development. Scientia Agricultura Sinica, 2011, 44(13): 2738-2747. (in Chinese)
[3] ZHANG H Y, FAN J G, GUO S G, REN Y, GONG G Y, ZHANG J, WENG Y Q, DAVIS A, XU Y. Genetic diversity, population structure, and formation of a core collection of 1197accessions. HortScience, 2016, 51(1): 23-29.
[4] RENNER S S, SOUSA A, CHOMICKI G. Chromosome numbers, Sudanese wild forms, and classification of the watermelon genus, with 50 names allocated to seven biological species. Taxon, 2017, 66(6): 1393-1405.
[5] ACHIGAN-DAKO E G, AVOHOU E S, LINSOUSSI C, AHANCHEDE A, VODOUHE R S, BLATTNER F R. Phenetic characterization ofspp. (Cucurbitaceae) and differentiation of egusi-type (). Genetic Resources and Crop Evolution, 2015, 62(8): 1159-1179.
[6] 陈菁菁, 许勇, 张建农, 陈年来. 我国籽用西瓜生产与研究进展. 中国蔬菜, 2015(12): 12-18.
CHEN J J, XU Y, ZHANG J N, CHEN N L. Production and research of seed using watermelon in China. China Vegetables, 2015(12): 12-18. (in Chinese)
[7] 甘肃省园艺学会瓜类专业委员会. 对黑籽瓜生产与研究中一些术语与标准界定的意见. 中国西瓜甜瓜, 1999, 12(2): 31-33.
Gansu Horticultural Society Cucurbits Professional Committee. Some terms and standards in the production and research of black edible seed watermelon. China Watermelon and Muskmelon, 1999, 12(2): 31-33. (in Chinese)
[8] 徐明慧, 张清华. 打瓜高产栽培管理. 特种经济动植物, 2011, 14(1): 34-35.
XU M H, ZHANG Q H. High yield cultivation and management of Da Gua. Special Economic Animal and Plant, 2011, 14(1): 34-35. (in Chinese)
[9] 中国农业科学院郑州果树研究所. 中国西瓜甜瓜. 北京: 中国农业出版社, 2000.
Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences. China Watermelon and Muskmelon. Beijing: Chinese Agriculture Press, 2000. (in Chinese)
[10] 林淑敏, 刘谨, 刘彤, 陶东, 王诚忠. 甘肃鲜食籽瓜产业开发前景. 农业科技与信息, 2011, 8(21): 9-11.
LIN S M, LIU J, LIU T, TAO D, WANG C Z. Development prospect of fresh seed melon industry in Gansu Province. Agricultural Science and Technology and Information, 2011, 8(21): 9-11. (in Chinese)
[11] Chen W, Gao Y Q, Xie W B, Gong L, Lu K, Wang W S, Li Y, Liu X Q, Zhang H Y, Dong H X, Zhang W, Zhang L J, Yu S B, Wang G W, Lian X M, Luo J. Genome-wide association analyses provide genetic and biochemical insights into natural variation in rice metabolism. Nature Genetics, 2014, 46(7): 714-721.
[12] GOFF S A, RICKE D, LAN T H, PRESTING G, WANG R L, DUNN M, GLAZEBROOK J, SESSIONS A, OELLER P, VARMA H, HADLEY D, HUTCHISON D, MARTIN C, KATAGIRI F, LANGE B M, MOUGHAMER T, XIA Y, BUDWORTH P, ZHONG J P, MIGUEL T,. A draft sequence of the rice genome (L. ssp.). Science, 2002, 296(5565): 92-100.
[13] FU J J, CHENG Y B, LINGHU J J, YANG X H, KANG L, ZHANG Z X, ZHANG J, HE C, DU X M, PENG Z Y, WANG B, ZHAI L H, DAI C M, XU J B, WANG W D, LI X R, ZHENG J, CHEN L, LUO L H, LIU J J, QIAN X J, YAN J B, WANG J, WANG G Y. RNA sequencing reveals the complex regulatory network in the maize kernel. Nature Communications, 2013, 4: 2832.
[14] HAAS B J, DELCHER A L, MOUNT S M, WORTMAN J R, JR R K S, HANNICK L I, MAITI R, RONNING C M, RUSCH D B, TOWN C D, SALZBERG S L, WHITE O. Improving thegenome annotation using maximal transcript alignment assemblies. Nucleic Acids Research, 2003, 31(19): 5654-5666.
[15] CONSORTIUM T G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature, 2012, 485(7400): 635-641.
[16] ZHANG W Y, ALSEEKH S, ZHU X, ZHANG Q H, FERNIE A R, KUANG H H, WEN W W. Dissection of the domestication-shaped genetic architecture of lettuce primary metabolism. The Plant Journal, 2020, 104(3): 613-630.
[17] YUN D Y, KANG Y G, KIM M, KIM D, KIM E H, HONG Y S. Metabotyping of different soybean genotypes and distinct metabolism in their seeds and leaves. Food Chemistry, 2020, 330: 127198.
[18] MOING A, ALLWOOD J W, AHARONI A, BAKER J, BEALE M H, BEN-DOR S, BIAIS B, BRIGANTE F, BURGER Y, DEBORDE C, ERBAN A, FAIGENBOIM A, GUR A, GOODACRE R, HANSEN T H, JACOB D, KATZIR N, KOPKA J, LEWINSOHN E, MAUCOURT M,. Comparative metabolomics and molecular phylogenetics of melon (Cucurbitaceae) biodiversity. Metabolites, 2020, 10(3): 121.
[19] 崔霞霞, 王亚钦, 任毅, Alisdair R Fernie, Saleh Alseekh, 何洪巨, 宫国义, 张海英, 郭绍贵, 张洁, 许勇. 低糖野生种与高糖栽培种西瓜果实代谢产物组分差异分析. 园艺学报, 2018, 45(4): 775-783.
CUI X X, WANG Y Q, REN Y, FERNIE A, ALSEEKH S, HE H J, GONG G Y, ZHANG H Y, GUO S G, ZHANG J E, XU Y. Variance analysis of metabolite components between low sugar wild and high sugar cultivated watermelon fruits. Acta Horticulturae Sinica, 2018, 45(4): 775-783. (in Chinese)
[20] ASLAM A, ZHAO S J, AZAM M, LU X Q, HE N, LI B B, DOU J L, ZHU H J, LIU W G. Comparative analysis of primary metabolites and transcriptome changes between ungrafted and pumpkin-grafted watermelon during fruit development. PeerJ, 2020, 8: e8259.
[21] SULAIMAN F, AZAM A A, BUSTAMAM M S A, FAKURAZI S, ABAS F, LEE Y X, ISMAIL A A, MOHD FAUDZI S M, ISMAIL I S. Metabolite profiles of red and yellow watermelon () cultivars using a1H-NMR metabolomics approach. Molecules, 2020, 25(14): 3235.
[22] 袁平丽, 李智, 赵胜杰, 路绪强, 何楠, 尚建立, 刘文革. 西瓜种质资源番茄红素含量评价. 江苏农业科学, 2018, 46(7): 115-120.
YUAN P L, LI Z, ZHAO S J, LU X Q, HE N, SHANG J L, LIU W G. Evaluation of lycopene content of watermelon germplasm resources. Jiangsu Agricultural Sciences, 2018, 46(7): 115-120. (in Chinese)
[23] 李蒙蒙, 路绪强, 赵胜杰, 何楠, 尚建立, 刘文革. 西瓜种质资源的瓜氨酸含量分析及评价. 果树学报, 2017, 34(4): 482-494.
LI M M, LU X Q, ZHAO S J, HE N, SHANG J L, LIU W G. Analysis and evaluation of citrulline content in watermelons. Journal of Fruit Science, 2017, 34(4): 482-494. (in Chinese)
[24] 关立颖, 刘文革, 裴孝伯, 赵胜杰, 阎志红, 路绪强. 不同砧木对西瓜果实中糖和Vc含量的影响. 西北农业学报, 2012, 21(1): 136-140.
GUAN L Y, LIU W G, PEI X B, ZHAO S J, YAN Z H, LU X Q. Effect of different rootstocks on the sugar and vitamin C content in watermelon fruit. Acta Agriculturae Boreali-Occidentalis Sinica, 2012, 21(1): 136-140. (in Chinese)
[25] 程瑛琨, 孟庆繁, 陈亚光, 滕利荣. 籽瓜多种营养成分的分析. 食品研究与开发, 2006, 27(7): 169-171.
CHENG Y K, MENG Q F, CHEN Y G, TENG L R. Analysis of nutritional compositions of seed melon. Food Research and Development, 2006, 27(7): 169-171. (in Chinese)
[26] 梁琪, 蒋玉梅, 张盛贵, 毕阳, 郑善强. 甘肃省不同产地籽瓜瓤皮成分分析. 甘肃农业大学学报, 1999, 34(1): 79-83.
LIANG Q, JIANG Y M, ZHANG S G, BI Y, ZHENG S Q. Components of seed-used watermelon fruit in Gansu of China. Journal of Gansu Agricultural University, 1999, 34(1): 79-83. (in Chinese)
[27] 张玉秀, 赵文明. 籽瓜种子蛋白质的氨基酸成分分析. 果树科学, 1992, 9(4): 231-233.
ZHANG Y X, ZHAO W M. Amino acid composition analysis of seed protein of seed melon. Guoshu Kexue, 1992, 9(4): 231-233. (in Chinese)
[28] ZHU G T, WANG S C, HUANG Z J, ZHANG S B, LIAO Q G, ZHANG C Z, LIN T, QIN M, PENG M, YANG C K, CAO X E, HAN X, WANG X X, VAN DER KNAAP E, ZHANG Z H, CUI X, KLEE H, FERNIE A R, LUO J E, HUANG S W. Rewiring of the fruit metabolome in tomato breeding. Cell, 2018, 172(1/2): 249-261.
[29] PECH J C, BOUZAYEN M, LATCHÉ A. Climacteric fruit ripening: Ethylene-dependent and independent regulation of ripening pathways in melon fruit. Plant Science, 2008, 175(1): 114-120.
[30] 张建农. 籽用西瓜种质资源利用和耐贮性生理机理的研究[D]. 兰州: 甘肃农业大学, 2005.
ZHANG J N. Study on germplasm resource exploitage and bear- storage mechanism in edible seed watermelon [D]. Lanzhou: Gansu Agricultural University, 2005. (in Chinese)
[31] LEVI A, THOMAS C E. Low genetic diversity indicates the need to broaden the genetic base of cultivated watermelon. HortScience, 2001, 36(6): 1096-1101.
[32] LUO J. Metabolite-based genome-wide association studies in plants. Current Opinion in Plant Biology, 2015, 24: 31-38.
[33] MCNAIR J B. Angiosperm phylogeny on a chemical basis. Bulletin of the Torrey Botanical Club, 1935, 62(9): 515-532.
[34] WATERMAN P G. The current status of chemical systematics. Phytochemistry, 2007, 68(22/24): 2896-2903.
[35] BERNILLON S, BIAIS B, DEBORDE C, MAUCOURT M, CABASSON C, GIBON Y, HANSEN T H, HUSTED S, DE VOS R C H, MUMM R, JONKER H, WARD J L, MILLER S J, BAKER J M, BURGER J, TADMOR Y, BEALE M H, SCHJOERRING J K, SCHAFFER A A, ROLIN D, HALL R D, MOING A. Metabolomic and elemental profiling of melon fruit quality as affected by genotype and environment. Metabolomics, 2013, 9(1): 57-77.
[36] VAN TREUREN R, VAN EEKELEN H D L M, WEHRENS R, DE VOS R C H. Metabolite variation in the lettuce gene pool: Towards healthier crop varieties and food. Metabolomics, 2018, 14(11): 146.
[37] FANG C Y, FERNIE A R, LUO J. Exploring the diversity of plant metabolism. Trends in Plant Science, 2019, 24(1): 83-98.
[38] WANG S C, ALSEEKH S, FERNIE A R, LUO J. The structure and function of major plant metabolite modifications. Molecular Plant, 2019, 12(7): 899-919.
Metabolomics Comparative Study on Fruits of Edible Seed Watermelon, Egusi and Common Watermelon
YUAN PingLi, HE Nan, ZHAO ShengJie, LU XuQiang, ZHU HongJu,DIAO WeiNan, GONG ChengSheng, Muhammad Jawad Umer, LIU WenGe
Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences/Henan Key Laboratory of Fruit and Cucurbit Biology, Zhengzhou 450009
【】Watermelon is a very popular summer fruit.(egusi),var.(edible seed watermelon) andvar.(common dessert watermelon) are the three main cultivation types. The appearance and taste of their fruits are quite different, but there is no detailed report on the comprehensive fruit metabolome. In order to clarity the influence of selection on metabolomics in watermelon domestication and improvement processes, the metabolic profiling of three types of watermelon fruits was analyzed. 【】 In this study, 5 egusi watermelon, 5 edible seed watermelon and 6 common watermelon accessions were used for metabolomics profiling analysis by widely targeted metabolic profiling method based on liquid chromatography tandem mass spectrometry (LC-MS/MS). The software SIMCA-P, MetaboAnalyst 5.0, and Origin were used to analyze the metabolomics data. 【】A total of 323 metabolites were detected, including 51 amino acids and their derivatives, 21 nucleotides and their derivatives, 14 carbohydrates, 32 organic acids, 52 lipids, 36 flavonoids, 32 hydroxycinnamoyl derivatives, etc. PCA and cluster analysis showed that the difference of metabolomics profile between egusi watermelon and edible seed watermelon was small, and the metabolomics profile of edible seed watermelon was between that of egusi watermelon and common watermelon. The major metabolites contributing to the classification were sucrose, citric acid, L-glutamic acid, L-threonine, cucurbitacin, vanillic acid glycoside isomers, lipids, and so on. Heatmap analysis showed that cucurbitacin and their derivatives were the unique metabolites in egusi watermelon. The contents of chlorogenic acid, LysoPE, etc. in edible seed watermelon were higher than those in egusi and common watermelon. The contents of carbohydrate, arginine, ferulic acid and C18-2 and C18-3 unsaturated fatty acids in common watermelon were higher than those in egusi and edible seed watermelon. There were 156 differentially accumulated metabolites, which were identified by comparison analysis. The main divergent metabolites between edible seed watermelon and egusi watermelon were p-coumaraldehyde, ferulic acid, cinnamic acid, sucrose, cucurbitacin D O-glucoside, cucurbitacin E isomer, vitexin, coniferyl alcohol, and so on. The main divergent metabolites between edible seed watermelon and common watermelon were lipids, flavonoids, organic acids, sugars, and others. With the development of crop evolution, the content of nutritious metabolites increased, whereas the content of resistance related metabolites decreased. 【】The watermelon fruit metabolomics was reported for the first time based on widely targeted metabolic profiling method. The metabolomics difference between edible seed watermelon and egusi watermelon was smaller than that of edible seed watermelon and common watermelon, and the metabolic profile of edible seed watermelon lay between that of egusi watermelon and common watermelon. In addition to phenotypic and genomic differences, the differential metabolites could also be used as biomarkers to distinguish different varieties. The metabolomics data provided the new insight for complementary understanding watermelon germplasm resources and for metabolomics-based genetic improvement of functional watermelon.
;var.;var.; metabolome; divergence metabolites; domestication and improvement

10.3864/j.issn.0578-1752.2021.19.013
2020-12-03;
2021-03-24
国家重点研发计划(2018YFD0100704)、中国农业科学院科技创新工程专项经费项目(CAAS-ASTIP-ZFRI-07)、国家现代农业产业技术体系建设专项(CARS-25-03)、国家自然科学基金(31672178,31471893)、河南省科技攻关项目(202102110197)
袁平丽,E-mail:82101179218@caas.cn,mengping513@163.com。通信作者刘文革,E-mail:liuwenge@caas.cn
(责任编辑 赵伶俐)
