不同品种南瓜内生细菌多样性及PICRUSt基因功能预测分析
2021-10-20黄子粤刘文君覃仁柳庞师婵肖健杨尚东
黄子粤,刘文君,覃仁柳,庞师婵,肖健,杨尚东✉
1广西大学农学院/植物科学国家级实验教学示范中心,南宁 530004;2广西壮族自治区农业科学院蔬菜研究所,南宁 530007
0 引言
【研究意义】南瓜(Cucurbita moschata Duchesne)又称番瓜、金瓜、倭瓜等,为葫芦科一年生蔓性草本植物,是我国重要蔬菜作物之一。南瓜富含多糖、维生素和人体必需氨基酸、β-胡萝卜素、蛋白质、钙、铁、磷微量元素等营养成分,具有良好的营养价值和保健功能[1]。南瓜产品的开发日益受到世界发达国家的重视,已被公认为特效保健食品之一,具有广阔的开发利用前景。我国地域辽阔,南瓜作物资源、类型丰富多样,但南瓜作物的育种研究工作长期以来未能得到相应的重视,缺乏系统深入的研究[2]。目前南瓜育种主要以生物技术为优势手段,如体细胞变异体离体筛选技术、转基因技术、分子标记辅助育种等,但南瓜育种基础研究相对薄弱,已成为当前制约南瓜育种工作快速发展的瓶颈之一。植物内生细菌(endophytic bacteria)是指能在健康植物组织内栖居,但对植物不造成实质性的危害并与植物建立了和谐(compatible association)关系的细菌;其包含一生或一生的某一阶段生活在植物体内的一类细菌[3]。内生菌是植物微生态系统的重要组成部分,在自然界长期的协同进化过程中,内生菌与寄主相互选择,互相影响,形成互惠共生或者寄生的关系,且两种关系在一定条件下可以相互转换。近年来,已有针对同一作物不同品种间的内生细菌多样性与群落结构特征的研究,如古丽尼沙·沙依木等[4]发现不同品种苹果树内生细菌群落多样性较为丰富,种群组成与功能存在较大差异。开展不同品种南瓜内生细菌群落多样性分析,不仅有助于揭示不同品种南瓜内生细菌群落结构特征,而且对挖掘利用有益内生细菌功能菌株,及开拓南瓜辅助育种新方向具有重要意义。【前人研究进展】研究表明,植物内生细菌可与植物结瘤固氮,促进植物合成多种生长激素助于生长,产生抗生素类物质增加植物的抗病性,以及促进植物对多种矿质元素的吸收,对宿主植物具有广泛有益的生物学作用[5-7]。植物内生细菌遗传多样性是由基因型和外部生长环境等多种因素共同决定的[8]。近年来,已有研究表明不同种植物内生细菌群落结构存在很大差异,同一品种植物内生细菌群落结构也有所不同。ZHANG等[9]发现不同基因型水稻种子内的内生细菌群落组成虽然不存在显著差异,但内生细菌的分布有明显差异,特别是优势内生细菌属。LAMIT等[10]研究也显示窄叶杨基因型影响其嫩枝内生真菌丰度以及群落组成。HARDOIM 等[11]的研究表明基因型在很大程度上决定了不同水稻品种内生细菌群落的组成。【本研究切入点】虽然目前不同作物内生细菌多样性与群落结构特征有研究,但缺少针对南瓜茎内生细菌群落结构的研究。【拟解决的关键问题】以不同品种南瓜作为研究对象,分析植株茎部内生细菌多样性及群落结构特征,并进行相关的基因功能预测;探究不同南瓜茎部内生细菌群落结构组成差异及功能,旨在开发和利用南瓜内生细菌资源的同时,为构建南瓜新品种选育评价新体系提供参考。
1 材料与方法
1.1 样品的采集和处理
南瓜育苗时间为2019年8月,9月上旬定植于南宁市广西农业科学院里建科学研究基地(108°02′ E,23°14′N)。2019年12月采集不同品种、无明显病状、生长性状良好的南瓜健康植株(表1)相同节位的茎段样品,每个品种随机采集3株。采集后装于经灭菌处理的密封采样袋中,低温冷冻送至上海美吉生物医药科技有限公司进行PCR扩增并利用Illumina MiSeq测序平台进行测序分析。

表1 不同品种南瓜品质特征Table 1 Quality characters of different pumpkin varieties
1.2 内生细菌多样性分析
内生细菌多样性分析,由上海美吉生物医药科技有限公司基于MiSeq[12]平台进行高通量测序,测序类型与引物序列见表2。

表2 引物名称及序列Table 2 The primer name and sequence
DNA抽提和PCR扩增流程:根据E.Z.N.A.® soil DNA kit(Omega Bio-tek, Norcross, GA, U.S.)说明书进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA 浓度和纯度;使用 799F(5′-AACMGGATTAGAT ACCCKG-3′)对16S rRNA基因V5—V7可变区进行PCR扩增,扩增程序如下:95℃预变性3 min,27个循环(95℃ 变性 30 s,55℃退火 30 s,72℃延伸 30 s),然后72℃稳定延伸10 min,最后在4℃进行保存(PCR仪:ABI GeneAmp® 9700型)。PCR反应体系为:5×TransStart FastPfu 缓冲液 4 μL,2.5mmol·L-1dNTPs 2 μL,上、下游引物(5 μmol·L-1)各 0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,补足至20 μL。每个样本3次重复。
Illumina Miseq测序流程:将同一样本的PCR产物混合后使用 2%琼脂糖凝胶回收 PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City, CA, USA)进行回收和产物纯化,2%琼脂糖凝胶电泳检测,并用 Quantus™ Fluorometer(Promega,USA)对回收产物进行定量检测。使用NEXTFLEX Rapid DNA-Seq Kit进行建库:(1)接头链接;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)磁珠回收PCR产物得到最终文库。利用Illumina公司的Miseq PE250平台进行测序(上海美吉生物医药科技有限公司)。
原始数据上传到NCBI数据库进行比较。本研究选用ACE指数、Chao指数、Simpson指数、Shannon指数表征不同品种南瓜内生细菌丰富度和多样性。其中,ACE指数和Chao指数表示物种的丰富度;Shannon指数和Simpson指数用于估算样本中细菌多样性;不同指数的计算方法和结果均基于上海美吉生物医药科技有限公司的 I-sanger云数据分析平台(www.majorbio.com)进行。
1.3 数据分析与处理
数据采用Excel 2019和IBM SPSS Statistics 21统计软件进行统计分析,并利用上海美吉生物医药科技有限公司提供的数据分析平台 I-Sanger进行多样性在线分析;同时构建物种群落丰度柱状图及OTU水平物种组成Venn图,分析内生细菌门、属分类水平的群落多样性,以及不同品种南瓜茎内生细菌优势菌群占比,同时基于 I-sanger云数据分析平台进行PICRUSt基因功能预测。数据以“平均值±标准差(SD)”表示。
2 结果
2.1 不同品种南瓜内生细菌多样性分析
覆盖率(Coverage)指数越高,则说明样本中序列被测出的概率越高,而没有被测出的概率越低[13]。由表3可知,样品分析覆盖率均达到99%,表明文中分析数据真实可信。5个不同品种南瓜茎部中内生细菌多样性Shannon指数和Simpson指数在不同品种南瓜茎部中均无显著差异;同时,丰富度Chao1和Ace指数在5个不同南瓜品种中也不存在显著差异(表3)。这一结果表明栽植于相同环境条件下,不同品种南瓜茎部内生细菌多样性和丰富度基本一致。由此推测,同一种作物不同品种间,植株内生细菌多样性和丰富度受环境的支配可能大于品种自身的影响。
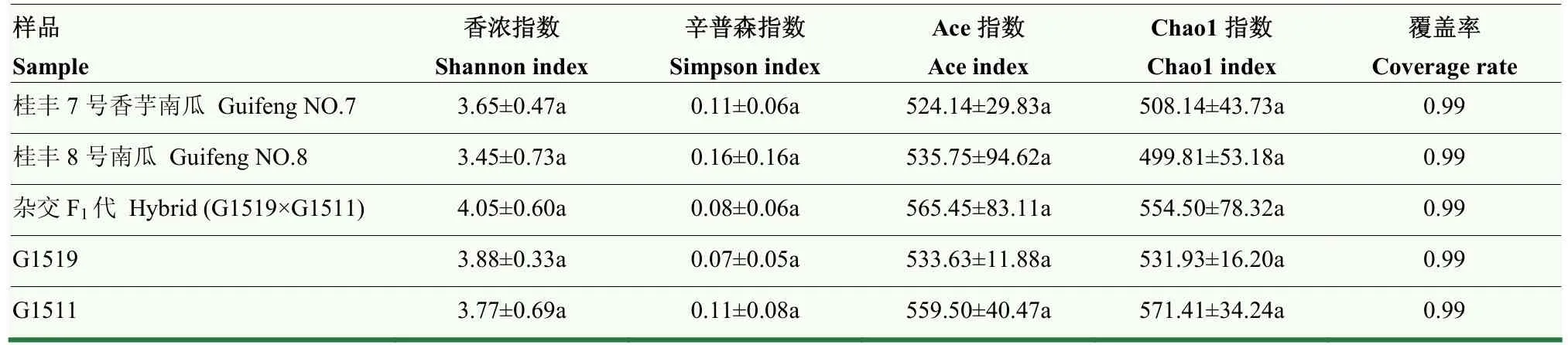
表3 不同品种南瓜茎部内生细菌Alpha多样性指数Table 3 Alpha diversity index of endophytic bacteria in terms of different pumkin varieties
2.2 不同品种南瓜内生细菌群落归类分析
5个不同品种南瓜茎部内生细菌分类水平上,共获得18个门,30个纲,101个目,199个科,362个属,567个种和863个OTU(表4)。本研究中南瓜作物共有的内生细菌OTU数目为369,不同品种南瓜茎部特有的内生细菌OTU数目存在一定差异;其中,‘桂丰 7 号’‘桂丰 8号’、杂交 F1代(G1519×G1511)、G1519、G1511品种茎部特有的内生细菌OTU数目分别为21、21、25、15和22;杂交F1代的属、种及OTU数目均高于父母本(G1519和G1511)(图 1)。由此可知,相同生长环境条件下,不同品种南瓜茎部内生细菌基于不同分类水平均存在数量上的差异。
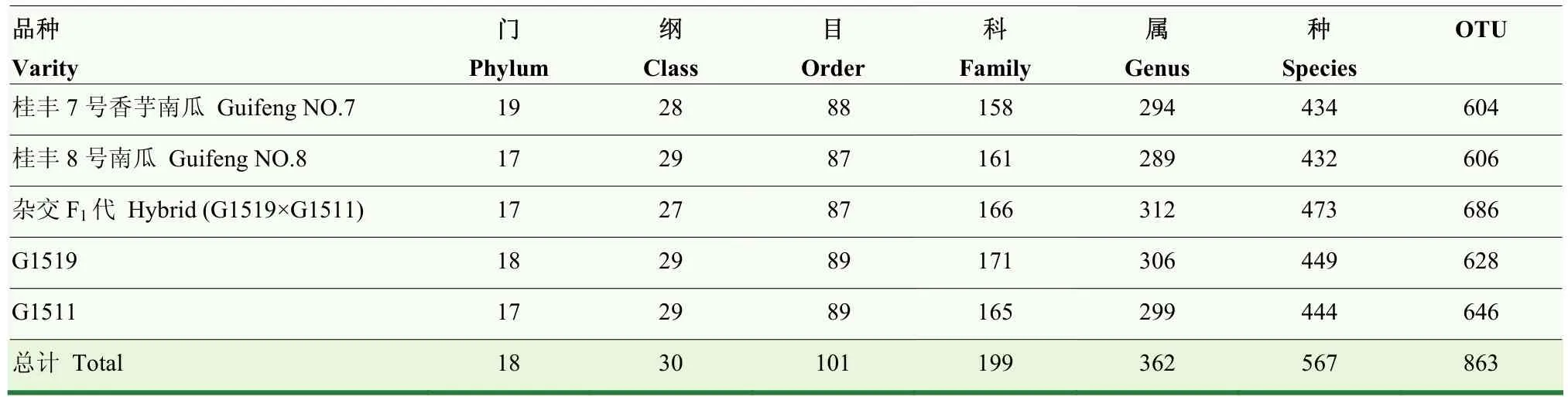
表4 不同品种南瓜茎部内生细菌物种丰富度统计表Table 4 Statistical table of species abundance of different pumpkin varieties
2.3 不同品种南瓜内生细菌群落门分类水平
基于门分类水平发现(图 2),不同品种南瓜茎部内生细菌共有的优势门类数量仅为3个,分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)。其中,变形菌门(Proteobacteria)是5个不同品种南瓜茎部最主要的优势细菌门类,达63.49%—76.55%;其次分别为放线菌门(Actinobacteria,14.55%—32.28%);厚壁菌门(Firmicutes,2.10%—4.51%);拟杆菌门(Bacteroidetes)细菌虽然是‘桂丰 7号’‘桂丰 8号’以及杂交 F1代(G1519×G1511)和G1511品种南瓜的优势菌门,占比分别达1.46%、2.47%、1.64%和1.06%,但在G1519品种中占比低于1%,表明该细菌门类在G1519品种茎部属于非优势的细菌门类;此外,衣原体门(Chlamydiae)细菌仅作为‘桂丰8号’南瓜茎部内生细菌的优势门类,占比2.27%,而在其他4个品种南瓜中占比均低于1%(表5)。

表5 优势细菌门分类水平丰度占比Table 5 Percent of dominant bacterial community on Phylum level
针对父母本(G1519和G1511)与其杂交F1代的门分类水平丰度占比分析,F1的厚壁菌门(Firmicutes)相对G1519(2.81%)和G1511(2.10%)较高,达到了4.51%;拟杆菌门(Bacteroidetes)在G1519中基本无分布,但在G1511和杂交F1代中占比均超过了1%;衣原体门(Chlamydiae)在父母本和F1中均无分布。上述结果表明,不同品种南瓜茎部内生细菌门分类水平结构组成相似,不同门类细菌丰度占比存在明显差异。杂交品种与父母本品种的门分类水平优势内生菌属组成及占比基本相同,可推测不同种类内生菌的聚集与作物品种之间存在关联。
2.4 不同品种南瓜茎部内生细菌属分类水平
属分类水平分析发现(图3),不同品种南瓜茎部内生细菌群落组成占比大于 1%的共有优势细菌属有假单胞菌属(Pseudomonas)、分枝杆菌属(Mycobacterium)、剑菌属(Ensifer)、德沃斯氏菌属(Devosia)、苯基杆菌(Phenylobacterium)、鞘氨醇单胞菌(Sphingomonas)、链霉菌属(Streptomyces)等 13个优势内生细菌属。其中,假单胞菌属(Pseudomonas)是 5个不同品种南瓜茎部内生细菌群落组成中占比最高的菌属,其占比在‘桂丰7号’‘桂丰8号’、杂交F1代、G1519、G1511品种中分别达26.86%、33.02%、19.45%、12.93%和25.88%;其次占比在前5位的共有优势菌属分别为分支杆菌属(Mycobacterium)、Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、剑菌属(Ensifer)、unclassified_f__Rhizobiaceae、德沃斯氏菌属(Devosia)(表6)。

表6 细菌属分类水平结构占比Table 6 Percent of dominant community on Genus level of bacteria
此外,糖霉菌属(Glycomyces)、Candidatus_Rubidus和Actinokineospora细菌仅是‘桂丰7号’南瓜特有的优势菌属;纤发菌属(Methylibium)细菌仅是G1519南瓜的特有优势菌属。同时,就杂交F1属分类水平上的优势菌属进行分析,发现F1的内生细菌优势菌属占比介于父母本(G1519和G1511)优势菌属占比之间;父母本样品中均无分布的菌属如糖霉菌属(Glycomyces)、Candidatus_Rubidus和Actinokineospora在杂交F1代的植株茎部中同样未被检测到。上述结果表明,内生细菌优势菌属组成及丰度随南瓜品种的不同而异,杂交品种内生菌群落结构组成占比与父母本之间无明显差异。‘桂丰7号’香芋南瓜茎部中特有的优势内生菌属数量均高于其余4个南瓜品种;另一方面,‘桂丰7号’南瓜的可溶性固形物和维生素C含量均显著高于其余4个南瓜品种;可溶性蛋白含量虽然与‘桂丰8号’和G1511间无显著差异,但显著高于相应的杂交F1代和G1519(表1)。由此推测,更为多样的优势内生细菌属可能是相同生长环境下,‘桂丰7号’南瓜可溶性固形物和维生素C含量显著高于其他4个品种的重要原因之一;糖霉菌属(Glycomyces)、Candidatus_Rubidus和Actinokineospora属细菌有望作为提高南瓜品质的备选有益功能菌属,以及作为南瓜品质评价的敏感生物学指标。
2.5 PICRUSt功能预测
PICRUSt是基于比对微生物群落的丰富度与数据库,从而在不可观测的情况下推测出生物群落的功能信息[14]。基于高通量测序技术和KEGG(kyoto encyclopedia of genes and genomes)数据库比对,发现5个不同品种南瓜茎部内生细菌在一级功能层共包含6类生物代谢通路(图4),即:代谢、环境信息处理、细胞过程、遗传信息处理、人类疾病和有机系统。其中,代谢通路为5个不同南瓜品种的主要功能组成,占比分别为 67.46%、65.45%、67.43%、66.44%和67.66%(表7)。
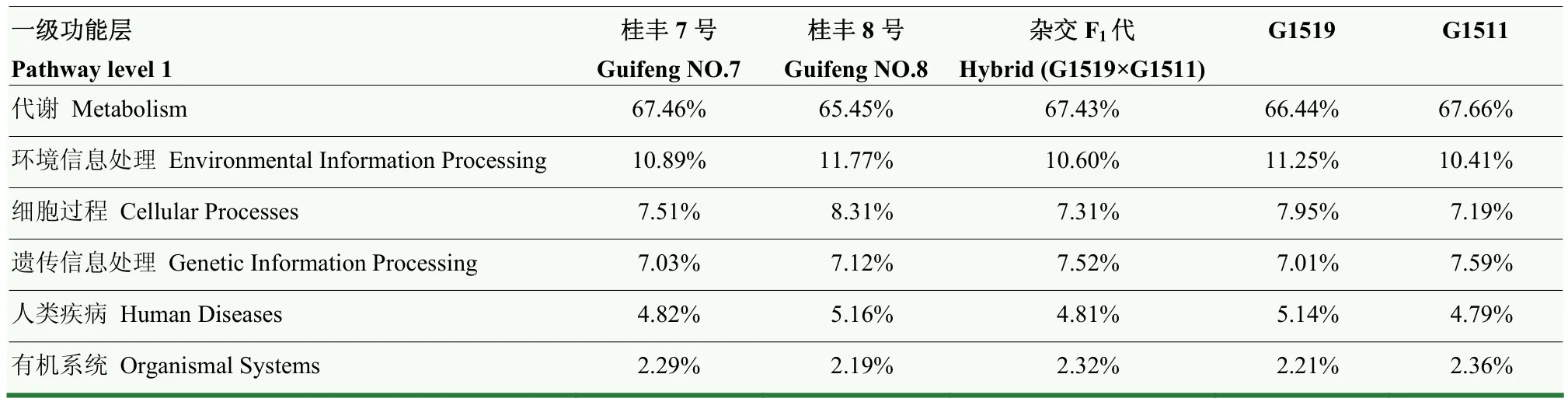
表7 预测功能基因在不同样品间的占比(一级功能层)Table 7 The proportion of predicted functional profiles in different pumpkin samples (Pathway level 1)
同时,针对不同品种南瓜茎部内生细菌基因二级功能层进行预测分析。结果发现,不同品种南瓜茎部内生细菌基因二级功能层主要由发育、感官系统、信号分子和相互作用、细胞群落-真核生物、排泄系统、消化系统等46个子功能组成(图5)。
其中,‘桂丰7号’南瓜的能量代谢、类脂化合物代谢作用、碳水化合物代谢、氨基酸代谢、信号转导、其他氨基酸的代谢、翻译、辅助因子和维生素的代谢等37个二级功能层预测基因拷贝数均为5个品种中最多;细胞运动、循环系统和感染性疾病方面,病毒性的预测基因拷贝数最多的品种为‘桂丰8号’;信号分子和相互作用及发育的预测基因拷贝数最多的品种为杂交 F1代(G1519×G1511);细胞生长和死亡与环境适应的预测基因拷贝数最多的是G1519;消化系统的预测基因拷贝数最多的品种为G1511。
此外,46个子功能组成中,除感官系统、信号分子和相互作用、发育(Development)、感染性疾病:病毒性和细胞群落-真核生物之外,杂交 F1代茎部内生细菌的预测基因拷贝数均最低。由以上结果可知,虽然不同品种南瓜茎部内生细菌基因二级功能层预测基因种类基本无差异,但基因拷贝数却因品种不同而异。‘桂丰7号’南瓜的可溶性固形物、Vc、可溶性蛋白和淀粉含量均表现为5个品种中最高(表1);其茎部内生细菌功能基因的碳水化合物代谢、氨基酸代谢和辅助因子和维生素代谢的基因拷贝数均为5个南瓜品种中表现最高。由此推测,同种作物不同品种间,不同群落组成和丰度的植株内生细菌发挥各自的功能基因影响南瓜植株内部的合成代谢途径,从而形成了不同品种南瓜即使栽植生长于相同的环境条件,也形成其相异品质果实的现象。
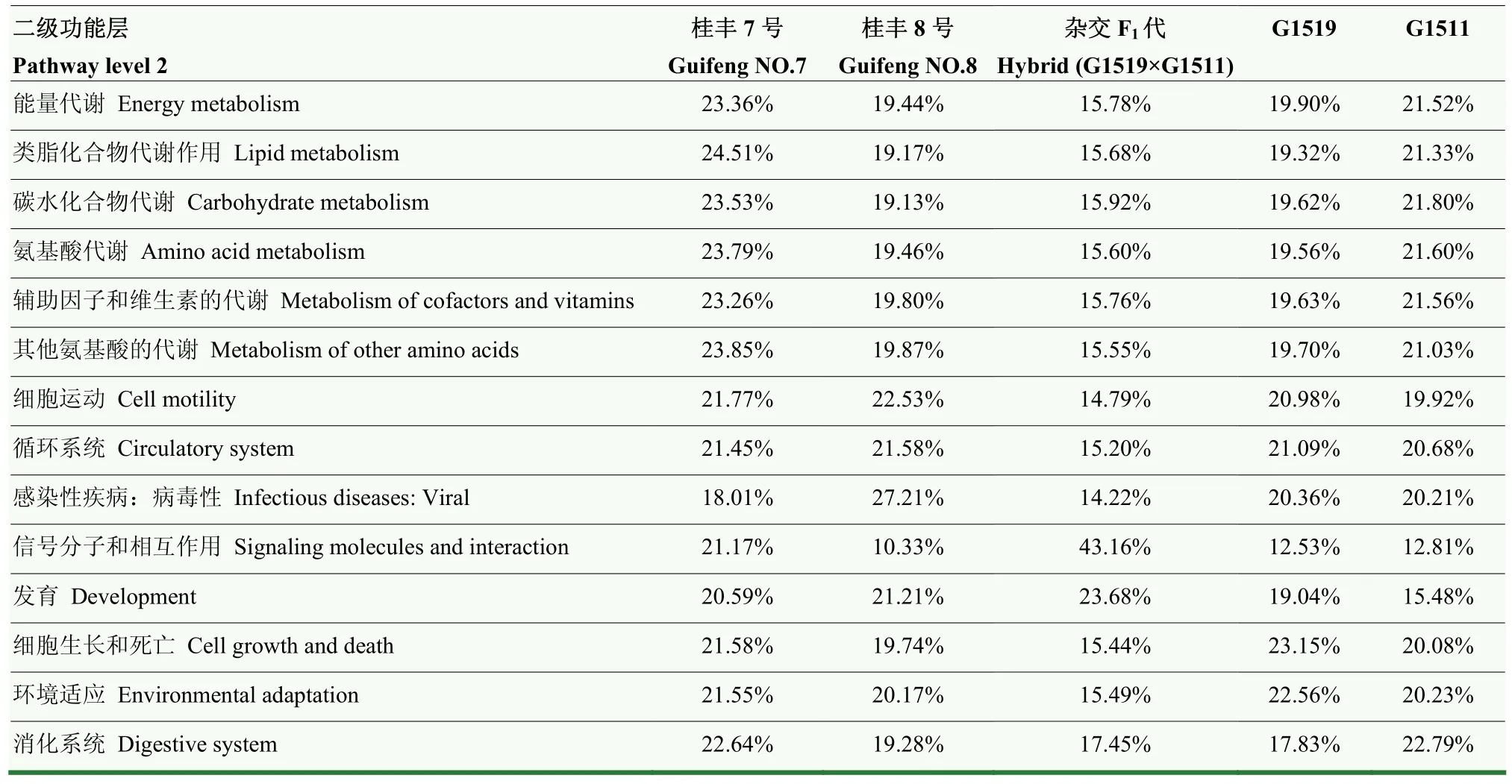
表8 部分预测功能基因在不同样品间的占比(二级功能层)Table 8 The proportion of some predicted functional profiles in different samples (Pathway level 2)
3 讨论
3.1 不同品种南瓜内生细菌丰富度与多样性
植物内生菌广泛存在于植物的各组织和器官中,表现丰富的物种与群落多样性,是植物微生态系统的重要组成部分,对宿主植物的生长和健康均起着重要的作用[15-16]。内生菌的群落多样性不仅取决于宿主植物基因型和内生菌种类,还与地理位置、气候条件、土壤类型、养分胁迫、光温、雨水、空气湿度等环境因素紧密相关[17]。本研究基于高通量测序技术,对 5个不同品种南瓜茎部的内生细菌多样性及群落结构特征进行了分析,发现相同环境条件下栽培的不同品种南瓜茎部内生细菌多样性和丰富度基本一致。高增贵等[18]通过对不同玉米品种在不同生长期内生细菌进行分析后,发现其种类和数量均存在差异;刘洋等[19]研究超级杂交水稻种子内生细菌群落结构及其多样性时,得到水稻种子基因型对其内生细菌的丰度及多样性具有一定影响的结论;刘波等[20]探究不同品种水稻茎部内生细菌群落结构与其品种特性是否存在关联的过程中,观察发现内生细菌含量与穗粒数、结实率、千粒重、理论亩产存在极显著正相关,而与水稻有效穗呈负相关;吴燕燕等[21]调查了 4个不同品种果桑植株内生菌多样性特征后,发现各品种桑树内生细菌多样性特征存在较大差异;马冠华和肖崇光[22]在针对不同品种和不同生长时期的烟草内生细菌类群做了初步分析后,指出不同烟草品种中的内生细菌种群不尽相同,内生细菌种群会随着植株生长发育时期的不同而发生变化。内生细菌菌群密度在不同品种烟草叶片中不尽相同,可能与内生细菌对宿主的选择性有关,烟草内生细菌与烟草共生关系的形成是长期自然选择的结果[23]。以上研究均表明相同栽培条件下,同种作物不同品种间的内生细菌多样性特征随着植株自身基因型呈现差异。本研究结果与上述水稻、烟草和桑树植株内生细菌多样性研究的结果不一致,这一现象可能与作物的科属有关,水稻、烟草和桑树分别属于禾本科、茄科和桑科作物,而南瓜属于葫芦科作物,具体原因有待进一步探讨。另外,本研究发现在相同环境条件下生长的不同品种南瓜茎部内生细菌基于不同分类水平均存在数量上的差异。由此推测,虽然不同品种南瓜茎部内生细菌多样性和丰富度受环境的影响可能大于品种,但内生细菌不同分类水平数量以及特有的细菌OTU数量仍根据品种的不同而异,而且杂交品种相较于父母本更能富集多种内生菌群落。
3.2 不同品种南瓜内生细菌门属水平优势菌群
变形菌门(Proteobacteria)细菌是5个品种南瓜茎部中丰度最高的优势菌门,占比均达60%以上,其次分别是放线菌门和厚壁菌门。变形菌门细菌是植物内生细菌中最为普遍的一个门类,本研究结果与前人的研究结果一致[24-25]。变形菌门细菌包括许多负责固氮的物种,影响植物对疾病的易感性[26]。放线菌是生物活性化合物的常见生产者,天然抗生素的重要来源之一,在植物中广泛存在[27-30]。长期的进化让内生放线菌与植物形成了密切关系。在抵御逆境、抵抗病虫害侵袭与促进宿主植物生长过程中,内生放线菌均发挥着不可替代的作用[31-36]。厚壁菌门细菌也是一类极为重要的微生物资源,在固氮、降解土壤中难溶化合物,并通过抑制病原微生物群,选择植物有益微生物防治植物病虫害等方面均发挥重要的作用[37-40]。微生物类群的丰富度和多样性对维持植物生长健康至关重要。本研究中,南瓜植株茎部内生细菌优势门类与多数作物相似,且与品种无关,证实了内生细菌与宿主作物相互依存与共生的友好关系。
此外,假单胞菌属(Pseudomonas)细菌均是 5个品种南瓜植株中占比最高的优势细菌属。这一结果与前人的研究结果一致[41]。假单胞菌属细菌是一种具有促进磷吸收和植物生长的生防菌[42],在干旱胁迫条件下,一些假单胞菌株可通过产生胞外多糖保护细菌免受水分威胁[43]。SANDHYA等[44]在筛选分离有效的适应胁迫的植物生长促进菌(PGPR)时发现,接种假单胞菌可提高植物脯氨酸、氨基酸和可溶性糖的含量,减轻干旱对植株造成的伤害,从而提高植物的抗性。本研究也发现南瓜果实可溶性固形物含量高的品种,其假单胞菌属内生细菌的丰度占比相对较高。
‘桂丰7号’香芋南瓜除了拥有与其余4个品种南瓜共有的优势内生菌属外,糖霉菌属、Candidatus_Rubidus和Actinokineospora等菌属均为其特有的优势内生细菌属;其中,糖霉菌属细菌分离自土壤或药用植物,绝大部分菌属均分离自普通环境,只有Glycomyces halotolerans分离自极端特殊环境,并且研究表明该属可耐受10%盐浓度[45-47];Actinokineospora在自然界中则是与土壤和植物凋落物密切相关[48]。更为多样的特有优势内生细菌属,可能是‘桂丰7号’香芋南瓜果实中可溶性固形物、Vc以及淀粉含量显著高于其余4个品种南瓜的原因之一。其中,特有优势内生细菌属的促生功能及其与南瓜品质的相关性,有待进一步的证实。
3.3 不同品种南瓜内生细菌基因一、二级功能层预测分析
近年来,基于高通量测序技术分析植物内生细菌的研究主要集中在细菌的多样性和群落结构[49-52]分析上,针对细菌的有益功能研究相对较少。本研究基于MiSeq高通量测序结果进行PICRUSt功能预测分析发现,不同品种南瓜茎部内生细菌基因功能主要涉及代谢、遗传信息处理等6个一级功能代谢通路以及能量代谢、类脂化合物代谢作用、碳水化合物代谢、氨基酸代谢等46个二级功能层。并发现5个品种南瓜中,‘桂丰7号’香芋南瓜茎部内生细菌的碳水化合物代谢、氨基酸代谢、辅助因子和维生素代谢等37个二级功能层预测基因拷贝数最多。众所周知,碳水化合物是植物生长的基本营养物质,并与果实品质的形成密切相关[53-54];维生素C是植物代谢过程不可缺少的产物,参与体内活性氧清除,调控细胞分裂和细胞生长等多种生理过程[55-57];另一方面,氨基酸是蛋白质合成的基础,环境胁迫下植物体内的游离氨基酸代谢可以对植物的抗逆性起到指示作用[58]。本研究发现‘桂丰7号’香芋南瓜茎部内生细菌二级功能层中,碳水化合物代谢、氨基酸代谢、辅助因子和维生素的代谢预测基因拷贝数最多,对应的果实中可溶性固形物、Vc和可溶性蛋白含量也最高。由此推测,不同品种植株中,由于其各异的内生细菌组成与丰度而形成的相异功能基因,影响着植株体内诸如碳水化合物、维生素以及氨基酸等营养物质的代谢途径,从而表现出相同生长环境条件下,不同品种果实品质相异的现象。鉴于PICRUSt功能预测的局限性,诸多内生细菌的基因功能尚不清楚,有待进一步探究。
植株内部微环境共生的内生微生物不仅影响植物营养物质的吸收与循环,还关系着植物的健康与存活。目前研究已发现,不同基因型影响着植株内生微生物区系结构与组成[59-61]。这一现象也表明,随着分析技术的发展和涉及微生物分类及功能数据库的完善,内生微生物群落结构与功能预测有望作为作物育种和开发过程中的一个常规评价指标或缩短作物育种周期的有效技术指标。
4 结论
相同环境条件下,5个不同品种南瓜茎部内生细菌多样性(Shannon和Simpson)和丰富度(Chao1和Ace)指数无显著差异,表明环境条件对南瓜植株内生细菌多样性和丰富度的影响高于品种间的影响;优良的杂交品种具有富集内生细菌的趋势,不同品质南瓜植株具有相异的内生细菌群落结构。不同品种南瓜茎部内生细菌群落组成相似,但丰度占比存在明显差异;杂交品种内生菌群落丰度占比与父本和母本之间均无显著差异;变形菌门、放线菌门和厚壁菌门是 5个品种南瓜共有的优势细菌门类。5个品种南瓜茎部内生细菌基因功能主要涉及代谢、环境信息处理、细胞过程、遗传信息处理、人类疾病和有机系统6个生物一级功能层代谢通路,以及氨基酸代谢、转录、信号分子和相互作用等46个二级功能层代谢通路。假单胞菌属(Pseudomonas)、分枝杆菌属(Mycobacterium)、剑菌属(Ensifer)、德沃斯氏菌属(Devosia)等 13个菌属是5个不同品种南瓜茎部的共有优势内生细菌属;糖霉菌属(Glycomyces)、Candidatus_Rubidus属和Actinokineospora属是高品质南瓜—‘桂丰7号’茎部特有的优势内生细菌属,有望作为提高南瓜品质的备选有益功能菌属,以及品质评价的敏感生物学指标。
