猪卵泡闭锁过程中circINHBB的鉴定及其对颗粒细胞凋亡的影响
2021-10-20马梦楠王慧明王苗苗姚望张金璧潘增祥
马梦楠,王慧明,王苗苗,姚望,张金璧,潘增祥
南京农业大学动物科技学院,南京 210095
0 引言
【研究意义】卵泡的发育和闭锁关乎哺乳动物的繁殖力,进而影响家畜生产性能。而在哺乳动物中,只有极少数卵泡(少于1%)会被选择并最终排卵为成熟卵泡,而其他卵泡则会发生闭锁[1]。卵泡闭锁的主要特征是卵母细胞、颗粒细胞和卵泡膜细胞的凋亡,但卵泡闭锁主要诱因是颗粒细胞的凋亡[2]。在猪卵巢中,细胞凋亡首先发生在壁层颗粒细胞的颗粒层中,而后是卵母细胞和卵丘细胞。在卵泡闭锁过程中,颗粒细胞凋亡增多导致内部容量减少,随着细胞脱落和卵泡腔塌陷,最终使整个卵泡发生退化。近年来,非编码 RNA(ncRNA),尤其是miRNA在卵巢功能中的普遍性和重要功能被逐渐揭开[3-5]。环状RNA(circRNA) 作为一类新发现的内源性 ncRNA,可通过几种不同类型的 RNA剪接方式以共价键形成环状结构,且不具有 5'末端帽子和 3'末端,不易被核酸外切酶识别并剪切,因此具备高度的保守性和稳定性。circRNA广泛分布于真核细胞中,参与多种生理过程[6-7],但其在家畜卵泡中的验证和研究较少。丰富卵泡闭锁过程中circRNA的调控机制的认知,是对家畜繁殖生理的分子调节机理进行补充,会为在实践中提高家畜繁殖力开拓思路和提供有益参考。【前人研究进展】颗粒细胞的凋亡是受到多种细胞因子调控的及其精确和复杂的生理过程,非编码RNA如miRNA已被广泛研究参与颗粒细胞的凋亡[8-9]。有研究表明circRNA作为调节因子参与了卵巢卵泡的发育过程。例如:在女性卵巢衰老过程中存在差异表达的circRNA,其中circRNA-103827和circRNA-104816参与调控卵巢类固醇的生成,从而影响卵泡的发育[10]。在成年和幼年的小鼠卵巢中鉴定了许多差异表达的 circRNA,其中的circEGFR的表达量在成年小鼠卵巢中显著上调,circEGFR是一种与雌激素信号相关的 circRNA,并且circEGFR调控卵泡发育和颗粒细胞的增殖[11];波尔山羊和麻城黑山羊的卵泡中有37个差异表达的circRNA,并且麻城黑山羊的繁殖率比波尔山羊更高,表明circRNA的差异表达可能对卵巢卵泡的发育产生影响从而导致繁殖率的不同[12];在牛中,circRNA与BMP15和GDF9相互作用,调节牛卵丘细胞的状态,从而影响卵泡的生长[13];笔者前期实验通过全基因组circRNA测序证实,猪卵泡中有大量circRNA的表达,且卵泡闭锁过程中的circRNA的表达水平发生了显著变化,表明 circRNA在猪卵泡闭锁过程中具有调控潜力。【本研究切入点】抑制素(Inhibin,INH)是一种性腺糖蛋白激素,由两个α亚基或一个α亚基和一个β亚基组成二聚体,主要由雌性动物卵巢卵泡的颗粒细胞产生。INH可以反馈抑制垂体前叶促卵泡激素FSH的释放,调节卵泡的生成,是控制哺乳动物排卵的重要因子[14]。前期的 circRNA测序发现,INHβ亚基的编码基因INHBB可能通过其前体 mRNA的反向剪切编码一个 circRNA,即circINHBB。但circINHBB的序列结构及其在卵泡闭锁和颗粒细胞中的作用尚待验证和探索。【拟解决的关键问题】本文旨在验证circINHBB的结构和细胞生物学分布,明确其在卵泡闭锁过程中的表达变化,并探索其对颗粒细胞凋亡的调控作用。
1 材料与方法
研究于2018年9月至2019年12月在南京农业大学动物科学类实验教学中心(国家实验教学示范中心)完成。
1.1 样品采集
猪卵巢选自淮安苏食肉品屠宰点180日龄的三元杂交后备母猪,屠宰后10 min内采集表面光滑,卵泡分布均匀,颜色呈淡粉色,无红体与白体的卵巢,置于37℃含双抗(青霉素、链霉素各100 U·mL-1)的生理盐水中,3 h内带回实验室进行后续试验。
1.2 卵泡的分类
用含有青霉素与链霉素的 37℃ 无菌生理盐水清洗卵巢,在培养皿中用手术刀,眼科镊剥离直径约5mm的单个卵泡。依据外观的形态特征,P4/E2比率和颗粒细胞的密度分为健康卵泡与早期闭锁卵泡,依据参考文献[15]改进的具体标准见表1。

表1 健康和早期闭锁猪卵泡的判定指标Table 1 Judgment criteria for porcine healthy and early atresia follicles
1.3 颗粒细胞培养
首先用含有青霉素与链霉素的37°C无菌生理盐水和 37°C的 75%乙醇交替清洗卵巢,然后用 10mL注射器抽取直径为 3—6mm卵泡的卵泡液及颗粒细胞,1 000×g离心5min去除卵泡液;用含有1%双抗的 PBS清洗颗粒细胞两次,1 000×g离心 5min去除PBS后,用完全培养基(含体积分数10%胎牛血清和 1%双抗的 DMEM/F12培养基)重悬细胞,充分吹打至散开并接种于12孔(用于RNA提取和流式细胞实验)或 6孔(用于蛋白提取)板中;放置于细胞培养箱内,37℃,5% CO2培养。36 h后观察颗粒细胞贴壁情况,弃去培养基及未贴壁的颗粒细胞、卵母细胞,用PBS清洗贴壁的颗粒细胞,继续后续试验。
1.4 RNA提取及反转录
猪颗粒细胞转染24h后,用PBS冲洗细胞两次,按照Trizol试剂(Invitrogen公司)说明书提取颗粒细胞RNA(每个孔用量1mL),用紫外比色法测定总RNA的浓度和纯度,用1.4%甲醛变性琼脂糖凝胶电泳检测总RNA的质量。吸光值为1.8—1.97,且18S、28S条带清晰的RNA样品可用于反转录。取1 μg质量合格的总RNA用PrimeScript RT Master Mix(TaKaRa)试剂盒进行cDNA第一链合成,具体步骤按说明书操作。反转录产物cDNA于-20℃保存备用。
1.5 细胞转染
circINHBB-siRNA,即si-circINHBB(sens -e:5'-GGCUCAGGCCCCGGCGGAGTT-3';antisense:5'-CUCCGCCGGGGCCUGAGCCTT-3')及阴性对照 nc-siRNA由吉玛(上海)生物公司合成。正常培养猪颗粒细胞 48h后,用 Lipofectamine 3000(Invitrogen)和 Opti-MEM(Gbico)转染猪颗粒细胞,继续培养。
1.6 引物设计与qRT-PCR反应
定量引物设计:根据 GenBank数据库中收录的INHBB基因mRNA序列和qPCR反应要求,用Primer Premier5.0软件设计反向引物,GAPDH作为内源对照。全部引物由深圳华大生物技术有限公司合成,使用时用ddH2O稀释至工作浓度。引物序列信息和扩增条件见表2。

表2 PCR引物及反应条件Table 2 Primer and PCR reaction conditions
PCR的具体操作方法按照 2×Vazyme LAmp Master Mix试剂盒(南京诺唯赞)说明进行。PCR产物由琼脂糖凝胶电泳和Sanger测序(上海生工生物工程股份有限公司)进行序列验证。
qRT-PCR的详细步骤参见 AceQ qPCR SYBR Green Master Mix试剂盒(南京诺唯赞)说明。GAPDH作为内参。根据 LIVAK等[16]的方法进行数据分析,即处理组的ΔCT=处理组目标基因的CT -处理组内参基因的CT,对照组的ΔCT=对照组目标基因的CT-对照组内参基因的CT;ΔΔCT=处理组的ΔCT -对照组的ΔCT。基因表达的变化倍数表示为 2-ΔΔCT,各基因表达量用均值表示。每个实验组包含6个生物学重复,每个生物学重复进行3次技术重复。
1.7 荧光原位杂交(FISH)
在盖玻片上培养猪颗粒细胞,用 4%多聚甲醛(含DEPC)固定20 min,PBS(PH7.3)振荡3次,最后加入蛋白酶 K(20 µg·mL-1)消化 5 min。随后用CY3标记的circINHBB特异性探针5'-CGCTCC GCCGG-GGCCTGAGCCCCCG-3'(武汉塞维尔生物公司)标记 circINHBB。并用DAPI进行细胞核染色。在Nikon立式荧光显微镜(日本Nikon DS-U3)上采集图像。
1.8 细胞凋亡检测
猪颗粒细胞转染48 h后, 首先用PBS洗涤贴壁的猪颗粒细胞。随后使用 Annexin V-FITC/PI staining试剂盒(南京诺唯赞)对颗粒细胞进行染色。最后运用流式细胞仪(FACSCalibur,美BD)检测。使用FlowJo v7.6软件分析数据。每个试验组包含5个技术重复。
1.9 生物信息学软件及在线分析工具
(1)生物信息学软件
Primer premier 5.0 软件:引物设计;
Chromas 2.0软件:对测序结果进行峰图分析;
DNAMAN V5.22 软件:进行核苷酸、氨基酸序列比对分析;
GraphPad Prism 5 软件:绘制图表并进行数据分析。
clipSearch软件:预测circINHBB结合的miRNA。
(2)在线分析工具
GenBank数据(https://www.ncbi.nlm.nih.gov):获取基因序列;
1.10 统计分析
本实验所有数据分析利用 SPSS 20.0和Prism 5软件进行统计分析。所有实验数据以平均值±标准误(mean±SEM)表示。P<0.05(*)和 0.01(**)分别被认为是差异显著和极显著。
2 结果
2.1 健康卵泡与闭锁卵泡的数据
根据课题组前期建立的研究方法,获得直径 3—5 mm猪中等卵泡。结合形态学和生物化学标准,即外观形态特征、P4/E2比率和卵泡液颗粒细胞密度指标(表 1)区分健康卵泡和早期闭锁卵泡(图1)。依据上述方法选择符合各项判定指标的健康卵泡6个、早期闭锁卵泡6个。样本信息及具体分组见表3。
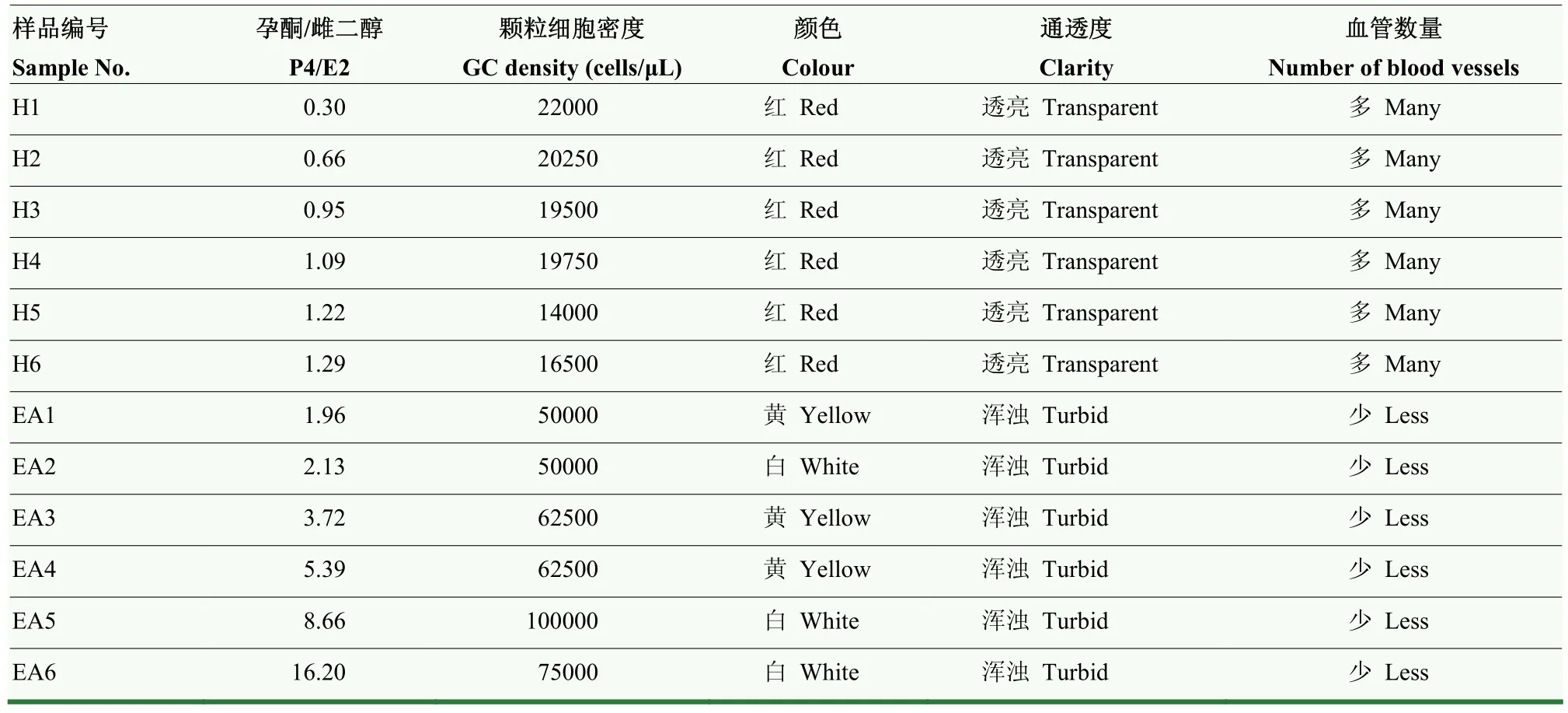
表3 卵泡样本信息Table 3 Sample information of ovary
2.2 circRNA的鉴定
由于circRNA由mRNA前体反向剪切形成,设计引物时以预测的线性RNA剪切位点方向为引物3′端,向线性 RNA两侧方向设计引物,从而扩增包含剪切位点的circRNA序列。circINHBB的正、反向引物设计原理如图2-A所示。circINHBB的PCR产物电泳结果显示出单一条带,表明了circINHBB在卵泡中有表达,且具有特异性(图2-B)。
对PCR产物进行Sanger测序的结果进一步确认了 circINHBB的碱基序列,并明确了 INHBB 线性mRNA前体(5′UTR区域)成环反应的剪切位点(图2-C)。
2.3 circINHBB在猪颗粒细胞中的分布
为了验证circINHBB在猪卵泡颗粒细胞中的分布情况,我们通过FISH方法,用circINHBB探针检测了其在健康颗粒细胞中的表达情况。结果可见circINHBB(红色荧光)主要存在于颗粒细胞质中,且表达量较高,在细胞核中表达量较低(图 3)。由此可见circINHBB可能主要通过转录后机制参与对颗粒细胞的调控。
2.4 circINHBB在猪健康、早期闭锁卵泡的差异表达
对健康和早期闭锁卵泡的 circINHBB进行 qRTPCR检测可见circINHBB在健康卵泡中表达量较高,而在早期闭锁卵泡中表达量显著下降(图 4),可见circINHBB参与了卵泡闭锁过程。
2.5 circINHBB抑制猪颗粒细胞的凋亡
为了探索circINHBB对猪颗粒细胞凋亡的影响,我们首先合成了circINHBB的特异性siRNA,然后将其转染到猪颗粒细胞中。qRT-PCR结果证明si-circINHBB能显著抑制circINHBB的表达水平,敲减效率约为50%(图5-A)。同时INHBB的线性mRNA表达水平不受si-circINHBB的影响(图5-B),可见该siRNA的敲减效果具有特异性。随后,用流式细胞术(FACS)检测si-circINHBB转染前后的颗粒细胞凋亡水平。结果显示,敲减circINHBB后,颗粒细胞凋亡率显著上升,可见circINHBB对颗粒细胞凋亡有显著的抑制作用(图5-C)。
2.6 circINHBB互作的miRNA
circINHBB存在于猪卵泡颗粒细胞的细胞质中,提示其可能作为 miRNA的分子海绵调控猪卵泡的发育。为进一步探索circINHB可能参与调节的miRNA,我们利用生物学信息工具预测 circINHBB互作的miRNA,结果表明,circINHBB可能与10个miRNA相互作用(表4)。

表4 circINHBB互作的miRNATable 4 circINHBB interacting miRNA
3 讨论
近年来,circRNA参与的分子调控成为了ncRNA调控研究的新热点。circRNA对核酸外切酶具有抗性,因此在哺乳动物细胞中半衰期较长。circRNAs的普遍性、保守性、组织/细胞特异性和稳定性使其成为了比miRNA更理想的生物标志物候选者[17]。研究表明在人类血液、唾液和胃液中也检测到了circRNAs,这进一步提高了 circRNAs作为有效诊断和预后生物标志物的潜力[18]。目前,在人卵巢颗粒细胞[19]、胎盘[20]和睾丸[21]中的circRNA表达谱已有研究,并得出了circRNA与这些生殖相关组织的病理特征密切相关的结论。笔者前期在猪中等有腔卵泡中的circRNA表达谱研究[22]是家畜繁殖学领域中对circRNA的首次探索。本研究验证了circINHBB在猪卵泡颗粒细胞中的表达,并发现其与卵泡闭锁过程息息相关。卵泡中的circINHBB的鉴定可能为畜牧业分子育种和生殖医学提供新的circRNA生物标记物。最近,越来越多的证据表明,circRNA可能通过多作为竞争性内源性RNA(ceRNA),通过高效结合某个 miRNA[23]或作为 miRNAs海绵[24]特异性吸附多个 miRNAs,从转录后水平调节基因的表达。笔者研究发现circINHBB主要在颗粒细胞质中表达。表明circINHBB可能是通过作为miRNAs分子海绵发挥生物学功能。
在生殖领域,miRNA在颗粒细胞凋亡、卵泡闭锁过程中的参与已经在人、小鼠、猪和牛身上得到了很好的研究和广泛证实[18]。笔者通过生物信息工具的预测分析发现,circINHBB可能与10个miRNA相互作用。研究表明,miR-342是Notch信号通路的下游分子,miR-342可以调控 TGF-β信号通路[25]并且 miR-342抑制PIK3R1的表达从而激活Akt信号通路[26];miR-432通过抑制IGF的表达抑制Akt信号通路从而抑制细胞的增殖[27];miR-122可以通过直接靶向TGFBR2抑制TGF-β/ Smad信号通路[28]。大量的研究表明TGF-β信号通路调控猪卵泡的发育和颗粒细胞的凋亡[29-31];Notch信号通路调控卵泡的生长,卵母细胞的减数分裂,卵巢的血管生成和类固醇激素的生成[32];在猪卵泡颗粒细胞中,抑制Notch信号通路时,将促进NPC1和StAR的表达从而刺激孕激素分泌[33];此外,研究证实IGF通过PI3K/ Akt信号通路促进猪颗粒细胞的增殖[34]。综上,circINHBB可能通过竞争结合miR-342、miR-432和miR-122从而调控卵泡的闭锁(图6)。
值得注意的是,INHBB作为circINHBB的编码基因,同时也编码INHB的β亚基,而INH是重要的FSH的负调节因子。据报道,抑制素活性的降低可能导致FSH水平升高,随后每个周期招募的卵泡数量过多,最终导致卵泡池提前耗尽,造成卵巢早衰(POF)[14]。circINHBB的剪接可能通过与线性INHBB mRNA的竞争,抑制INHBB的剪接和翻译,从而促进FSH的调节作用,促进颗粒细胞增殖以及卵泡的生长和发育(图6)。
4 结论
笔者在猪卵泡中鉴定了一个新的,由 INHBB基因编码的 circRNA,即 circINHBB。它在卵泡颗粒细胞质中表达,在猪卵泡闭锁过程中显著下调,并具有抑制颗粒细胞凋亡的功能。circINHBB的作用机制可能通过作为miRNA的分子海绵,通过TGF-β、Notch等信号通路参与调控颗粒细胞凋亡及卵泡闭锁过程。本研究为进一步完善circRNA对卵泡闭锁、颗粒细胞凋亡的影响及调控机理提供了参考。
