高加索三叶草响应不同降温模式低温胁迫的代谢组学分析
2021-10-19卡着才让祁学忠顾智辉谢久祥李希来
牟 丹, 杨 帆, 卡着才让, 祁学忠, 顾智辉, 谢久祥*, 李希来*
(1.青海大学农牧学院, 青海 西宁 810016; 2. 河南蒙古族自治县自然资源局林业站, 青海 黄南 811599)
高加索三叶草(TrifoliumambiguumBieb.),又称库拉三叶草(Kura clover),是一种生长相对低矮、具有多分枝深根的根茎型多年生草本植物[1],也是豆科三叶草属中唯一具有地下根蘖和利用根蘖进行强克隆性生长的多年生长寿命草种[2]。该草具有广泛的生态位,从近海平面至高海拔地区均可生长[3];还具有很强的抗寒、耐水淹、抗旱和耐牧等特性[4]。据报道,高加索三叶草能在海拔3 500~3 700 m的青海省河南蒙古自治县(河南县)3处试验地形成克隆植株,并自然越冬[5-6]。河南县地处青藏高原东部,高原大陆性气候较明显,表现为气候严寒,昼夜温差大,无霜期短,极端低温、倒春寒等灾害天气时有发生[7-8]。高加索三叶草在河南县的成功越冬说明其能够适应该地区的低温天气。
植物面临低温胁迫时,可通过合成并积累渗透调节物质来降低细胞冰点温度,增强细胞保水力,缓和细胞低温结晶,从而避免脱水伤害[9]。氨基酸及其衍生物是参与植物渗透调节的重要有机物质之一,在植物遭受低温和水分等逆境时会大量积累[10]。低温胁迫下,植物体内活性氧(Reactive oxygen species,ROS)含量迅速上升,积累的自由基与细胞膜相互作用,从而对植物生长发育造成危害[11]。为清除体内ROS并维持其平衡,植物主要依靠酶类和非酶类两种抗氧化防御系统,其中非酶类抗氧化防御系统主要包括抗坏血酸、类黄酮和酚类等物质[12]。类黄酮化合物是植物体内的一类次生代谢产物,可作为强抗氧化剂、自由基清除剂和脂质过氧化抑制剂等,在植物响应多种逆境方面起着重要作用[13]。
代谢组学被称为新的“组学”之一,是继基因组学、转录组学和蛋白组学后又一门用于研究系统生物学的科学[14],被认为是植物基因组和表型之间的桥梁,已广泛应用于植物响应低温胁迫的研究[8]。目前,关于高加索三叶草响应低温胁迫的代谢组学研究却鲜见报道。本课题组于2015 年将高加索三叶草从新西兰引种到河南县,发现该植物的绿期较长,于当年11月初枯黄,在10月处于正常生长状态,并于次年5月返青。据前期气象观测,河南县春秋季节昼夜温差大,且时有零下低温发生(2015年至2018年间的5月和10月极端低温分别达-6℃和-13℃,极端高温分别为19℃和18℃),这无疑会对正处于返青或正常生长的高加索三叶草造成一定的低温伤害。植物面临低温胁迫时,会通过产生一些代谢物并调节其含量来抵御低温[15]。为此,本研究对高加索三叶草进行以超高效液相色谱-串联质谱(Ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)联用的广泛靶向代谢组学技术检测,比较分析不同降温模式低温胁迫处理与常温处理间高加索三叶草叶片代谢物的变化,筛选响应低温胁迫的关键代谢物,以期探讨高加索三叶草响应低温胁迫的代谢机制,为耐寒植物新品种培育提供理论参考。
1 材料与方法
1.1 试验材料
供试材料为高加索三叶草的育成品种‘蒙农三叶草1号’(TrifoliumambiguumBied‘Mengnong clover No.1’),种子由内蒙古农业大学王明玖教授提供。
1.2 试验设计
试验于2019年5—8月在青海大学校内牧草试验地和草业科学系实验室进行。将种子播种到含混合基质的花盆中。60 d后将长势一致的幼苗转移到低温人工气候箱(光照12 h、昼夜温度20℃/18℃、光照强度12 000 lx、湿度60%)适应性培养30 d。试验分3组:常温对照组(CK)、缓慢降温组(Gradual cooling,GC)和骤然降温组(Sudden cooling,SC),每组均为3个重复。试验具体处理及采样过程同牟丹等[7]研究中的处理及采样过程。采样完成后,将剪取的叶片立即置于液氮速冻并放入-80℃超低温冰箱中保存备用。
1.3 代谢物提取与检测
取出-80℃超低温冰箱中冷冻保存的高加索三叶草叶片,对其进行真空冷冻干燥,然后利用研磨仪研磨(30 Hz)1.5 min,称取100 mg的粉末,利用含0.1 mg·L-1利多卡因作为内标的70%甲醇1.0 mL于4℃提取过夜。提取后,10 000 g离心10 min,吸取上清,用微孔滤膜(孔径0.22 μm)过滤样品,将过滤液保存在进样瓶中用后续分析。同时,由样本提取物混合制备质控样本(Quality control,QC),用于样本重复性分析。
数据采集仪器系统主要包括超高效液相色谱(Ultra performance liquid chromatography,UPLC)和串联质谱(Tandem mass spectrometry,MS/MS)。UPLC分析条件主要包括:色谱柱:C18柱(1.8 μm×2.1 mm×100 mm);流动相:水相为超纯水(加入0.04%的乙酸),有机相为乙腈(加入0.04%的乙酸);洗脱梯度:0 min(水/乙腈95∶5 V/V),11.0 min(水/乙腈5∶95 V/V),12.0 min(水/乙腈5:95 V/V),12.1 min(水/乙腈95∶5 V/V),15.0 min(水/乙腈95∶5 V/V);流速:0.4 mL·min-1;柱温:40℃;进样:2 μL。
1.4 数据统计分析
代谢产物分析采用多元统计分析,包括主成分分析法(Principal component analysis,PCA)和正交偏最小二乘判别分析法(Orthogonal partial least squares discriminant analysis,OPLS-DA);差异代谢物(Differential metabolites,DMs)的筛选利用OPLS-DA和单变量统计分析T检验相结合的方法。
2 结果与分析
2.1 UPLC-MS/MS鉴定结果
通过UPLC-MS/MS技术平台对常温对照组和低温胁迫组样品进行分析,共检测到894个代谢物。这些代谢物主要属于有机酸及其衍生物(柠檬酸、草酸和苹果酸等)、黄酮(木犀草素、芹菜素和芸香柚皮苷等)和氨基酸衍生物(亮氨酸、组氨酸、天冬氨酸和谷氨酸等)等23个类型。
2.2 UPLC-MS/MS数据多元统计分析
由图1的PCA得分图可以看出,GC组与CK组间的模型累计解释率为 77.3,SC组与CK组间的模型累计解释率79.7,说明各组样本间的总体代谢差异较明显。图2所示,GC组与CK组间的模型主要质量参数为R2X=0.783,R2Y=0.999,Q2=0.99,SC组与CK组间的模型主要质量参数为R2X=0.842,R2Y=1,Q2=0.994,表明该模型可靠,能很好地拟合不同处理之间代谢物的差异情况。

图1 不同降温模式低温胁迫下代谢物的PCA得分图
2.3 差异代谢物的筛选
本研究依据OPLS-DA模型参数VIP得分值(VIP ≥ 1)及T检验的P值(P< 0.05)筛选不同降温模式低温胁迫处理与常温处理间(即GC-vs-CK和SC-vs-CK)的差异代谢物(Differential metabolites,DMs),且当某一代谢物含量的差异倍数(即处理组含量与对照组含量的比值)大于1时认为该代谢物上调,小于1时认为该代谢物下调。与CK相比,在GC组中筛选出124个DMs(49个上调,75个下调),在SC组中筛选出139个DMs(64个上调,75个下调)。GC和SC处理组的DMs均属于氨基酸及衍生物和有机酸及衍生物等19个类型(表1)。此外,通过韦恩分析直观展示了GC和SC这 2个处理组中共有或特有的DMs。由图3所示,2个处理组共同拥有103个DMs;GC组特有21个DMs,SC组特有36个DMs。
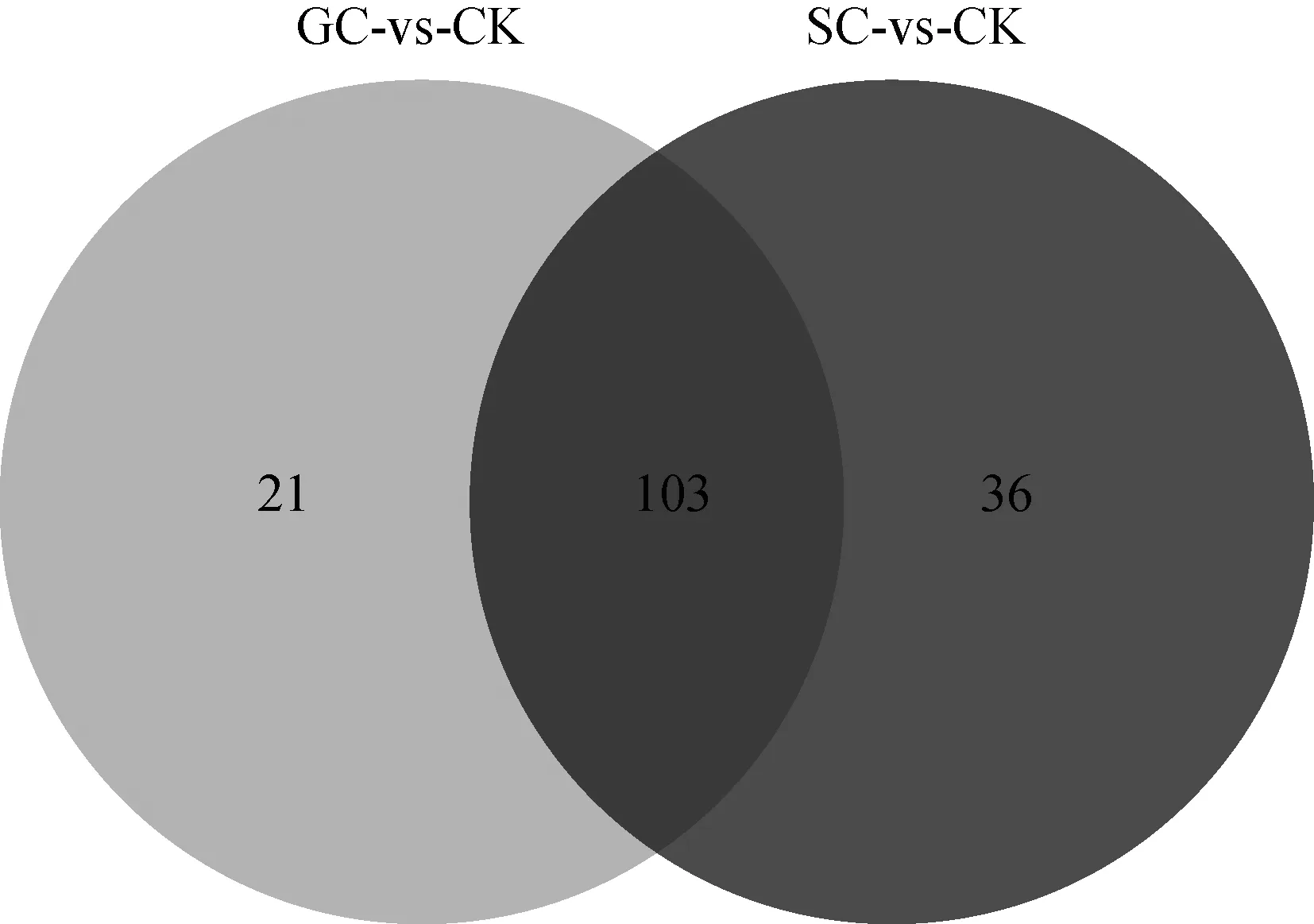
图3 不同降温模式低温胁迫下DMs的韦恩图
2.4 DMs的富集分析
为了解不同降温模式低温胁迫下高加索三叶草叶片中代谢物质的总体代谢途径,分别对GC和SC这2个处理组的DMs进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路注释,即将各个DMs对应的KEGG编号映射到KEGG网站中。由KEGG通路注释总览表可看出(表2),2个处理组的DMs均主要富集在氨基酸代谢和次生代谢产物生物合成2个类别中。此外,为筛选不同降温模式低温胁迫下显著性差异变化的代谢通路,对2个处理组的DMs进行了通路富集分析。如图4的富集分析结果所示,GC和SC处理组的DMs均在ABC转运蛋白、丁酸代谢、组氨酸代谢、烟酸和烟酰胺代谢和氨酰tRNA生物合成5通路显著富集(P<0.05);而SC组的DMs还在β-丙氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢和甘油酯代谢通路中显著富集(P<0.05)。

表2 不同降温模式低温胁迫下DMs的KEGG通路注释
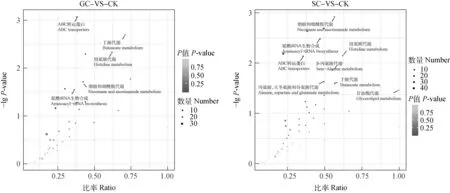
图4 不同降温模式低温胁迫处理下DMs的代谢通路富集图
2.5 响应低温胁迫的关键代谢物分析
为了比较分析响应低温胁迫的关键代谢物变化情况,本研究对GC和SC这2个处理组的DMs结合通路富集情况进行整理,绘制了简化代谢图(图5)。该图涉及多条重要的代谢途径,例如淀粉和蔗糖代谢、三羧酸循环(Tricarboxylic acid cycle,TCA)、丙氨酸,天冬氨酸和谷氨酸代谢、精氨酸和脯氨酸代谢、苯丙烷生物合成和类黄酮生物合成等代谢通路。图5直观地反映了不同降温模式低温胁迫处理与常温处理间的代谢物变化情况,从整体上可看出低温胁迫对氨基酸代谢和类黄酮生物合成过程中的代谢物种类和含量影响较大,对TCA循环和糖代谢过程中的代谢物种类和含量影响较小(因各代谢物含量的值较大,图中不方便展示,故本文用差异倍数进行展示)。氨基酸代谢过程中,与CK相比,在GC和SC这2个处理组中,亮氨酸、赖氨酸和4-氨基丁酸(别名:γ-氨基丁酸,Gamma-aminobutyric acid,GABA)的含量均极显著增加(P<0.01),天冬氨酸的含量均显著增加(P<0.05),谷氨酸和脯氨酸的含量均极显著下降(P<0.01);而酪氨酸的含量仅在SC组显著增加(P<0.05)。类黄酮生物合成过程中,与CK相比,在GC和SC这2个处理组中,矢车菊素的含量均显著上调(P<0.05);木犀草素的含量也均上调,且上调的差异倍数均最大,分别达到598 518.52和291 851.85;而紫铆因的含量仅在GC组显著上调(P<0.05),新橙皮苷的含量仅在SC组显著上调(P<0.05)。TCA循环过程中,与CK相比,在GC和SC这2个处理组中,仅有柠檬酸的含量均极显著上调(P<0.01)。糖代谢过程中,与CK相比,在GC和SC这2个处理组中,尿苷二磷酸葡萄糖(UDP-葡萄糖)的含量均增加,而蔗糖的含量均极显著降低(P<0.01)。

图5 不同降温模式低温胁迫处理下的DMs变化情况
3 讨论
低温胁迫可导致植物形态和生理生化等方面改变,如渗透保护剂积累、抗氧化剂合成、代谢途径改变等[16]。本研究通过对不同降温模式低温胁迫处理与常温处理的高加索三叶草叶片代谢物进行比较,发现GC和SC这2个处理组的代谢物含量相较CK均有显著变化。进一步筛选,在2个处理组中均得到大量的DMs,这些DMs均主要属于氨基酸及衍生物和有机酸及衍生物等类型。GC组的DMs数量较SC组少,说明高加索三叶草响应骤然降温的代谢组变化可能更强烈,可通过产生更多种类的代谢物来抵御突然的零下低温。从总体代谢途径看,GC和SC处理组的DMs均主要富集在氨基酸代谢和次生代谢产物的生物合成中,说明这2个代谢类别在高加索三叶草面临不同降温模式低温胁迫时均具有重要作用。
氨基酸是植物体内一种重要的渗透调节物质,能直接或是间接对环境中的压力(温度、水分、盐碱等)做出响应[17-18],其含量常在低温胁迫下增加[19]。本研究中,GC和SC处理组的GABA、亮氨酸、组氨酸和赖氨酸等氨基酸及衍生物的含量在低温胁迫后均显著增加,推测积累这些氨基酸是高加索三叶草在低温胁迫下维持渗透平衡的一种策略。GABA作为一种非蛋白氨基酸,在应激反应中扮演的角色与脯氨酸类似,可通过增强抗氧化酶活性和减少活性氧积累来减轻逆境对植物的伤害[20]。本研究中,GABA含量在常温处理下几乎为零,而在不同降温模式低温胁迫下却大量增加,这和Mazzucotelli等[21]的研究结果类似,说明高加索三叶草可能通过合成大量的GABA来减轻低温胁迫造成的伤害。亮氨酸属于支链氨基酸(Branched chain amino acids,BCAAs),而BCAAs在包括冷胁迫在内的非生物胁迫条件下普遍积累,且可作为保护性渗透剂[22-23]。本研究发现GC和SC这2个处理组中的亮氨酸含量均显著上调,上调倍数分别是26.05和43.17,可看出该物质对维持低温胁迫下高加索三叶草叶片的渗透平衡起着重要作用。组氨酸、赖氨酸和半胱氨酸等氨基酸被认为是抗氧化氨基酸[24],因易于与-OH或-SH发生反应而实现抗氧化能力[25]。因此,推测低温胁迫后显著增加的组氨酸和赖氨酸在高加索三叶草抗氧化过程发挥了一定的作用。
另一方面,本研究还发现部分氨基酸及衍生物的含量在不同降温模式的低温胁迫下均有所降低,其中谷氨酸含量在GC和SC处理组中均显著降低,这与赵春旭等人[8]的研究结果类似。谷氨酸参与多种与植物抗逆相关的非蛋白氨基酸(如GABA)或蛋白氨基酸(如脯氨酸和精氨酸)的合成,可被谷氨酸脱羧酶直接转化为GABA,还可被谷氨酸脱氢酶脱氨生成α-酮戊二酸进入TCA循环[26]。因此,结合本研究中GABA含量在2个处理组均大量增加的结果,说明高加索三叶草叶片中谷氨酸可能被转化为了GABA,也可能被转化为α-酮戊二酸参与到和抗逆相关的TCA循环之中[27]。脯氨酸作为渗透调节物质、保护蛋白质分子和活性氧清除剂等在植物抗寒方面扮演着多种角色,并在植物面临低温胁迫时表现为普遍积累[28]。然而,本研究中不同降温模式的低温胁迫均使高加索三叶草叶片脯氨酸含量降低,推测随着低温胁迫时间的延长,高加索三叶草某些组织或器官因受伤害无法产生更多的脯氨酸,也可能因为上游合成脯氨酸的前体物质谷氨酸含量减少使其积累速率小于分解速率,最终导致含量降低。贾向荣[29]发现黄精(Polygonatum.sibiricumRed.)叶片脯氨酸含量在低温胁迫4 h内呈下降趋势,并在胁迫4 h时含量降到最低值,这与本研究结果相似。酪氨酸是合成多酚类化合物的芳香族氨基酸之一[30],而多酚类化合物具有良好抗氧化能力,可通过消除自由基活性来保护组织免受氧化损害[31]。本研究发现酪氨酸的含量仅在SC组显著增加,说明高加索三叶草面临骤然降温时,可能通过合成更多的酪氨酸来促进多酚类化合物的合成,从而清除体内多余的自由基,进一步减少骤然降温对其的伤害。
有机酸(特别是TCA循环中的有机酸)含量可反映植株的生长和代谢活性[32]。TCA循环是连接糖代谢和氨基酸代谢的重要枢纽,能为植物提供能量,在植物遭遇逆境时起着重要作用[33]。本研究中,作为TCA循环中间产物之一的柠檬酸,其含量在GC和SC这2个处理组中均显著增加,分别是CK的6.11倍和10.79倍。由此说明,低温胁迫下,高加索三叶草体内TCA循环可能被增强,进而产生更多的能量以补充抵御低温期间的能量消耗,同时验证了前文谷氨酸含量降低的情况。此结果与低温胁迫下梭梭(Haloxylonammodendron)幼苗的代谢响应情况较为相似[34]。
类黄酮化合物是植物中一类重要的次生代谢产物,具备抗氧化、清除自由基的活性,低温环境更有利于其合成与积累[35-36]。本研究发现高加索三叶草经不同降温模式低温胁迫处理后,叶片中多种类黄酮化合物的含量显著增加。其中,GC和SC处理组中的矢车菊素和木犀草素2种类黄酮化合物的含量均显著高于CK,推测高加索三叶草可通过积累矢车菊素来提高抗氧化能力从而增强其抗寒力,还可通过积累木犀草素来清除体内过多的自由基,进而提高低温胁迫下的抗氧化能力,这分别与齐睿[37]对四季秋海棠(Begoniasimperflorens)和Kim等[38]对宽叶胡枝子(Lespedezamaximowiczii)的研究结果类似。据报道,同属类黄酮的紫铆因和新橙皮苷也具抗氧化作用[39-41]。本研究中,紫铆因含量仅在GC组显著增加,而新橙皮苷含量仅在SC组显著增加,说明高加索三叶草在面临不同降温模式的低温胁迫时,可能采用不同的抗低温策略,即紫铆因可能在缓慢降温中起重要作用,而新橙皮苷可能在骤然降温中起重要作用。
4 结论
本研究通过超高效液相色谱-串联质谱联用的广泛靶向代谢组学技术在高加索三叶草叶片中共检测出894种代谢物,并发现缓慢降温和骤然降温2处理组中的部分代谢物含量均与常温对照组存在显著差异(P<0.05)。差异代谢物均主要富集在氨基酸代谢和次生代谢物生物合成类别;紫铆因的含量仅在缓慢降温组中显著增加(P<0.05),酪氨酸和新橙皮苷的含量仅在骤然降温组中显著增加(P<0.05);GABA、亮氨酸、组氨酸、赖氨酸、柠檬酸、矢车菊素和木犀草素的含量在缓慢降温和骤然降温2处理组中均显著增加(P<0.05),这些代谢物可作为高加索三叶草响应低温胁迫的关键代谢物。
