鲁斯可皂苷元对脑缺血再灌注损伤小鼠时钟基因的调控作用
2021-10-19张三利盛明月寇俊萍陈刚领
张三利,盛明月,吴 琪,陈 逊,俞 妍,寇俊萍,陈刚领
(中国药科大学中药学院,江苏 南京 211198)
卒中已成为继癌症和心血管疾病之后的全球第三大疾病,严重威胁公众健康,其中缺血性卒中占比>80%[1-2]。在哺乳动物中,昼夜节律是生物适应温度和光照等环境因素规律变化而演化的内在自主计时机制。研究表明,多种心脑血管疾病包括缺血性卒中的发病率均具有昼夜节律特征[3-4]。
时钟基因的蛋白产物在多种疾病的病理生理过程中发挥着重要作用。有研究表明,在神经退行性疾病中,Bmal1的蛋白产物可通过生存激酶(survival kinase)发挥对昼夜节律发挥调节和维持作用,且Bmal1的表达与神经元存活呈正相关[5]。此外有研究表明,在牙龈卟啉单胞菌诱导动脉粥样硬化的发病进程中,Toll样受体(Toll-like receptors,TLR)/NF-κB信号通路被激活,抑制了时钟基因Bmal1转录,进而增强人主动脉内皮细胞的氧化应激和炎症反应,从而加剧疾病的进展[6]。鲁斯可皂苷元(ruscogenin,Rus)又称为假叶树苷元,属甾体皂苷元,由中药麦冬中提取获得。研究发现,Rus具有显著的抗炎抗血栓活性[7-8]。此外,Rus可通过抑制NF-κB和硫氧还蛋白结合蛋白(thioredoxin-interacting protein,TXNIP)/核苷酸结合寡聚化结构域样受体蛋白 3(NLR family pyrin domain containing 3,NLRP3)介导的脑部炎症反应,减轻小鼠脑缺血再灌注(ischemia/reperfusion,I/R)损伤[9-10]。但是Rus与时钟基因的关系尚未见报道。本研究采用大脑中动脉线栓法制备小鼠I/R模型,评价Rus对I/R小鼠脑I/R损伤的改善作用,同时考察Rus对模型小鼠大脑皮质时钟基因表达的影响,以期探讨减轻脑I/R损伤与调控脑皮质时钟基因表达的相关性,为进一步阐释脑I/R损伤的昼夜节律特征提供实验依据。
1 材料与方法
1.1 药物、试剂和主要仪器
Rus(纯度≥98%,成都普思生物科技有限公司)。2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride solution,TTC)(美国Sigma公司);兔抗小鼠Per1,Bmal1和Clock多克隆抗体(武汉爱博泰克公司);兔抗小鼠GAPDH多克隆抗体和山羊抗兔IgG抗体(美国Birworld公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);组织总RNA提取试剂盒(天根生化科技有限公司);逆转录试剂盒和实时荧光定量PCR试剂盒(南京诺唯赞生物技术有限公司)。
多功能酶标仪(美国Thermo Scientific公司);EPS-600数显式稳压稳流电泳仪(上海天能科技有限公司);凝胶成像系统(美国Bio-rad公司)。
1.2 动物
健康SPF级雄性C57BL/6J小鼠,2月龄,体重20~25 g(河南斯克贝斯生物科技股份有限公司),许可证号SCXK(豫)2020-0005。所有小鼠饲养于食物、饮水充足的人工控制光暗环境的恒温饲养箱中。饲养箱温度25℃,湿度30%~60%,光照强度200 lx,12 h/12 h光暗周期,每天6∶00-18∶00灯光照明。实验开始前小鼠适应性饲养≥2周,动物实验经中国药科大学动物伦理委员会批准(批准号:202011004)。
1.3 动物分组和l/R模型制备
将小鼠随机分为4组:假手术组、假手术组+Rus组、I/R组和I/R+Rus组。假手术+Rus组和I/R+Rus组小鼠在术前1 h ig给予Rus 10 mg·kg-1,假手术和I/R组给予同体积溶媒(0.5%羧甲纤维素钠)。I/R组和I/R+Rus组均采用线栓法复制小鼠I/R模型。小鼠ip给予4%的水合氯醛麻醉,仰卧位固定于手术台上,在颈部正中作一定长度的切口,轻柔地分离出右侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA)。在靠近ECA分叉处约3 mm作一切口,缓慢将线栓沿ECA插入到ICA,当线栓头部插入的深度距离ECA与ICA分叉处9~10 mm且感到阻力时即停止进栓,缺血1 h后,拔出线栓实现再灌注。假手术组小鼠仅分离CCA,ICA和ECA,但不插线。选择造模成功的小鼠用于实验。模型成功的判定标准为:小鼠麻醉苏醒后出现神经功能缺损体征;缺血一侧大脑的对侧肢体出现神经功能障碍,且以前肢为重;小鼠出现跛行或对侧肢体屈曲内收,爬行时向对侧转圈[12]。
1.4 神经功能评分
再灌注24 h后,采用24分制评分表对小鼠进行神经行为评分[11-12],评分项目主要有:①身体对称。正常(0分)、向一侧倾斜(1分)、中度不对称(2分)、明显不对称(3分)、极度不对称(4分)。② 步态。正常(0分)、行走僵硬、不灵活(1分)、跛行(2分)、颤抖(3分)、无法行走(4分)。③ 转圈行为。正常(0分)、主要转向一侧(1分)、不总是向一侧转圈(2分)、总是向一侧转圈(3分)、旋转或无法移动(4分)。④攀爬行为。正常(0分)、沿着斜面攀爬(1分)、抓住斜面(2分)、滑下斜坡,防止跌倒行为失败(3分)、立即滑下斜坡,无防止跌倒行为(4分)。⑤前肢对称。正常(0分)、轻微不对称(1分)、中度不对称(2分)、明显不对称(3分)、前肢不对称且肢体或身体无法移动(4分)。⑥强迫转圈。正常(0分)、倾向转向一边(1分)、向一侧转圈(2分)、缓慢地向一边转圈(3分)、无法前进(4分)。
1.5 组织样本收集和处理
待神经功能评分完成后,ip给予4%水合氯醛麻醉小鼠,生理盐水心脏灌流至肝发白,取完整大脑,部分(n=8)用于TTC染色评价脑梗死体积,部分(n=3)置于-80℃冰箱保存,取皮质组织用于实时荧光定量PCR和Western印迹实验。
1.6 TTC染色观察脑组织梗死体积
将小鼠右侧完整大脑制成厚度为2 mm的冠状脑切片,浸泡于1%TTC 3~4 mL中,37℃恒温避光放置15 min。脑片正常区域被染成红色,梗死区域为白色。将脑切片转入4%多聚甲醛溶液中固定24 h后拍照。本研究采取右大脑中动脉栓线法制备脑I/R模型,仅右侧脑出现梗死。实际梗死体积=右侧脑体积-右侧脑无梗死体积。右侧脑无梗死体积由Image J软件分析获得,视左侧脑与右侧脑等体积的前提下,右侧脑梗死体积百分比(%)=(左侧脑体积-右侧脑无梗死体积)/左侧脑体积×100%。
1.7 实时荧光定量PCR法测定右侧梗死皮质组织Per1,Clock和Bmal1 mRNA表达水平
取-80℃保存的右侧梗死皮质组织25 mg,用Trizol提取总 RNA,测定A260nm/A280nm为 1.8~2.0。逆转录成cDNA,以此模板进行PCR扩增。Per1基因引物上游序列:5′-CAGCCGTGCTGCCTACTCATT-3′;下游序列:5′-AGAGGCAGCTTGGTGTGTGTC-3′。Bmal1基因引物上游序列:5′-CCAAGAAAGTATGGACACAGACAAA-3′;下游序列:5′-GCATTCTTGATCCTTCCTTGGT-3′。Clock基因引物上游序列:5′-CCTATCCTACCTTCGCCACACA-3′;下游序列:5′-TCCCGTGGAGCAACCTAGAT-3′。GAPDH基因引物上游序列:5′-AAATGGTGAAGGTCGGTGTGAAC-3′;下游序列:5′-GTCTTCTCTGAATGGGCCAG-3′。PCR反应体系为20 μL,扩增条件为:95℃ 10 min,95℃15 s,60℃ 1 min,40循环。使用QuantStudio 3仪器实时荧光定量分析,以 2-△△Ct法计算Per1,Clock和Bmal1mRNA相对表达水平。
1.8 Western印迹法检测小鼠右侧梗死皮质组织Per1,Clock和Bmal1 蛋白表达
取-80℃保存的小鼠右侧梗死皮质组织,用RIPA裂解液提取总蛋白,BCA试剂盒测定其浓度,SDS-PAGE凝胶电泳分离蛋白,湿法转膜2 h至PVDF膜上。用5%脱脂牛奶室温封闭1.5 h;加入一抗(稀释比例:Per1 1∶1000,Bmal1 1∶800,Clock 1∶1000,GAPDH 1∶10 000)4℃过夜;TBST洗膜,5 min,3次;加入适量二抗(稀释比例1∶6000),常温孵育2 h;TBST洗膜,5 min,3次。使用增强型发光试剂盒显影,凝胶成像系统Image lab图像分析软件进行测定,以目标蛋白条带与内参蛋白条带积分吸光度值的比值表示蛋白相对表达水平。
1.9 统计学分析
2 结果
2.1 Rus对脑l/R损伤小鼠神经功能评分和脑死梗体积的影响
如图1所示,I/R组行为学评分和梗死体积高于假手术组(P<0.01);与I/R组相比,I/R+Rus组行为学评分和梗死体积显著减小(P<0.01)。
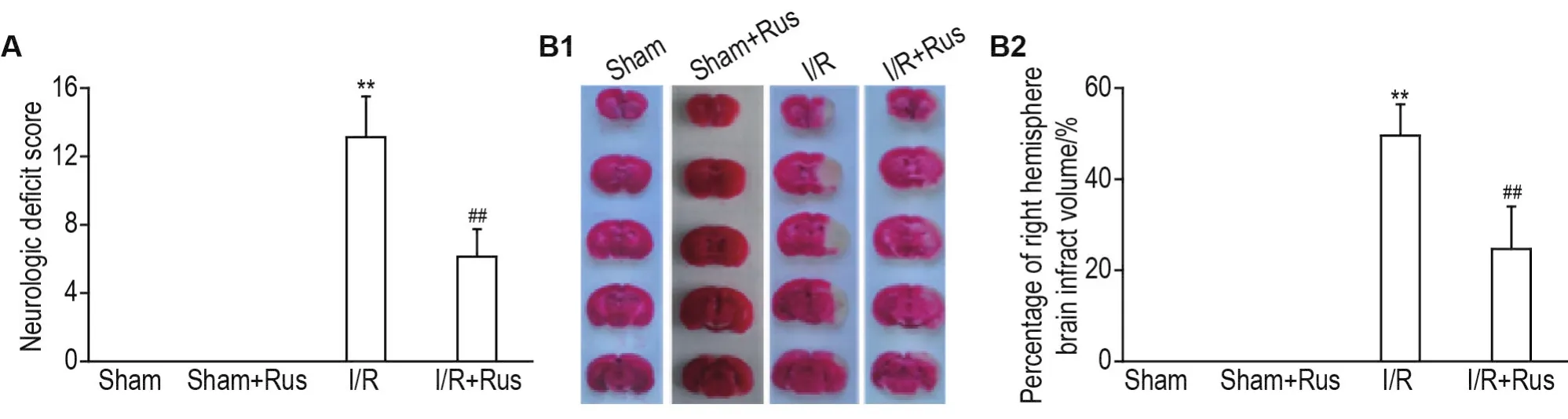
Fig.1 Effect of ruscogenin(Rus)on neurological deficit score(A)and cerebral infarction volume(B)of mice with cerebral ischemia/reperfusion(l/R)injury.B2 was the semi-quantitative result of B1.Mice were randomly divided into sham group,sham+Rus group,I/R group and I/R+Rus groups.Mice were ig Rus 10 mg·kg-1(in drug group)or 0.5% sodium carboxymethyl cellulose(in sham and I/R group)1 h before middle cerebral artery occlusion.The normal part of the right hemisphere brain was detected by Image J software.The percentage of right hemisphere brain infract volume(%)=(the volume of the left hemisphere brainthe normal part of the right hemisphere brain)/the volume of the left hemisphere brain×100%.±s,n=8.**P<0.01,compared with sham group;##P<0.01,compared with I/R group.
2.2 Rus对脑l/R损伤小鼠Per1,Clock和Bmal1 mRNA水平的影响
RT-qPCR检测结果如图2所示,与假手术组相比,I/R组Per1,Clock和Bmal1mRNA表达水平均显著下调(P<0.01);与I/R组相比,I/R+Rus组Per1,Clock和Bmal1mRNA表达水平显著上调(P<0.05,P<0.01)。

Fig.2 Effect of Rus on mRNA levels of Per1,Clock and Bmal1 in mice with cerebral l/R injury by real-time quantitative PCR.See Fig.1 for the mouse treatment.±s,n=3.*P<0.05,**P<0.01,compared with sham group;#P<0.05,##P<0.01,compared with I/R group.
2.3 Rus对脑l/R损伤小鼠Per1,Clock和Bmal1蛋白水平的影响
如图3所示,与假手术组相比,I/R组Per1,Clock和Bmal1蛋白表达水平下调(P<0.05,P<0.01);与I/R组相比,I/R+Rus组上述3种蛋白表达水平均上调(P<0.05,P<0.01)。

Fig.3 Effect of Rus on protein expressions of Per1,Clock and Bmal1 in mice with cerebral l/R injury by Western blotting.See Fig.1 for the mouse treatment.B was the semi-quantitative reslut of A.IA:integrated absorbance.±s,n=3.*P<0.05,**P<0.01,compared with sham group;#P<0.05,##P<0.01,compared with I/R group.
3 讨论
在哺乳动物中,生物钟调节着生物的生化和行为过程,维持其生理和行为的昼夜节律性[13]。研究表明,昼夜节律紊乱会导致生物体生理和生物行为改变,进而影响到疾病的发生和发展[14-15],有研究证实,时钟基因Per1被敲除后,脑I/R损伤更为严重[16-17]。在I/R小鼠模型上,小鼠脑缺血损伤的程度会因缺血发生的时刻不同而变化,在授时因子时间0(zeitgeber time 0,ZT0)发生的脑缺血损伤最严重,在ZT18发生的缺血损伤最轻[5]。其他研究证实,大鼠在ZT14发生的脑缺血损伤最严重,且海马中缺血损伤标志物胱天蛋白酶3,8和9的水平最高[18]。表明不同动物不同区域脑缺血损伤最严重的时刻有差异。缺血性损伤的程度具有昼夜节律,提示时钟基因的表达与脑I/R损伤有一定的相关性。基于此,推测通过药物调控时钟基因的表达,可能发挥减轻脑I/R损伤的作用。
本课题组前期研究表明,ig给予Rus可有效减小I/R损伤小鼠的脑梗死体积、减轻脑水肿和降低神经功能评分,且10 mg·kg-1剂量显示较好药效[9-10]。本研究的结果显示,与假手术组小鼠相比,I/R小鼠皮质组织中Per1,Clock和Bmal1 mRNA转录和蛋白表达水平均下调。相对于I/R组,I/R+Rus组时钟基因的转录水平和蛋白表达升高,提示Rus可能通过上调时钟基因的表达以减轻小鼠脑I/R损伤。此外有研究表明,褪黑激素和Bmal1增加了小鼠脑神经瘤细胞糖氧剥夺后的细胞存活率,这与丝氨酸/苏氨酸激酶(serine/threonine kinase,Akt)、细胞外信号调节蛋白激酶1/2和哺乳动物雷帕霉素靶蛋白存活途径的表达增加有关[19]。并且证明了褪黑激素在细胞生理条件下和糖氧剥夺之后,可通过激活磷脂酰肌醇3-激酶/Akt信号通路调节Bmal1蛋白的表达。本研究表明,ig给予Rus可上调小鼠脑皮质时钟基因表达,推测Rus可能通过相关信号通路调节时钟基因的表达,从而减轻脑I/R损伤,相关机制仍需进一步研究。
综上所述,Rus可能通过上调时钟基因Per1,Clock和Bmal1 mRNA和蛋白表达改善小鼠脑I/R损伤,但其具体机制尚不清楚。深入研究Rus调节时钟基因减轻脑I/R损伤的机制,对脑I/R损伤的防治具有重要的意义。
