ROS/JNK通路在槲皮素抑制异烟肼诱导肝细胞凋亡中的作用
2021-10-19陈廷玉陈德顺何帅兵易燕锋林钜斌卢春凤
陈廷玉,陈德顺,何帅兵,易燕锋,沈 洪,林钜斌,卢春凤
(1.湖州师范学院 医学院,浙江 湖州313000;2.江南大学 物联网工程学院,江苏 无锡 214122)
据2020年WHO统计资料显示,结核病在全球范围内的发病率呈急剧上升趋势,中国是结核病高发国之一.目前,结核病的治疗仍以药物治疗为主.异烟肼(isoniazid,INH)是临床上广泛应用的一线抗结核药物[1],但因其严重的肝损伤限制了它的临床应用,且严重影响了结核病的治疗效果[2-6].因此,如何防治INH肝损伤已成为亟需解决的问题,寻找有效防治INH肝损伤的药物也成为该领域的研究热点.槲皮素(quercetin,Que)是黄酮类化合物,具有抗氧化、抗炎、抗凋亡、抗纤维化等多种药理作用[7-9],且使用安全,具有理想的临床应用前景.我们前期研究发现,槲皮素对INH诱导的肝细胞和大鼠肝损伤具有一定的保护作用,但其作用机制尚不清楚[10-12].研究表明,ROS/JNK通路在细胞分化、细胞凋亡、氧化应激反应的发生发展中发挥着重要作用[13].因此,本研究以人肝细胞L-02细胞为研究对象,重点探讨ROS/JNK通路在槲皮素抑制INH诱导L-02细胞凋亡中的作用,进而阐明槲皮素对INH肝损伤的保护作用机制,以期为临床寻找有效防治INH肝损伤的药物提供实验依据.
1 材料与方法
1.1 细胞株与主要试剂
L-02细胞购自中国科学院上海细胞生物研究所;DMEM培养基为Gibco公司产品;胎牛血清为Hyclone公司产品;异烟肼、槲皮素、DCFH-DA均为Sigma公司产品;MTT为Amresco公司产品;LDH活性检测试剂盒购自南京建成生物工程研究所;BCA蛋白定量试剂盒、Hoechst33258染色试剂盒、Caspase 3活性检测试剂盒为杭州碧云天公司产品;丙烯酰胺、甲叉双丙烯酰胺、PMSF为Merck公司产品;Super ECL为普利莱基因技术有限公司产品;p-JNK、β-actin多克隆抗体为Santa Cruz公司产品,辣根过氧化物酶(HRP)标记的羊抗兔IgG为Zymed公司产品.
1.2 方法
1.2.1 L-02细胞培养与存活率检测
L-02细胞用含青、链霉素双抗及10%胎牛血清的DMEM培养基进行常规培养.镜下观察细胞生长情况,取对数生长期的细胞进行实验,加药后换为不含血清的培养液进行培养.将细胞随机分为4组.对照组(Control):给予等体积无血清培养基;INH组(INH):给予10 mmol/L INH;槲皮素低剂量组(Que-L):给予10 mmol/L INH+25 μmol/L槲皮素;槲皮素高剂量组(Que-H):给予10 mmol/L INH+50 μmol/L槲皮素.首先将细胞接种于96孔板中,再按实验分组进行处理,每组设3个平行孔,培养 24 h 后应用MTT法检测L-02细胞存活率.在波长570 nm处用酶标仪测定每孔的吸光度(OD)值,并计算细胞相对存活率:
细胞相对存活率(%)=(OD样品-OD本底)/(OD对照-OD本底)×100%.
1.2.2 LDH活性测定
将L-02细胞按实验分组进行处理,每组设3个平行孔,培养24 h后应用比色法测定细胞上清液中LDH活性.吸取细胞培养液,离心,取上清液100 μL,加入50 μL蒸馏水和250 μL基质缓冲液,充分混匀,37 ℃孵育15 min,加入250 μL 2,4-Dinitrophenylhydrazine,混匀,37 ℃孵育15 min,加入2.5 mL氢氧化钠,室温放置,3 min后在波长440 nm处用酶标仪测定OD值,并计算LDH活性.
1.2.3 Hoechst 33258荧光染色法检测细胞凋亡
将L-02细胞接种于用Poly-L-Lysine包被的培养皿中,按实验分组对细胞进行处理,每组设3个平行孔,培养24 h后采用Hoechst 33258荧光染色法检测细胞凋亡情况.具体按试剂盒说明进行操作:吸弃培养液,用PBS冲洗后加入500 μL固定液,4 ℃固定10 min,再用PBS冲洗,加入500 μL Hoechst 33258染色液,避光染色5 min,用PBS冲洗后加抗荧光淬灭剂,封片.在激发波长350 nm、发射波长460 nm下采用荧光显微镜观察细胞凋亡情况,拍照并计算细胞凋亡率:
细胞凋亡率(%)=凋亡细胞数/计数的细胞总数×100%.
1.2.4 Caspase 3活性检测
采用比色法检测细胞裂解液中Caspase 3活性.首先按实验分组处理细胞后收集细胞,然后用PBS洗涤细胞,加入100 μL细胞裂解液冰上裂解,离心,收集上清液.具体检测方法按试剂盒说明书进行操作:取10 μL裂解上清液,加入90 μL检测缓冲掖,再加入10 μL Ac-DEVD-pNA,37 ℃下避光反应1 h,用多功能酶标仪在400 nm处测定OD值,根据凋亡诱导的细胞OD值与空白对照细胞OD值的比值计算Caspase 3相对活性.
1.2.5 线粒体ROS水平测定
按实验分组处理细胞后,收集各组细胞,采用差速离心法分离线粒体,并用HEPES缓冲液制成线粒体悬液,应用荧光探针DCFH-DA检测细胞线粒体ROS水平.首先加入DCFH-DA,使其终浓度为2 μg/mL,37 ℃孵育30 min后,用冷PBS冲洗,然后在激发波长488 nm、发射波长525 nm下采用多功能酶标仪测定其荧光强度值.结果用相对值表示,即处理组荧光强度/对照组荧光强度×100%.
1.2.6 p-JNK蛋白表达水平检测
采用Western blot技术检测细胞中的p-JNK蛋白表达水平.首先将L-02细胞接种于培养瓶中,按实验分组处理细胞后收集细胞,然后加入细胞裂解液在冰上裂解细胞,提取细胞蛋白,并用BCA法对蛋白浓度进行测定.每孔上样10 μg总蛋白,在SDS-PAGE中进行电泳分离,然后将分离后的蛋白转膜至PVDF膜上.用含5%脱脂奶粉的封闭液封闭,2 h后加入用封闭液稀释的一抗(p-JNK、β-actin),室温孵育1 h后转入4 ℃冰箱孵育过夜.第二天用TBST洗膜,然后加入二抗室温再孵育1 h后TBST洗膜.在暗室中用Super ECL发光液检测目标蛋白条带,胶片曝光、显影,并扫描胶片,用Quantity One 4.6.2图像分析软件对p-JNK蛋白表达进行分析,以β-actin作为内参.
1.3 数据统计与分析

2 结果与分析
2.1 槲皮素和INH对细胞存活率及LDH活性的影响
由图1和图2可见:L-02细胞经INH处理后,与对照组相比,细胞存活率明显降低,而细胞上清液中LDH活性明显增高(P<0.01),提示INH可能造成细胞膜损伤,导致LDH漏出到细胞外液中;与INH组相比,槲皮素高剂量组细胞存活率明显增高,而经槲皮素处理后细胞上清液中的LDH活性明显降低(P<0.05或P<0.01),表明槲皮素对INH诱导的细胞损伤具有保护作用,且高剂量组的保护作用更显著.

注:与对照组比较,“**”表示P<0.01;与INH组比较,“#”表示P<0.05,“##”表示P<0.01.下同.

图2 L-02细胞上清液中LDH活性
2.2 槲皮素和INH对细胞凋亡的影响
采用Hoechst 33258荧光染料将L-02细胞染色后,在荧光显微镜下观察细胞凋亡情况,可见INH组细胞胞浆浓缩、核染色质致密深染,且个别细胞发生了核固缩、核碎裂等凋亡形态学改变,而经槲皮素处理后细胞凋亡形态明显改善,见图3.凋亡细胞数用凋亡百分率表示.由图4可见:L-02细胞经INH处理后,细胞凋亡率显著增高,与对照组相比差异具有统计学意义(P<0.01),表明INH可诱导L-02细胞凋亡;经槲皮素处理后细胞凋亡率明显低于INH组(P<0.05或P<0.01),表明槲皮素可抑制L-02细胞凋亡,且高剂量组对细胞凋亡的抑制作用更明显.

注:A为对照组,B为INH组,C为槲皮素低剂量组,D为槲皮素高剂量组.下同.

图4 L-02细胞凋亡率
2.3 槲皮素和INH对细胞Caspase 3活性的影响
由图5可见:L-02细胞经INH处理后,细胞Caspase 3相对活性明显升高,与对照组相比差异具有统计学意义(P<0.01);与INH组相比,槲皮素高剂量组细胞Caspase 3相对活性明显降低(P<0.05),表明槲皮素可抑制细胞Caspase 3相对活性.

图5 L-02细胞Caspase 3活性Fig.5 Activity of Caspase 3 in L-02 cells
2.4 槲皮素和INH对细胞线粒体ROS水平的影响
由图6可见:L-02细胞经INH处理后,细胞线粒体ROS相对水平明显升高,与对照组相比差异具有统计学意义(P<0.01),表明INH可诱导细胞线粒体ROS生成增多;而经槲皮素处理后细胞线粒体ROS相对水平明显低于INH组(P<0.05或P<0.01),表明槲皮素可抑制细胞线粒体ROS生成,且高剂量组对ROS生成的抑制作用更明显.

图6 L-02细胞线粒体ROS水平Fig.6 Level of ROS in mitochondria of L-02 cells
2.5 槲皮素和INH对细胞中p-JNK蛋白表达的影响
JNK是细胞凋亡通路蛋白,因为p-JNK是JNK的活性形式,所以本文研究了细胞中p-JNK蛋白表达情况,结果见图7和图8.L-02细胞经INH处理后,与对照组相比,细胞中p-JNK蛋白表达明显增高(P<0.01),表明INH可诱导L-02细胞中p-JNK蛋白表达;与INH组相比,槲皮素高剂量组细胞中p-JNK蛋白表达明显降低(P<0.05),表明槲皮素可抑制L-02细胞中p-JNK蛋白表达.
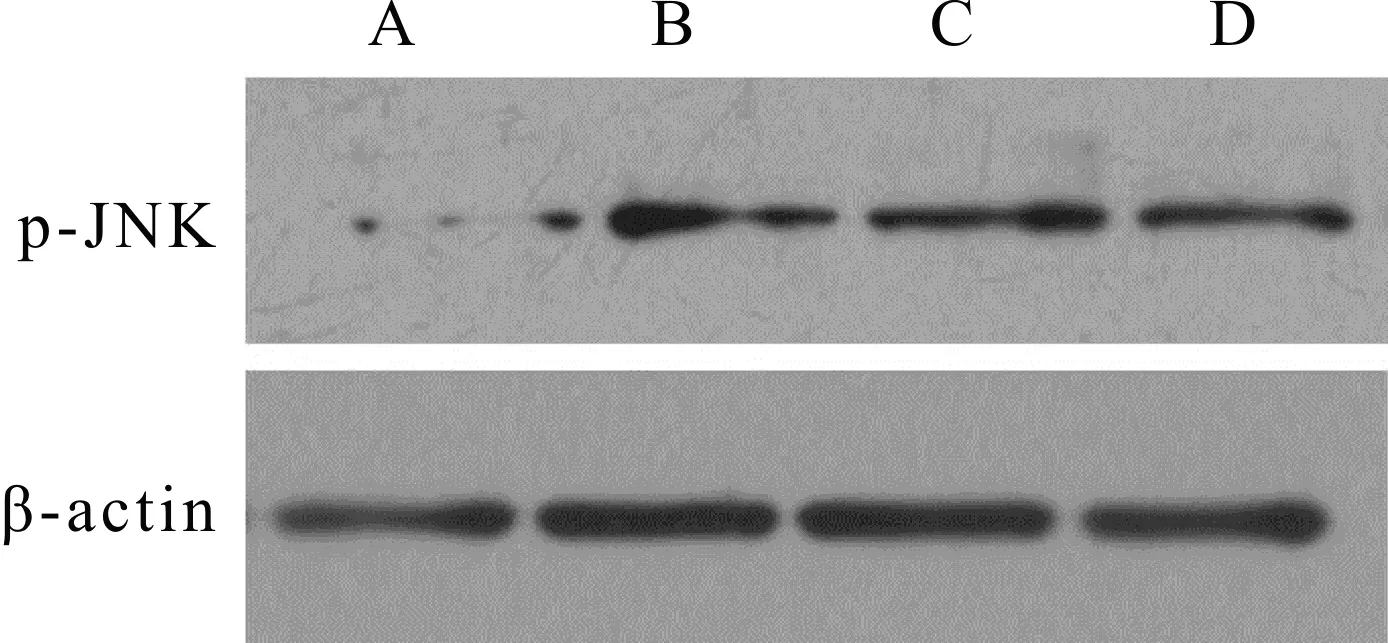
图7 L-02细胞中p-JNK蛋白表达条带Fig.7 Expression bands of p-JNK protein in L-02 cells
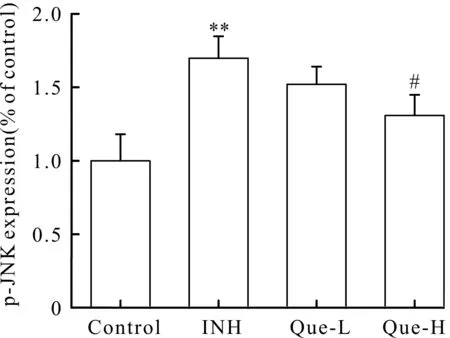
图8 L-02细胞中p-JNK蛋白表达分析Fig.8 Analysis of p-JNK protein expression in L-02 cells
3 讨 论
目前,INH诱导肝损伤的机制尚未阐明.研究表明,线粒体是药物细胞毒性的主要靶点,也是ROS产生的主要场所[14-15].近年来,线粒体在细胞氧化损伤和凋亡机制研究中的作用越来越受到学者们的关注[16].槲皮素是黄酮类化合物,具有良好的保肝作用[17].研究表明,槲皮素在体外可通过清除氧自由基、抗氧化、抗凋亡等发挥作用[19].前期研究发现,INH在体内和体外均可诱导肝细胞氧化损伤,产生大量的ROS,而槲皮素对其具有保护作用,但其作用机制尚不清楚[10-12,19].目前认为ROS介导JNK通路是JNK通路的重要成员之一,ROS/JNK通路在细胞分化、氧化应激反应、细胞凋亡的发生发展中起着重要作用[13].本实验主要研究了INH对L-02细胞凋亡的影响,并重点探讨了ROS/JNK通路在槲皮素抑制INH诱导L-02细胞凋亡中的作用.
本研究检测了L-02细胞存活率、LDH活性、细胞凋亡率及Caspase 3活性.LDH释放或漏出是反映细胞膜受损的重要指标,LDH漏出量的多少可间接反映细胞受损程度[20],而Caspase 3是细胞凋亡过程中的一个关键酶,Caspase 3的活化可启动细胞线粒体凋亡途径.本研究结果显示,L-02细胞经INH处理后,细胞存活率明显降低,LDH漏出和细胞凋亡率明显增加,且Caspase 3活性明显增高,表明INH对L-02细胞具有毒性作用,能够造成细胞膜损伤,激活Caspase 3蛋白酶,启动细胞线粒体凋亡途径,诱导细胞凋亡.Cristina等研究也发现,INH能诱导肝细胞发生氧化损伤,从而导致细胞凋亡[21].本文的研究结果与此相似. 本研究还发现,采用槲皮素处理L-02细胞能增加细胞存活率,减少LDH漏出和细胞凋亡率,并能够降低Caspase 3活性,表明槲皮素对INH诱导的L-02细胞损伤及凋亡具有保护效应.这与文献[22]的研究结果一致.
为探究INH诱导L-02细胞凋亡是否与ROS及JNK有关,本研究进一步检测了细胞线粒体ROS水平及细胞中JNK蛋白表达情况.ROS是细胞内主要的氧自由基,它的水平能反映细胞内氧化系统的情况,同时ROS具有很高的生物学活性,可作为第二信使参与到JNK通路中.ROS是JNK上游信号分子,ROS可促进JNK活化,而活化的JNK反过来刺激产生更多的ROS,最终JNK被持续活化,活化的JNK可启动Caspase级联反应,促进细胞凋亡;而阻止JNK的活化可抑制细胞凋亡[23].本研究发现,L-02细胞经INH处理后,细胞线粒体ROS生成和JNK蛋白表达增多,而槲皮素能明显减少细胞线粒体ROS生成,并抑制细胞JNK蛋白表达.这表明INH可能是通过增加ROS的生成激活JNK通路,启动Caspase级联反应,从而诱导细胞凋亡;槲皮素可能是通过减少ROS的生成抑制JNK通路,降低Caspase 3酶活性,从而抑制细胞凋亡.
综上,在本文的研究条件下,INH可诱导L-02细胞发生凋亡,槲皮素对INH诱导的肝细胞凋亡具有保护作用,其机制可能与其抑制ROS/JNK通路有关,但具体的作用机制还有待深入研究.
