氯吡格雷低反应冠心病患者血小板miRNA表达谱差异
2021-10-19李济民叶泽康谈楚楚李春坚
李济民,朱 辉,徐 可,王 飞,杨 璐,叶泽康,谈楚楚,顾 倩,王 静,李春坚*
1南京医科大学第一附属医院心脏科,江苏 南京 210029;2阜阳市第五人民医院心血管内科二病区,安徽 阜阳 236000;3南京医科大学附属常州第二人民医院老年病科,江苏 常州 213000
抗血小板治疗是冠心病(coronary artery dis⁃ease,CAD)药物治疗的基石。作为二磷酸腺苷(ade⁃nosine diphosphate,ADP)受体拮抗剂,氯吡格雷被广泛应用于急性冠脉综合征(acute coronary syn⁃drome,ACS)或冠状动脉支架植入后的CAD患者[1-2]。但研究发现,氯吡格雷的抗血小板疗效存在显著的个体差异,20%以上的患者在服用常规剂量的氯吡格雷时血小板聚集功能未被有效抑制[3],称为氯吡格雷低反应性(clopidogrel low response,CLR)或氯吡格雷抵抗(clopidogrel resistance,CR)[4]。研究显示,CLR 患者的支架内血栓、心肌梗死和全因死亡的风险显著增加[5]。
microRNA(miRNA)是一类长18~22 nt 的非编码RNA,其可通过与靶信使核糖核酸(messenger RNA,mRNA)特异性结合,在转录后水平调控靶基因的表达。Nagalla等[6]发现健康志愿者中血小板高反应组与正常反应组间血小板miRNA 存在表达差异,miRNA可以通过与mRNA结合来调控血小板蛋白的表达,从而影响血小板活性。本研究旨在通过筛查CLR患者血小板miRNA表达的差异,探寻对血小板聚集关键蛋白(P2Y12受体、Gi2α蛋白、血小板糖蛋白Ⅱb/Ⅲa 受体)可能有调控作用的miRNA,为个体化抗血小板治疗提供新的靶标。
1 对象和方法
1.1 对象
连续入选2015年4月—8月在南京医科大学第一附属医院心血管内科经常规氯吡格雷治疗(负荷剂量300 mg,维持剂量75 mg/d)至少5 d 的CAD 患者78 例。入选标准:①年龄18~80 岁;②入院诊断为急性心肌梗死(acute myocardial infarction,AMI)、不稳定型心绞痛(unstable angina pectoris,UA)或稳定型心绞痛(stable angina pectoris,SA);③签署知情同意书。排除标准:①氯吡格雷过敏或不耐受者;②高出血风险患者(如血小板计数<80×109/L、活动性消化性溃疡、近期脑外伤史等);③计划服用华法林或可能干扰氯吡格雷[如细胞色素P450 3A(cyto⁃chrome P450 3A,CYP3A)抑制剂或CYP3A 诱导剂等]抗血小板疗效的药物。本研究已在clinicaltrials.gov 网站注册,ID号:NCT02447809。
光学血小板聚集仪(light transmittance ag⁃gregometry,LTA;540VS,Chronolog公司,美国),全自动血液分析仪(XS⁃500i,Sysmex公司,日本),高速离心机(Centrifuge 5810 R)、移液枪(Eppendorf 公司,德国),反应杯、搅拌磁棒(Chronolog 公司,美国),漩涡震荡仪(上海青浦泸西仪器厂),pH 计(上海仪电科学仪器股份有限公司),去离子水制水设备(Mer⁃ck Millipore 公司,德国),电泳仪(Bio⁃Rad 公司,美国),凝胶成像系统(上海天能科技有限公司),Agi⁃lent 2200TapeStation(Agilent Technologies 公司,美国),Qubit 2.0(Life Technologies 公司,美国),Hiseq 2500(Illumina 公司,美国),台式低温高速离心机、分光光度计、水浴锅(Thermo Fisher Scientific 公司,美国),磁珠分选磁铁架(Miltenyi Biotec 公司,德国),电子天平(Mettler Toledo公司,瑞士),净化工作台(苏州安泰空气技术有限公司),制冰机(SANYO公司,日本),Illumina Hiseq 2500测序仪(Illumina公司,美国)。
TRIzol(Invitrogen 公司,美国),mirVanaTMmiR⁃NA Isolation Kit(Life Technologies 公司,美国),CD45 MicroBeads,human(Miltenyi Biotec 公司,德国),Small RNA Sample Prep Kit(Illumina 公司,美国),终浓度为5 μmol/L 的ADP(Chronolog 公司,美国),氢氧化钠、盐酸、冰醋酸(上海凌峰化学试剂有限公司),乙二胺四乙酸、琼脂糖、MOPS、PBS 粉剂(合肥Biosharp公司),枸橼酸钠(西陇化工股份有限公司),无水乙醇、甲醛(上海国药集团化学试剂有限公司),DEPC 水(Invitrogen 公司,美国),甲酰胺(上海麦克林生化科技有限公司),5 mL枸橼酸钠1∶9 抗凝的采血管(BD 公司,美国),CD45 抗体、LD 磁珠分选柱(Miltenyi Biotec 公司,德国),0.22 μm无菌滤器(Merck Millipore公司,德国)。
1.2 方法
1.2.1 血小板聚集率测定
在患者服用氯吡格雷后2.5 h,用含3.2%枸橼酸钠抗凝管采集肘静脉血样8 mL,并于标本采集后2 h内完成LTA 法血小板聚集功能检测,具体方法如下:在常温下将采集的血标本以200g离心8 min,用移液枪缓慢抽取离心后血标本的上清液以获取富血小板血浆(platelet rich plasma,PRP);用全自动血液分析仪检测PRP中的血小板计数;将吸取PRP后剩余的血样常温下以2 460g离心10 min,用移液枪缓慢抽取血标本的上清液以获取贫血小板血浆(platelet poor plasma,PPP);用PPP 作为稀释液将PRP中的血小板浓度稀释至250×109/L(如PRP中的血小板浓度在250×109/L以下,则无需稀释);向PRP中加入2.5 μL终浓度为5 μmol/L的ADP,测定8 min最大血小板聚集率。
参照CREST研究,将ADP诱导的血小板聚集率(platelet aggregation induced by adenosine diphos⁃phate,PLADP)大于上四分位数定义为氯吡格雷低反应性[7],小于下四分位数者设为对照组。
1.2.2 血小板纯化与RNA提取及变性电泳
在患者进行冠状动脉造影时,经鞘管采集15 mL动脉血于枸橼酸钠抗凝管,以200g离心10 min,移取上层PRP,用免疫磁珠法分选白细胞与血小板比例低于1∶5 000 000 的纯化血小板(具体操作参考CD45 MicroBeads LD 磁珠分选柱的说明书)。用TRIzol 裂解上述纯化血小板,再用mirVanaTMmiR⁃NA Isolation Kit 提取裂解后血小板中的总RNA(具体操作参考TRIzol 及mirVanaTMmiRNA Isolation Kit说明书),最终将每份样本的总RNA 溶解于20 μL无RNase 的的DEPC 水中置-80 ℃冰箱储存。通过Nanodrop 分光光度计检测每个样本总RNA 的浓度及260 nm/280 nm 的吸光度(OD)比值,确认每个总RNA 样本的OD 比值均在1.8~2.0 之间。按上述分组结果,将氯吡格雷低反应组和对照组患者的总RNA 分别混为2 个RNA 池。分别从2 组RNA 池中取RNA样本1.5 μg,按照相应配比加入10×MOPS、甲醛、甲酰胺并混匀,用1%琼脂糖凝胶进行变性电泳。
1.2.3 测序文库的构建及测序
每例样本取1.5 μg 总RNA 行15%尿素聚丙烯酰胺凝胶电泳,电泳后对18~32 nt片段进行切割、洗脱、纯化回收。采用Small RNA Sample Prep Kit(Il⁃lumina,美国)构建小RNA文库。纯化后的小RNA序列采用T4 RNA连接酶将接头引物分别连接至2个文库的序列5′端和3′端,逆转录合成cDNA 第一链,PCR建立小RNA文库。利用Illumina HiSeq 2500测序平台对该文库进行高通量测序。
1.2.4 小RNA数据处理和信息分析
测序所得长度为51 nt 的小RNA 序列通过去接头、去除低质量和污染序列,最终获得18~32 nt的高质量小RNA 序列。统计小RNA 的种类、数量及长度分布,初步判断小RNA质量。采用mirdeep2软件将所得小RNA序列与参考基因组进行比对分析,再将匹配序列分别与GenBank 和Rfam 10.0 数据库进行对比,筛选出miRNA 序列并分类注释,分析其表达情况。
1.2.5 miRNA差异表达分析
将样本中的miRNA 表达量标准化为TPM(tags per million),应用EdgeR 软件对2 对样本已知miR⁃NA表达差异分析统计。将“差异倍数”绝对值≥2且P<0.05的miRNA定义为差异表达的miRNA。差异倍数=Log2(氯吡格雷低反应组miRNA 标准化的表达量/对照组miRNA标准化的表达量)。
1.3 统计学方法
计量资料经正态检验符合正态分布者采用均数±标准差()表示,两组计量资料的比较采用独立样本的t检验;不符合正态性分布者用中位数与四分位数[M(P25,P75)]表示,组间比较采用非参数检验中的秩和检验;计数资料以百分率表示,计数资料比较采用χ2检验或Fisher’s精确检验。所有数据采用SPSS 20.0 统计学处理,P<0.05 为差异有统计学意义。
2 结果
2.1 临床基线资料及患者分组
根据入选患者的PLADP结果计算出四分位数P25=19.5%,P75=48.5%。选取PLADP>48.5%的氯吡格雷低反应性患者19例为低反应组,为了更明显地筛选出血小板miRNA 表达谱的差异,将PLADP<19.5%的19 例患者设为对照组。两组患者的临床基线特征包括年龄、性别、体重指数、临床诊断、既往史及合并用药等均无统计学差异(表1)。两组患者住院期间的生化指标包括红细胞计数、白细胞计数、尿素氮、丙氨酸氨基转移酶、射血分数等亦无显著的统计学差异(表2)。

表1 患者临床基线特征Table 1 Baseline clinical characteristics of the patients
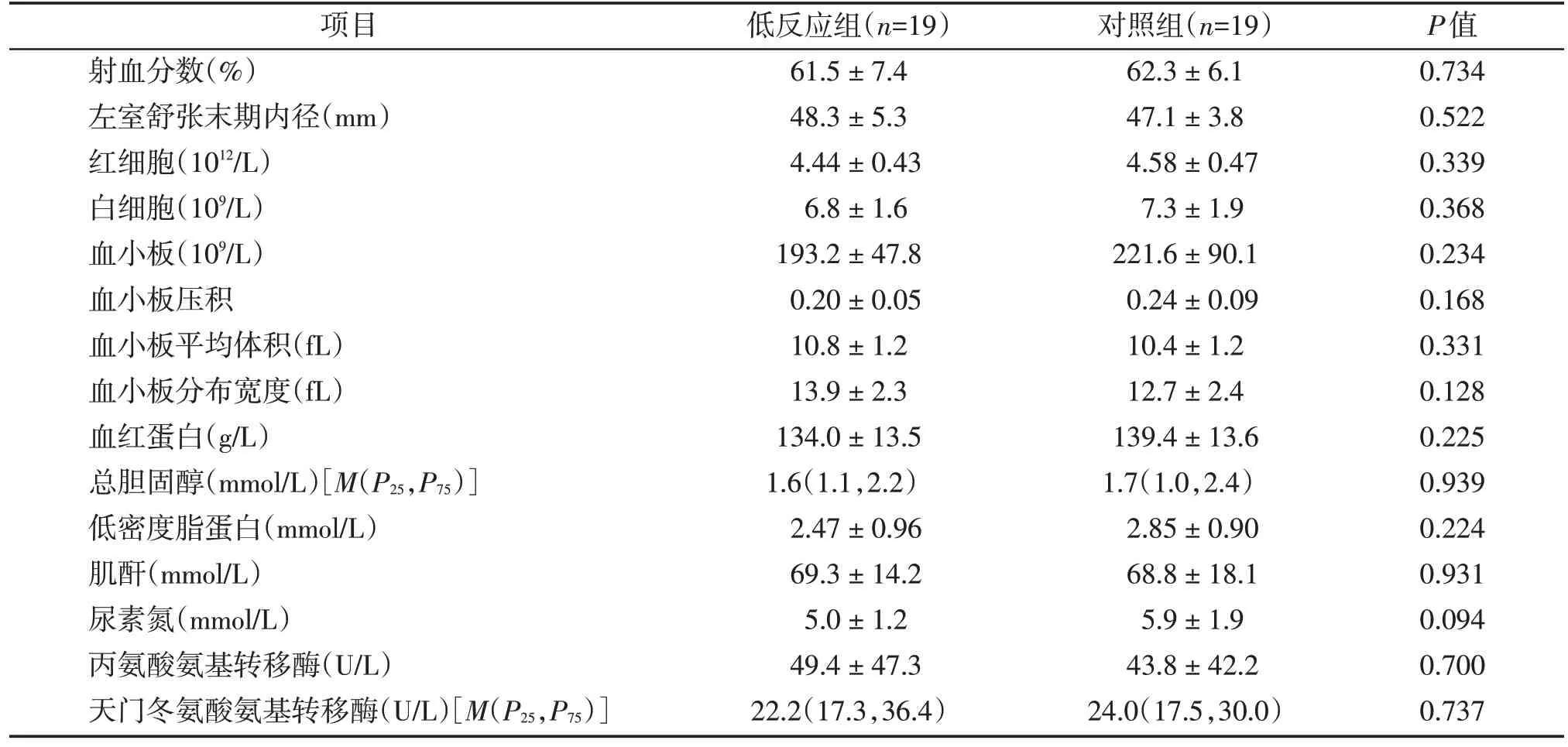
表2 患者住院期间的生化指标Table 2 Biochemical indexes of the patients during hospitalization
2.2 住院期间的血小板聚集率
氯吡格雷低反应组和对照组的PLADP分别为54.8%±5.3%vs.13.3%±4.4%,组间存在统计学差异(P<0.000 1,图1)。
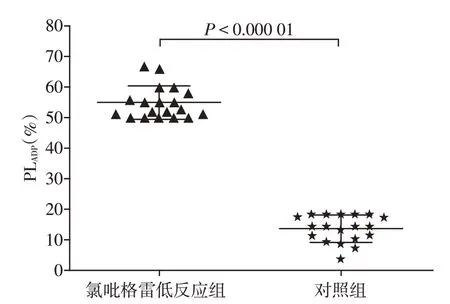
图1 两组患者血小板聚集率Figure 1 Platelet aggregation in the two groups
2.3 血小板总RNA的变性电泳
经Nanodrop分光光度计检测,氯吡格雷低反应组的血小板总RNA 池OD值为2.0,浓度为30.3 ng/μL。对照组的血小板总RNA 池OD 比值为1.9,浓度为41.8 ng/μL。从RNA 变性电泳图可以看出血小板总RNA 中miRNA 分布区的条带清晰,无明显降解(图2)。
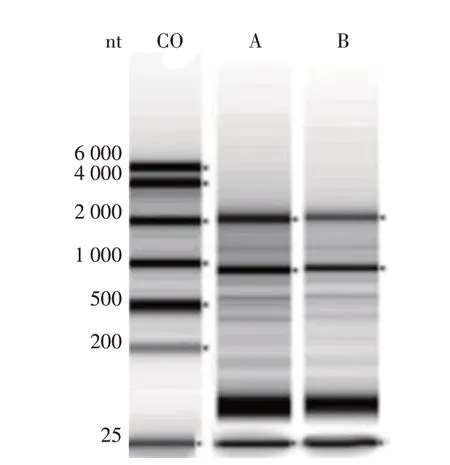
图2 血小板总RNA的变性电泳图Figure 2 Denaturation electrophoresis of platelet total RNA
2.4 两组患者血小板miRNA表达谱差异
通过高通量测序发现两组患者有95 种血小板miRNA 表达上存在显著差异,其中显著性下调的、差异倍数>2、拷贝数前20 位的miRNA 依次是hsa⁃miR⁃300、hsa⁃miR⁃151b、hsa⁃miR⁃1299、hsa⁃miR⁃16⁃1⁃3p、hsa⁃miR⁃3150b⁃3p、hsa⁃miR⁃548am⁃3p、hsa⁃miR⁃1260a、hsa⁃let⁃7f⁃2⁃3p、hsa⁃miR⁃4755⁃3p、hsa⁃miR⁃3144⁃3p、hsa⁃miR⁃5004⁃3p、hsa⁃miR⁃6862⁃5p、hsa⁃miR⁃1288⁃3p、hsa⁃miR⁃4661⁃5p、hsa⁃miR⁃4479、hsa⁃miR⁃4421、hsa⁃miR⁃6788⁃3p、hsa⁃miR⁃188⁃5p、hsa⁃miR⁃6874⁃3p、hsa⁃miR⁃218⁃5p(表3)。
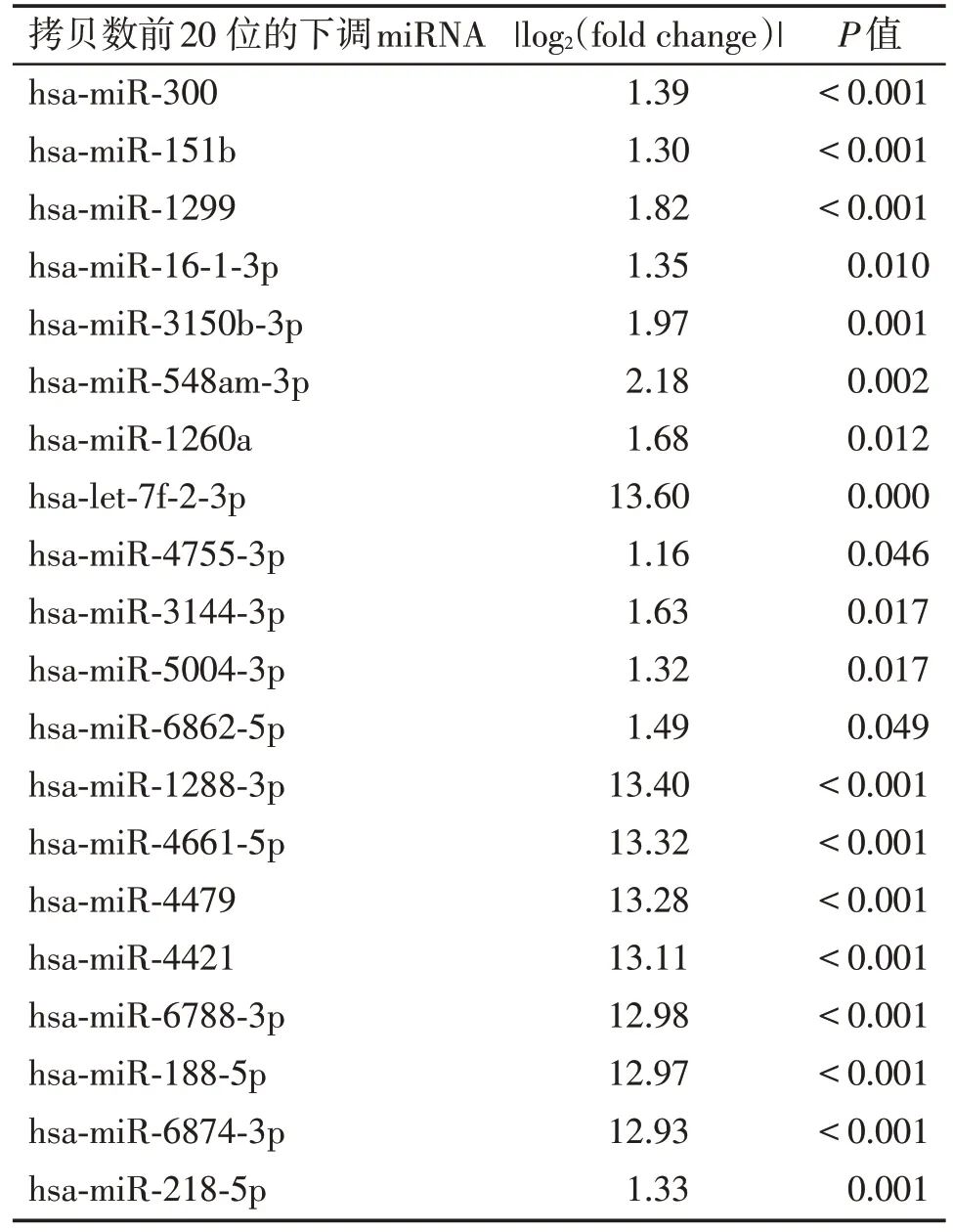
表3 大于2倍拷贝数下调的miRNA(前20 位)Table 3 2⁃fold down⁃regulated miRNAs(top 20)
2.5 靶基因预测
通过靶基因预测软件TargetScan、miRanda、PI⁃TA 和miRWalk 对上述显著性下调的、差异倍数>2、拷贝数前20 位miRNA 的靶基因进行预测,并从中筛选出至少被2个靶基因预测软件预测对血小板聚集关键蛋白(P2Y12 受体、Gi2α蛋白、血小板糖蛋白Ⅱb/Ⅲa 受体)可能有调控作用的miRNA;结果发现血小板miRNAs中的hsa⁃miR⁃188⁃5p、hsa⁃miR⁃6874⁃3p对P2Y12受体基因的表达可能具有调控作用;hsa⁃miR⁃218⁃5p、hsa⁃miR⁃3150b⁃3p、hsa⁃miR⁃1288⁃3p、hsa⁃miR⁃1299、hsa⁃miR⁃6862⁃5p 对Gi2α蛋白基因的表达可能具有调控作用;hsa⁃miR⁃6862⁃5p、hsa⁃miR⁃188⁃5p、hsa⁃miR⁃4421对血小板糖蛋白Ⅲa受体基因的表达可能具有调控作用;对于血小板糖蛋白Ⅱb受体,结果未发现同时被至少被2 个靶基因预测软件预测到的交集miRNA(表4)。

表4 血小板miRNA靶基因预测Table 4 Target gene prediction of platelet miRNA
3 讨 论
目前,阿司匹林与氯吡格雷双联抗血小板治疗被广泛应用于ACS患者[1,8-10],较之新一代ADP受体拮抗剂替格瑞洛,氯吡格雷在年龄≥75 岁的老年患者、肾功能不全、血小板计数偏低等特殊ACS 患者中使用更为安全[11]。但研究发现在服用氯吡格雷常规剂量的患者中CLR发生率>20%[12],且CLR患者血栓事件发生率显著增高[5]。研究发现CLR与细胞色素P450 2C19(cytochrome P450 2C19,CYP2C19)基因多态性、糖尿病、吸烟、肥胖、肾功能不全、血清碱性磷酸酶、血尿酸等多种因素相关[13-18],但基因变异等已知因素仅可解释约12%的个体反应差异,探讨CLR的未知相关因素一直是近年来的研究热点。
Chen等[19]发现与健康对照相比,支架植入术后接受抗血小板治疗(阿司匹林联合氯吡格雷或替格瑞洛或西洛他唑)的患者中miR⁃365⁃3p表达水平与抗血小板治疗的反应性相关;Chen S 等通过检测血管舒张刺激磷蛋白计算血小板反应指数来评价健康对照与介入治疗术后冠心病患者对氯吡格雷的反应性,发现miRNA⁃26a 与氯吡格雷低反应性相关[20];Nagalla 等[6]发现在血小板高反应与正常反应的健康人中有74种血小板miRNA 存在表达水平的差异,并发现miR⁃200b、miR⁃495和miR⁃107可通过特异性识别各自的靶mRNA 来调控血小板相应蛋白的表达。因入选对象、血小板miRNA 提取方法、血小板功能检测方法、miRNA 测序方法等存在差异,上述不同研究筛选出的与血小板反应性相关的血小板miRNA不尽相同。
本研究通过如下方面在一定程度上避免了相关偏倚对实验结果造成的影响:①参考相关研究共入选38例CAD患者[6],氯吡格雷低反应组与对照组患者的临床基线特征与生化指标均无显著的统计学差异。②采取了免疫磁珠法高效地纯化血小板后,提取的血小板miRNA又经Nanodrop分光光度计及变性电泳质控。③采用的光比浊法血小板功能检测可特异性地反映ADP通道被抑制的水平[21],是目前血小板聚集功能检测的“金标准”[22],也是国际相关共识推荐的检测方法之一[23]。POPULAR 研究比较了光比浊法、VerifyNow P2Y12、Plateletworks、IMPACT⁃R、PFA⁃100、改良PFA P2Y 共6 种血小板功能检测方法,结果提示,光比浊法是对临床终点有预测价值的3种血小板功能检测方法之一[24]。④选取的Illumina HiSeq 2500 测序平台是一个功能强大的高通量测序系统,可获得高质量数据,是目前高通量测序领域主导的检测方法之一[25]。
与对照组相比,CLR患者中有95种血小板miR⁃NA 表达上存在显著差异;通过查询靶基因预测软件TargetScan、miRanda、PITA 和miRWalk,筛选出了至少被2个靶基因预测软件预测对血小板聚集关键蛋白(P2Y12 受体、Gi2α蛋白、血小板糖蛋白IIb/IIIa受体)可能有调控作用的miRNA。在这些miRNA中,已有研究证实miR⁃218⁃5p 与凝血功能相关,但具体机制还有待进一步研究[26]。这些差异表达的miRNAs 有望成为血小板反应性特异性生物学标志物,也可能用于预测作用于相同位点的新型抗血小板药物的反应性。
综上所述,本研究通过高通量测序探讨了CLR的CAD患者血小板miRNA的表达差异,并筛选出了8个对血小板聚集关键蛋白可能有调控作用的miR⁃NA。随着血小板miRNA 对血小板和其他细胞(包括血管内皮细胞、心肌细胞等)以及lncRNA(long non⁃coding RNA)、circRNA、miRNA、mRNA 之间的调控网络的进一步完善,miRNA在抗栓治疗中的调控作用可能会为个体化抗血小板治疗提供新的干预手段,值得进一步深入研究。
