云南地区肾移植受者HLA基因分布频率分析
2021-10-19潘永圣汪佳婕许小靓徐宏忍赵云平尹利民
蒲 丹,潘永圣,汪佳婕,许小靓,徐宏忍,赵云平,尹利民
昆明市第一人民医院检验科,云南昆明 650011
肾移植是目前治疗终末期肾病的最有效手段,随着外科技术的成熟、围术期管理方法的完善、组织配型的开展、免疫抑制剂的应用,我国肾移植术后1年移植肾存活率已达94.6%,5年存活率为87.5%[1]。影响移植肾长期存活的主要独立危险因素是排斥反应[2],而人类白细胞抗原(HLA)的匹配程度与急、慢性排斥反应均有关[3]。HLA基因具有高度的遗传多态性,不同地区和种族基因分布频率存在明显差异[4],因此,找到与肾移植受者HLA完全匹配的无关供者概率非常小。近年来关于肾移植受者HLA等位基因研究的相关报道较少,本研究对云南地区1 251例肾移植受者的HLA基因检测数据进行了分析,以了解该地区HLA-A、B、DRB1和DQB1位点等位基因种类和分布频率。
1 资料与方法
1.1一般资料 选取2017年6月至2020年11月在本院运用PCR联合序列特异性寡核苷酸(SSO)探针技术进行HLA基因检测的肾移植受者1 251例为研究对象,其中男857例,女394例,平均年龄(41±12)岁。所有受者进行HLA基因检测前均未接受过任何移植手术。
1.2仪器与试剂 主要仪器:BIOER基因扩增仪(杭州博日仪器有限公司),Luminex 200多功能流式点阵仪(美国Luminex公司),Qbit4核酸浓度测定仪(美国赛默飞世尔公司)。 主要试剂:血液基因组DNA提取试剂盒(型号:DP348-02,北京天根生化科技有限公司), HLA-SSO LABType分型试剂盒 (美国One Lambda公司),Taq DNA聚合酶(上海普洛麦格生物产品有限公司)。
1.3方法 采集肾移植受者静脉血2~3 mL至乙二胺四乙酸二钾(EDTA-K2)抗凝真空采血管中,充分混匀,用血液基因组DNA提取试剂盒提取基因组DNA,采用Qbit4核酸浓度测定仪检测DNA浓度并调整至15~25 ng/μL。配制PCR反应体系:D-mix 13.8 μL,Primer 4.0 μL,DNA聚合酶0.2 μL,DNA 2.0 μL,终体积为20.0 μL。分别利用HLA-A、HLA-B、HLA-DRB1和HLA-DQB1位点的不同引物进行扩增。PCR结束后,将产物变性、中和,分别加入4种寡核苷酸探针标记的微珠混匀,60 ℃杂交15 min。杂交结束后加入链霉亲和素-PE染料进行染色,然后将杂交板转移至 Luminex 200多功能流式点阵仪进行数据获取,使用Fusion软件进行结果分析,具体操作步骤参照试剂说明书。
1.4统计学处理 采用Excel 2010进行数据分析。
2 结 果
2.1肾移植受者HLA-A位点等位基因分布频率 HLA-A位点检出等位基因17种,其中常见的等位基因是A*11、A*02、A*24,分布频率较低的等位基因是A*66、A*69和A*74,见表1。

表1 肾移植受者HLA-A位点等位基因及分布频率
2.2肾移植受者HLA-B位点等位基因分布频率 HLA-B位点检出等位基因31种,其中常见的等位基因是B*15、B*40、B*46,分布频率较低的等位基因是B*45、B*59和B*65,见表2。

表2 肾移植受者HLA-B位点等位基因及分布频率

续表2 肾移植受者HLA-B位点等位基因及分布频率
2.3肾移植受者HLA-DRB1位点等位基因分布频率 HLA-DRB1位点检出等位基因14种,其中常见的等位基因是DRB1*12、DRB1*04、DRB1*09、DRB1*15和DRB1*08,分布频率最低的等位基因为DRB1*06,见表3。

表3 肾移植受者HLA-DRB1位点等位基因及分布频率
2.4肾移植受者HLA-DQB1位点等位基因分布频率 HLA-DQ位点检出等位基因7种,分别为DQB1*02、DQB1 0301、DQB1 0302、DQB1 0303、DQB1*04、DQB1*05和DQB1*06,7种等位基因均较为常见,其中DQB1 0301分布频率最高,为0.286 6,DQB1 0302分布频率最低,为0.061 2,见表4。
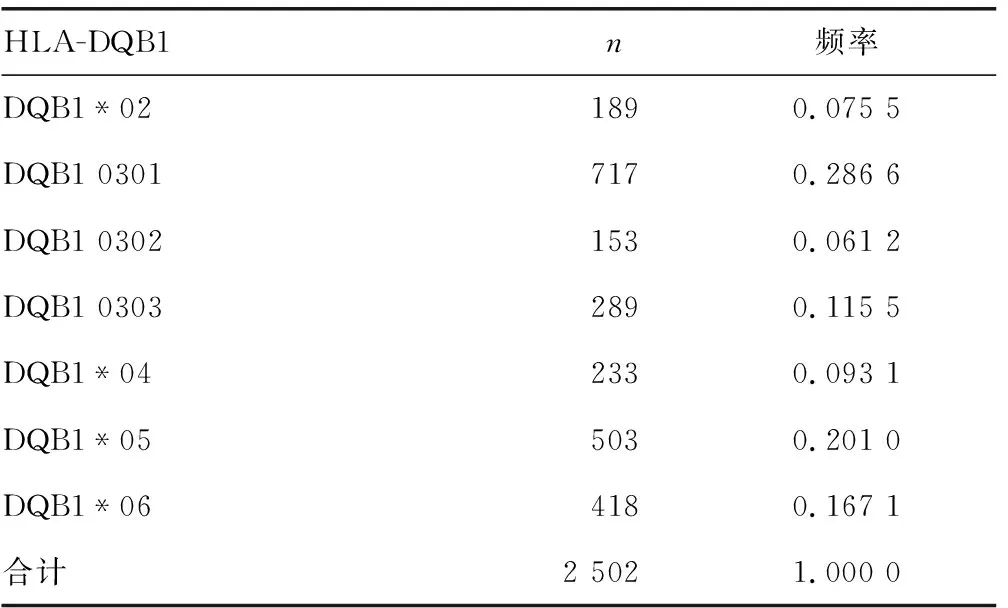
表4 肾移植受者HLA-DQB1位点等位基因及分布频率
3 讨 论
排斥反应是肾移植受者和移植肾存活的重要影响因素,HLA错配数可影响肾移植受者术后排斥反应的发生[5],但HLA系统具有高度多态性,找到HLA完全匹配的无关供者概率很低。1987年美国器官分配联合网制定了强制性HLA 6抗原匹配肾脏分享政策,要求ABO血型相容和HLA 6抗原相配的肾脏在全国范围内共享。按零抗原错配标准选择供受者的肾移植能够获得较为理想的近期和远期肾存活率,但能够达到6抗原无错配的肾移植仅占2% ~5%。我国各移植中心供受者的样本量小,能够达到零抗原错配标准的肾移植比例更低。因此,了解肾移植受者HLA不同位点的等位基因分布频率具有重要意义,可为肾移植配型提供可靠的科学数据。
本研究对肾移植受者1 251例的HLA基因检测数据进行分析,结果显示,HLA-A位点等位基因分布频率排在前3位的依次是A*11、A*02和A*24,频率分别为0.314 5、0.280 2和0.193 0,如此高的等位基因频率使找到相匹配的供者更加容易。PEI等[6]的研究结果显示,A*11:01(0.321 2)、A*2:07(0.125 4)、A*24:02(0.120 1)等位基因分布频率较高,与本研究结果较一致。马锡慧等[7]的研究结果显示,A2、A11和A24(9)抗原分布频率较高,分别为0.305 9、0.178 3和0.156 8,与本研究有一定差异。各研究结果不一致的原因可能与样本量不同、研究对象不同、地域不同等有关。ARNAIZ-VILLENA等[8]的研究报道,在白色人种、黑色人种和黄色人种中A*02、A*11和A*24分布频率均较高,A*25、A*34、A*66和A*74等多种等位基因在黄色人种中未被发现。然而,本研究结果显示,黄色人种也存在A*34、A*66和A*74等位基因,说明这几种等位基因并非白色人种或黑色人种所特有,考虑可能与ARNAIZ-VILLENA等[8]的研究中纳入的黄色人种例数较少或覆盖的地域不同有关。
本研究发现,昆明地区肾移植受者HLA-B位点是4个HLA位点中基因多态性最高的位点,因此在肾移植供、受者间匹配概率低于其他HLA位点。但有研究表明,HLA-B等位基因匹配不仅在移植肾长期存活中发挥重要作用,并且能降低晚期排斥反应的发生率[9-10]。本研究B*15、B*40和B*46分布频率较高,与PEI等[6]针对南宁汉族人群的研究结果一致,与吴强驹等[11]针对中国北方汉族人群的研究有一定差异,考虑中国南方不同省份的人群基因多态性可能无明显差异,但南、北方之间可能存在一定差异,也提示肾移植受者在寻找HLA相匹配的无关供者时应考虑地域差异。
研究表明,HLA-DRB1配型与早期排斥反应发生率呈高度相关性,HLA-DRB1位点错配会降低移植肾的存活率[12]。RODRIGUES等[13]的研究结果显示,HLA-DRB1等位基因错配对移植肾长期存活的影响更大。本研究中,HLA-DRB1位点常见的等位基因是DRB1*12、DRB1*04、DRB1*09,与云南地区造血干细胞捐献者HLA-DRB1位点最常见的等位基因一致[14],这提示肾移植受者找到相匹配的HLA-DRB1供者相对容易。
由于HLA-DR/DQ基因存在连锁不平衡,早期的组织配型一般只包括HLA-A、B、DRB1位点,然而越来越多的研究发现HLAⅡ类抗体显著影响移植肾的存活及功能[15]。LEE等[16]研究发现,HLA-DQB1抗体在慢性排斥反应的发生及移植物功能丧失中发挥重要作用。郑瑾等[17]研究发现,HLAⅡ类抗体出现频率以HLA-DRB1、DQB1抗体较高,尤其是HLA-DQB1抗体的频率在0.30~0.60,且大部分在0.50以上。HLA-DRB1抗体的频率在0.10~0.30。分析发生抗体介导的排斥反应(AMR)患者的供体特异性抗体(DSA)发现,HLAⅡ类抗体出现的频率高于HLAⅠ类抗体,尤其是HLA-DQB1抗体,因此,移植前HLA-DQB1位点的匹配非常重要。本研究发现,HLA-DQB1位点等位基因均较常见,其中分布频率最高的是DQB1 0301,其次是DQB1*05、DQB1*06,提示这几种等位基因在肾移植供、受者间匹配概率较大。
综上所述,肾移植受者HLA-A、B、DRB1和DQB1位点中,A*11、B*15、DRB1*12和DQB1 0301分别为分布频率最高的等位基因,符合南方汉族人群HLA基因多态性分布特征。了解肾移植受者HLA基因分布情况将有助于更好地寻找HLA相匹配的无关供者。肾移植供、受者良好的HLA配型可以减少术后急性和慢性排斥反应的发生,降低肾移植受者对供者HLA的致敏性,减少术后新生DSA的产生,改善肾移植受者术后的生存质量,提高肾移植受者与移植肾的长期存活率。
