MEBT/MEBO 联合 ADSC 治疗慢性难愈合创面的疗效分析
2021-10-19张炜强傅丽琴黎秋生
张炜强 傅丽琴 黎秋生
创面愈合是复杂的连续性生物过程, 通过炎症反应、 新生组织形成及组织重塑序贯交叉进行。 慢性难愈合创面是指无法通过常规程序及时修复恢复解剖和功能完整状态的创面[1]。 近年来, 由于大面积软组织损伤、 开放性骨折等所致的慢性难愈合创面越来越常见。 随着细胞和分子生物学的发展以及创面愈合过程研究的不断深入, 慢性难愈合创面的治疗方法也越来越多, 具有去腐生肌等多种作用的烧伤创疡再生医疗技术 (moist exposed burn therapy/moist exposed burn ointment, MEBT/MEBO) 及具备多向分化潜能的脂肪干细胞 (adipose-derived stem cells, ADSC) 在创面修复、 骨组织再生等领域得到了广泛应用[2-3], 但目前有关两者联合应用的研究鲜见报道。 基于此, 本研究将 MEBT/MEBO 与ADSC 联合应用于慢性难愈合创面的治疗, 取得了较为满意的临床疗效, 现报道如下。
1 临床资料
1.1 一般资料
选取2017 年1 月至2020 年1 月龙岩市第一医院收治的61 例慢性难愈合创面患者作为研究对象,并按照随机数表法将其随机分为研究组 (31 例)与对照组 (30 例), 两组患者性别、 年龄、 病程等一般资料对比,P均>0.05, 差异无统计学意义,具有可比性 (表1)。 本研究经龙岩市第一医院医学伦理委员会批准, 且所有患者均签署了知情同意书。
表1 两组慢性难愈合创面患者一般资料对比Table 1 Comparison of general data of patients with chronic refractory wounds between the two groups
1.2 纳入与排除标准
纳入标准: 符合慢性难愈合创面的诊断标准;依从性好, 能够配合完成全程治疗; 对本研究知情同意。 排除标准: 合并有湿性坏疽; 合并有恶性肿瘤或全身严重感染; 合并有严重心肺脑等重要脏器疾病; 合并有认知功能障碍或因特殊原因无法坚持治疗中途退出。
2 方法
2.1 治疗方法
对照组: 无菌操作下, 创面于生理盐水、 双氧水及碘伏反复冲洗消毒后, 在保护创面周围血管和神经的前提下彻底清除坏死组织、 异物及游离药痂,继而均匀涂抹湿润烧伤膏 (moist exposed burn ointment, MEBO), 厚约0.5 ~1.0 mm, 范围超过创缘1.0 cm, 并依次覆盖MEBO 药纱及无菌敷料包扎,根据创面渗出情况每天换药1 ~2 次, 直至创面完全愈合。
研究组: 腹部或腹股沟局部浸润麻醉后, 采用吸脂针吸取患者自体脂肪不少于35 mL, 8 h 内行ADSC 分离和培养。 采用含青霉素、 链霉素的磷酸盐缓冲液 (phosphate buffer solution, PBS) 洗涤后, 加入等体积Ⅰ型胶原酶和含10%胎牛血清的Hank’s溶液, 37 ℃消化 1 h; 消化完毕后, 200 目细胞筛过滤去除未消化的组织碎片, 2000 r/min 离心10 min 后弃去上清液; 加入含10%胎牛血清的DMEM 培养基中培养, 稀释为细胞悬液; 取10 μL细胞悬液, 加入30 μL 锥虫蓝染色, 显微镜下细胞计数脂肪干细胞 > 5 × 103/L 即为提取成功[4]; 将细胞悬液接种至培养瓶中 (密度约2 ×105/mL),置于37 ℃、 5% CO2、 95%湿度培养箱中培养; 待细胞贴壁 70% ~80% 时, PBS 漂洗 2 次, 弃去PBS, 培养瓶中加入胰蛋白酶37 ℃消化3 min, 并反复吹打, 加入等量培养基中和胰蛋白酶后, 转移至离心管, 1000 r/min 离心 5 min, 弃去上清液;培养基重悬沉淀, 细胞计数后接种于新培养瓶内;选择第3 或第4 代生长良好的ADSC, 经胰蛋白酶消化后收集上清液, 配制 ADSC 液, 置于冻存盒中, -80 ℃冻存备用。 无菌操作下清创后, 创面均匀涂抹MEBO (方法同对照组); 创缘注射ADSC液, 每周注射 1 ~ 2 次, 每次注射 5 ~6 mL, 直至创面完全愈合。
2.2 观察指标及评价标准
对比观察两组患者临床疗效, 血管内皮生长因子 (vascular endothelial growth factor, VEGF)、 碱性成纤维细胞生长因子 (basic fibroblast growth factor, bFGF) 表达水平, 创面愈合时间, 愈后皮肤瘢痕增生情况。
治疗4 周后, 评估两组患者临床疗效: 创面缩小40%以上, 渗出液明显减少, 新生肉芽组织新鲜无水肿为显效; 创面缩小20% ~40%, 渗出液有所减少, 创缘软化, 新生肉芽组织红润无水肿为有效; 创面缩小20%以下或扩大, 渗出液无明显减少, 肉芽组织老化为无效; 总有效率= (显效例数 + 有效例数) /总例数 ×100%[5]。
分别于治疗前及治疗4 周后, 切取适量创面组织, PBS 洗涤后称重剪碎, 按1∶9重量体积比加入含蛋白酶抑制剂的 PBS 匀浆, 5000 r/min 离心10 min, 取上清液; 严格按照说明书, 采用酶联免疫吸附法测定VEGF、 bFGF 表达水平。
创面愈合后采用温哥华瘢痕量表 (Vancouver scar scale, VSS) 评估瘢痕增生情况, 共包含厚度、色泽、 柔软性和血管分布4 个维度, 总分为0 ~15分, 分值越高表示瘢痕增生越严重[6]。
2.3 统计学处理
采用SPSS 22.0 统计软件对所得数据进行统计学分析, 其中计数资料以频数或百分比表示, 采用卡方检验或等级资料的秩和检验; 符合正态分布的计量资料以均数 ±标准差() 表示, 组间两两比较采用独立样本t检验; 均以P<0.05 为差异具有统计学意义。
3 结果
3.1 两组患者临床疗效对比
治疗4 周后, 研究组患者中显效17 例、 有效11 例、 无效 3 例, 总有效率为 90.32% , 明显优于对照组患者中显效10 例、 有效11 例、 无效9 例,总有效率70.00% (Z= -2.070,P=0.038)。
3.2 两组患者VEGF、 bFGF 表达水平对比
治疗前, 两组患者创面组织中 VEGF、 bFGF表达水平无明显差异 (P均>0.05), 具有可比性;治疗4 周后, 两组患者创面组织中VEGF、 bFGF 表达水平均明显升高, 且研究组明显高于对照组 (P均 <0.05), 详见表2。
表2 两组慢性难愈合创面患者创面组织中VEGF、 bFGF 表达水平对比 ()Table 2 Comparison of expression levels of VEGF and EGF in the wound tissues of patients with chronic refractory wounds between the two groups ()
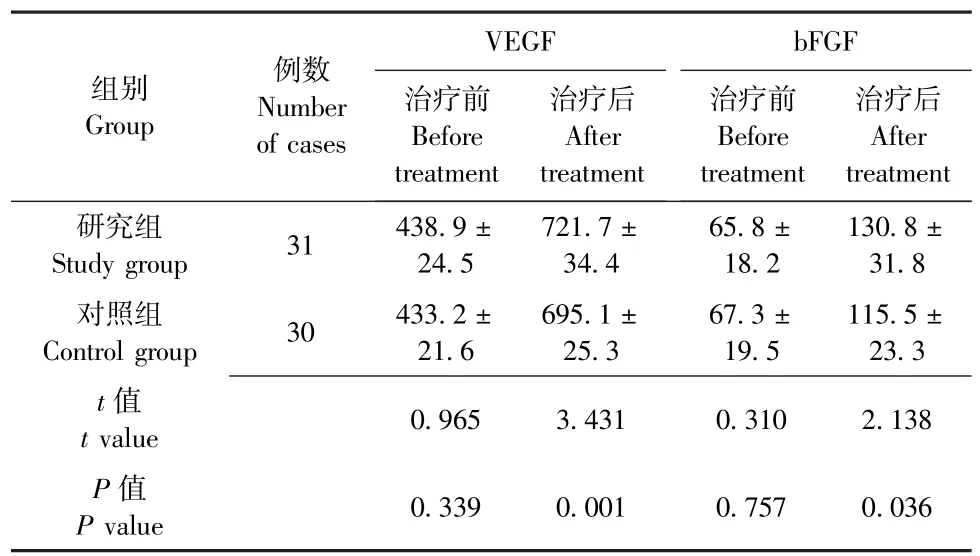
表2 两组慢性难愈合创面患者创面组织中VEGF、 bFGF 表达水平对比 ()Table 2 Comparison of expression levels of VEGF and EGF in the wound tissues of patients with chronic refractory wounds between the two groups ()
注: VEGF 为血管内皮生长因子, bFGF 为碱性成纤维细胞生长因子; 研究组患者局部创面采用烧伤创疡再生医疗技术联合脂肪干细胞治疗, 对照组患者局部创面采用烧伤创疡再生医疗技术治疗Note: VEGF - vascular endothelial growth factor, bFGF - basic fibroblast growth factor; The local wounds of patients in study group were treated with MEBT /MEBO combined with adipose-derived stem cell,while the control group were treated with MEBT/MEBO only
VEGF bFGF例数Number of cases组别Group 治疗前Before treatment治疗后After treatment治疗前Before treatment治疗后After treatment Study group 31 438.9 ±24.5研究组721.7 ±34.4 65.8 ±18.2 130.8 ±31.8 Control group 30 433.2 ±21.6对照组115.5 ±23.3 t 值t value 0.965 3.431 0.310 2.138 695.1 ±25.3 67.3 ±19.5 P 值P value 0.339 0.001 0.757 0.036
3.3 两组患者创面愈合情况对比
最终两组患者创面均完全愈合, 研究组患者创面愈合时间为 (36.53 ±5.83) d, 明显短于对照组患者的创面愈合时间 (41.07 ± 7.07) d (t=2.740,P=0.008)。 研究组患者愈后皮肤 VSS 评分为 (4.33 ±0.73) 分, 明显低于对照组患者的愈后皮肤 VSS 评分 (5.02 ± 0.85) 分 (t= 3.405,P=0.001)。
4 讨论
随着人口老龄化的加剧和疾病谱的改变, 除创伤、 烧伤等急性创伤所致的慢性难愈合创面外, 糖尿病足、 压疮等各类慢性疾病导致的慢性难愈合创面患者数量也逐年增加。 创面经久不愈不仅会严重影响患者的生活质量, 还会给患者造成沉重的心理负担。 MEBO 作为 MEBT/MEBO 的核心药物, 主要由芝麻油、 β-谷甾醇、 小檗碱等中草药成分组成,可通过改善局部微循环、 液化和排除坏死组织、 减轻创面炎症反应[7], 加速血管再生, 促进创面愈合[8-9]。 但临床研究显示, MEBT/MEBO 在慢性难愈合创面的治疗中虽具有显著疗效, 但治疗周期较长。 为进一步缩短慢性难愈合创面的愈合时间, 本研究将ADSC 与MEBT/MEBO 联合应用于慢性难愈合创面的治疗。
ADSC 可分泌多种细胞因子和生长因子, 促进表皮细胞生长、 血管生成、 胶原沉积等, 加快创面愈合[10], 利用未分化细胞的自我更新和功能细胞分化能力, 提高创面愈合率[11]。 本研究将其与MEBT/MEBO 联合应用于慢性难愈合创面的治疗,与单纯应用 MEBT/MEBO 相比, 创面愈合时间更短、 瘢痕评分更低、 临床疗效更高, 且 VEGF 和bFGF 的表达水平更高。 可见, ADSC 能够分泌VEGF 和 bFGF, 以进一步促进创面愈合[12]。 创面愈合涉及血管内皮细胞、 成纤维细胞等多种细胞的迁移、 增殖、 分化, VEGF 作为血管内皮细胞特异性生长因子, 对血管生成至关重要[13-14], 可诱导血管内皮细胞增殖分化, 促进血管生成[15]; bFGF可促进成纤维细胞的增殖分化, 同时能够上调VEGF 的表达水平[16]。 但慢性难愈合创面中缺乏具有再生潜能的细胞, 故分泌 VEGF、 bFGF 水平不足, 成纤维细胞迁移受限, 创面愈合较慢。 而脂肪中含有的大量间充质干细胞来源于中胚层, 可向脂肪细胞、 成骨细胞、 软骨细胞等多胚层细胞转化,而且能够分泌VEGF、 bFGF 等部分细胞因子参与创面修复的各个时期, 向创面组织中注射ADSC,解决了创面中缺乏潜能再生细胞的问题[17-18], 且MEBO 内含有的碳水化合物、 脂肪酸、 氨基酸等成分, 为其增殖分化提供了充足的营养物质[19], 进而促进了创面的再生修复。
综上所述, MEBT/MEBO 联合 ADSC 可提高VEGF、 bFGF 的表达水平, 缩短创面愈合时间, 有效缓解创面愈合后病理性瘢痕的形成, 疗效显著,具有较高的临床应用价值。
