Isatuximab治疗多发性骨髓瘤的研究进展
2021-10-19狄潘潘贾淑云
狄潘潘 王 杰 贾淑云
(1. 亳州市人民医院 静配中心, 安徽 亳州 236800; 2. 蚌埠医学院 公共基础学院, 安徽 蚌埠 233030)
多发性骨髓瘤(multiple myeloma,MM)是一种血液系统疾病,其特征是单克隆浆细胞的恶性增殖[1],我国MM的发病率约为十万分之一,以中、老年人居多[2]。MM的发生与器官功能障碍有关,临床可表现为骨痛、贫血、肾功能不全和高钙血症等。蛋白酶体抑制剂(例如硼替佐米)与免疫调节药物联合使用是治疗MM及复发/难治性多发性骨髓瘤(relapsed and refractory multiple myeloma,RRMM)的标准治疗方案,可提高患者的生存时间和生存率[3,4]。MM因极易复发而被当做慢性疾病来治疗,其治疗目标为控制症状、提高生活质量并延长生存时间[5]。MM的治疗方法包括诱导化疗(沙利度胺,地塞米松等)、巩固疗法(自身干细胞移植)和维持治疗(干扰素α-2)等,但都无法彻底治愈该疾病[6-8]。
CD38是一种具有外切酶活性的跨膜糖蛋白,有受体和粘附分子的功能。研究发现CD38在MM细胞呈高表达,而在正常淋巴和髓样细胞以及某些非造血来源的组织中表达相对较低[9,10]。新近研究表明CD38参与腺苷的产生,能发挥免疫抑制作用[11]。Isatuximab是一种靶向CD38的单克隆抗体,由赛诺菲开发并上市销售,并于2020年5月30日获得欧洲药物管理局(European Medicines Agency,EMA)批准与泊马度胺和地塞米松联合,用于治疗既往至少接受过两种治疗方法(包括来那度胺和蛋白酶体抑制剂)的成年MM患者。本文就isatuximab的作用机制、用法用量、药动学及临床研究等作一综述。
1 作用机制
Isatuximab是IgG1衍生单克隆抗体,可与造血及肿瘤细胞(包括MM)表面的CD38结合,抑制CD38的ADP-核糖基环化酶活性及CD38+调节性T细胞并激活自然杀伤(natural killer,NK)细胞。Isatuximab与CD38结合后,可激活免疫效应因子,诱导肿瘤细胞凋亡,其机制包括抗体依赖性细胞介导的细胞毒性(antibody-dependent cell-mediated cytotoxicity,ADCC),抗体依赖性细胞吞噬作用(antibody-dependent cellular phagocytosis,ADCP)及补体依赖性细胞毒性(complement dependent cytotoxicity,CDC)等[12]。同时,相关研究表明isatuximab与CD38结合后,可降低骨髓中由CD38介导产生的腺苷水平,从而有助于整个免疫抑制微环境[13]。Isatuximab与泊马度胺联合可增强ADCC活性,并可直接杀死肿瘤细胞[14]。
2 用法用量
Isatuximab为注射剂,与泊马度胺和地塞米松联合使用,联合使用剂量为10 mg/kg。年龄(36~85岁)、性别、种族等因素对用药剂量无显著影响,但不排除65岁以上老年人可能对用药剂量更为敏感。Isatuximab治疗周期为28 d,首个治疗周期给药时间为d 1、d 8、d 15和d 22,后续给药时间为d 1和d 15。在使用isatuximab前应使用地塞米松、对乙酰氨基酚、H2受体拮抗剂和苯海拉明以降低输液反应[15]。
3 药代动力学
以推荐剂量给药后,isatuximab的稳态最大血药浓度(Cmax)平均值(CV%)为351 mg/mL(36.0%),血药浓度-时间曲线下的面积(area under curve,AUC)为72 600 mg/(h·mL)(51.7%)。Isatuximab达到稳态的中位时间为8周。若2周给药剂量为1~20 mg/kg(推荐剂量的0.1~2倍),isatuximab的 AUC增加幅度大于剂量幅度;若前4周每周给药剂量为5~20 mg/kg(推荐剂量的0.5~2倍),以后每2周都给予相同剂量,则AUC呈等比例增加。Isatuximab平均分布体积(CV%)为8.13 L(26.2%),总清除率随着使用剂量的增加而降低。在稳定状态下,最后一次给药后血浆中的isatuximab药物浓度几乎全部消除(≥99%)的时间大约为2个月[15]。Isatuximab无论是单药还是联合用药其血药浓度消除趋势相似。Isatuximab稳态下的AUC随着体重增加而降低。年龄、性别、种族、肾功能不全和轻度肝功能不全对isatuximab AUC无显著影响[16]。
4 临床研究
Martin等[17]在2010年进行了isatuximab的Ⅰ期多中心临床试验,旨在评估isatuximab在RRMM患者中的单药疗效并确定最大耐受剂量(maximum tolerated dose,MTD)。试验共纳入84例RRMM成年患者,梯度剂量设计为0.000 1~20 mg/kg,每2周静脉给药1次;剂量扩展研究共两组(EC1:标准风险和高风险患者;EC2:仅高风险患者)给药剂量为10 mg/kg,每2周静脉给药1次,并预防性用药以避免输液反应(infusion reactions,IRs)。结果,94%的患者出现1~2级不良事件(adverse events,AEs)。当用药剂量≥10 mg/kg时,首次输注发生IRs的患者为47.6%,后续输注时再次出现IRs的患者为8.3%。多数IRs可通过治疗得到解决或患者自然缓解。最常见(≥5%)的IRs表现为寒战(12%)、呼吸困难(12%)及恶心(11%)等,严重程度均为1~2级。29.8%的患者因输注isatuximab而中断治疗,最常见AEs为IRs(27.0%)。其他常见(≥10%)的AEs为疲劳、恶心及咳嗽等。最常见的3~4级AEs为血液系统异常和肝肾异常。Isatuximab使用剂量≥10 mg/kg时可观察到客观缓解(objective responses,OR)。用药剂量为1~5 mg/kg的患者(n=11)总缓解率(overall response rate,ORR)为18.2%,临床受益率(clinical benefit rate,CBR)为27.3%,且ORR与CBR随用药剂量的增加而增加。1例剂量为10 mg/kg(每周1次)的患者达到了完全缓解(complete response,CR);用药剂量≥10 mg/kg的患者(不包括EC2组)中位无进展生存期(progression-free survival,PFS)为3.7个月(95%CI:2.56~5.78)。该实验表明isatuximab单药治疗一般耐受良好,在RRMM的治疗中显示出初步疗效。
2013年,Martin等[18]开展了isatuximab的Ⅰb期临床研究,该实验的主要目的是确定isatuximab联合来那度胺和地塞米松的MTD。研究共分为两部分,其中一部分研究(剂量递增研究)isatuximab的给药方案为3 mg/kg、5 mg/kg或10 mg/kg,每2周1次;另一部分给药方案为10 mg/kg或20 mg/kg,每周1次,连续给药4次后再调整为每2周1次。在剂量递增研究中仅发现1例(3级肺炎)剂量限制性毒性(dose-limiting toxicities,DLTs),并在中断治疗后毒性消失。该试验未达到MTD。最常见的AEs(大部分为3级)为腹泻(53%)、疲劳(49%)及上呼吸道感染(40%)等。所有接受治疗的患者CBR为65%,ORR为51%,包括2例CR、17例非常好的部分缓解(very good partial response,VGPR)和10例部分缓解(partial response,PR)。在可评估疗效的患者中ORR为56%,CBR为71%,首次应答中位时间为0.95个月(0.9~4.1),中位反应持续时间为10.9个月(1.4~31.4)。来那度胺难治性患者的ORR为52%,CBR为67%。所有接受治疗的患者中位PFS为8.5个月(95%Cl,4.73~16.59)。这项Ⅰb期研究的结果表明,isatuximab联合标准剂量的来那度胺和地塞米松对RRMM患者具有良好的耐受性和活性,临床疗效高于单用isatuximab。
Mikhael等[19]在2014年开展了isatuximab的Ⅱ期临床研究,旨在确定isatuximab的单一给药剂量。研究结果显示,给药剂量为3 mg/kg(每2周1次)的ORR为4.3%,剂量为10 mg/kg(每2周1次或每4周1次)的ORR为20.0%,剂量为10 mg/kg(每2周1次)的ORR为29.2%,剂量为20 mg/kg(每周1次或每2周1次)的ORR为24.0%。总CBR为28.9%,其中3 mg/kg(每2周1次)CBR为4.3%,10 mg/kg(每2周1次)CBR为41.7%,10 mg/kg(每2周1次或每4周1次)CBR为32.0%,20 mg/kg(每周1次或每2周1次)CBR为36.0%。10 mg/kg(每2周1次)剂量组的中位反应持续时间为14.8个月(3.7~16.6),20 mg/kg(每周1次或每2周1次)剂量组的中位反应持续时间为8.3个月(3.7~10.2)。中位PFS范围从3 mg/kg(每2周1次)剂量组2.1个月至10 mg/kg(每2周1次)剂量组的9.6个月。3 mg/kg(每2周1次)剂量组的中位总生存期(overall survival,OS)为15.3个月,10 mg/kg(每2周1次)剂量组的中位OS为18.6个月,其他剂量组未达到OS。总的来说,isatuximab在RRMM中显示出了良好的单药活性,一般耐受性良好,大多数首次输液反应为轻度,确定单一用药剂量为10 mg/kg。
Attal[20]等研究了isatuximab联合泊马度胺和地塞米松对比泊马度胺联合地塞米松的临床疗效,该研究的主要终点为PFS,次要终点为ORR及OS等。结果显示,isatuximab-泊马度胺-地塞米松治疗组与泊马度胺-地塞米松治疗组PR分别为60%和35%,VGPR分别为27%和7%,CR分别为5%和1%。相对来说,isatuximab-泊马度胺-地塞米松治疗组较泊马度胺-地塞米松治疗组反应发生更快、更持久。在PR或更好的患者中,首次缓解的中位反应时间分别为35 d(32~60 d)和58 d(32~87 d);中位缓解时间分别为13.3个月和11.1个月;先前接受过二线或三线治疗患者的OR分别为57%和39%;先前接受过三线以上治疗患者的OR分别为67%和29%。Isatuximab-泊马度胺-地塞米松治疗组与泊马度胺-地塞米松治疗组的疾病中位进展时间分别为12.7个月(95%Cl:11.2~15.2)和7.75个月(95%Cl:5.0~9.8)。研究结果显示,isatuximab联合泊马度胺和地塞米松治疗RRMM具有良好的临床疗效和耐受性。
由上述临床数据可知isatuximab单药治疗时的CR、PR、ORR、CBR和PFS等不及联合用药效果,且治疗效果随着剂量增加而增强;联合用药时,isatuximab-来那度胺-地塞米松方案临床效果不及isatuximab-泊马度胺-地塞米松方案,具体见表1。
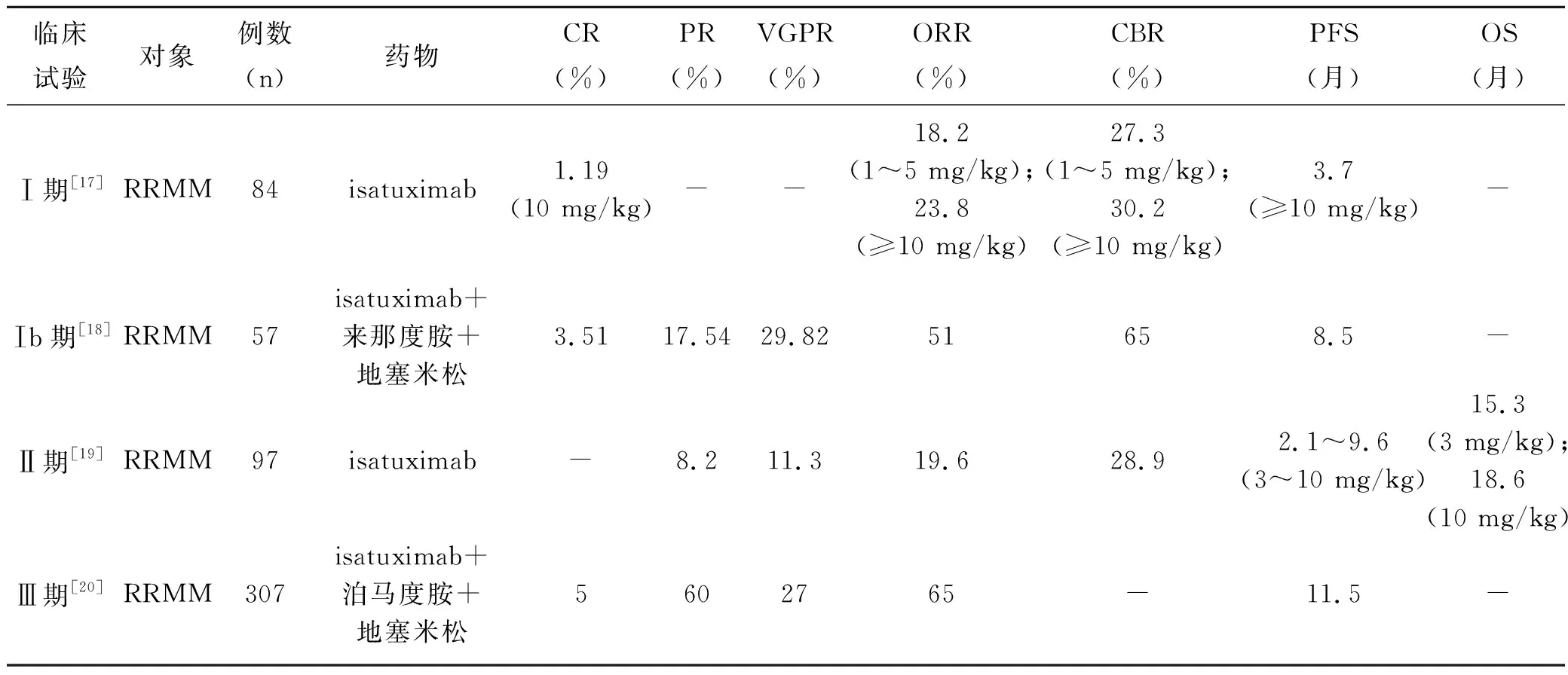
表1 isatuximab各期临床试验数据汇总
5 结语
MM发病率低,但治疗后易复发,是影响患者死亡的重要因素。蛋白酶体抑制剂(如硼替佐米,卡非佐米及伊沙佐米)及免疫调节剂(如沙利度胺,来那度胺及泊马度胺)的使用,显著提高了MM患者的生存率。目前蛋白酶体抑制剂及免疫调节剂是治疗MM的基石,而单克隆抗体药物的出现使得MM患者的预后有进一步的改善,如抗CD38单克隆抗体isatuximab和daratumumab[21]。Isatuximab联合蛋白酶体抑制剂及免疫调节剂治疗效果显著强于单一用药,可显著提高CR、PR、VGPR、CBR及PFS等,且患者的不良反应没有明显增加,耐受性良好。Isatuximab在首次使用时有明显的IRs,但可通过预防性使用药物降低发生率及严重程度。Isatuximab作为一种抗CD38单克隆抗体在治疗MM及RRMM方面显示出了良好的应用前景。总之,对于MM患者来说isatuximab是一种有希望的新治疗选择。
