齐整小核菌发酵产胞外多糖的培养基优化研究
2021-10-18柳昊睿赵馨仪黄福山黄正梅
张 丽,柳昊睿,赵馨仪,翟 丽,黄福山,黄正梅,王 敏*
(1.德州昂立达生物技术有限公司,山东 德州 253000;2.天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室天津市微生物代谢与发酵过程控制技术工程中心,天津 300457)
多糖(polysaccharide)是由糖苷键结合的糖链,至少要超过10个单糖组成的聚合糖高分子碳水化合物,目前已经成为分子生物学、食品科学、药学等领域中的热点研究内容之一[1-3]。随着分子生物学的发展,人们逐级认识到糖及其复合分子具有极其重要的生物学功能,多糖具有抗凝血、抗感染、降血糖和降血脂等作用。多糖还可以控制细胞分裂和老化,与细胞间物质的运输、癌症的诊断与治疗等都有着密切的关系[4-8]。
进入21世纪以来,利用生物技术生产聚合物和生物分子得到了长足的发展。与传统化学技术相比,生物技术具有化石资源消耗少、反应条件温和、环境友好等诸多优点。一些微生物最近被用于经济地生产微生物多糖。硬葡聚糖是一种非离子型、水溶性多糖,是由丝状真菌小核菌属纯培育发酵获取,此中最典范的是齐整小核菌。小核菌多糖[9-11]拥有良好的水溶性、粘度、增稠性和稳定性[12]。近几年来,国内外的研究者对微生物发酵产多糖的优化方面也做了大量研究,WANG L Y等[13]利用一株新菌株Kosakonia cowaniiLT-1进行发酵生产胞外多糖的研究。通过比较转录组学分析,了解蔗糖对胞外多糖(exopolysaccharides,EPS)生物合成的影响。向蓉等[14]通过探究龙眼多糖添加量、发酵时间、接种量和初始pH对丁酸梭菌活菌量的影响,使总多糖含量比发酵前提高了464.65 mg/mL。FENG J等[15]通过优化发酵条件将灵芝的细胞内多糖产量提高到1.98 g/L。
考虑不同培养条件对齐整小核菌发酵产多糖量[14]的影响,从氮源、碳源、无机盐等多个因素进行培养基的优化和设计。近年来,多糖被广泛用于制药、化工和保健品行业中,应用领域不断扩大,需求量不断增加[17-18]。随着我国人民生活水平逐步的提高,多糖产品在国内市场的需求量也将逐渐增加。因此,对于怎样提高多糖产量显得尤为重要,首先利用Plackett-Burman法[19-20]可以快速有效的从许多因素中筛选出较为首要的几个因素,其次利用最陡爬坡试验及Box-Behnken试验优化培养基的配方[21-23]。本研究将对齐整小核菌发酵产多糖的培养基中的碳源、氮源以及无机盐进行优化,提高其胞外多糖产量。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌种
齐整小核菌(Sclerotium rolfsii)ATCC 15205:保藏于天津科技大学微生物制药研究室。
1.1.2 化学试剂
酵母浸粉、胰蛋白胨(均为生化试剂):北京索莱宝科技有限公司;酵母膏、大豆蛋白胨、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;七水硫酸镁、葡萄糖、蔗糖、果糖、麦芽糖、甘露醇、乳糖(均为分析纯):天津市耀华化工厂;磷酸氢二钾、氯化钠、硝酸钠、氯化钾、七水硫酸亚铁、七水硫酸锌、磷酸、乙醇(均为分析纯):天津化学试剂二厂。
1.1.3 主要培养基
基础液体培养基:葡萄糖100.0 g/L,NaNO33.0 g/L,KH2PO41.3 g/L,柠檬酸0.7 g/L,KCl 0.5 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.05 g/L,维生素B13.3 mg/L,ZnSO4·7H2O 3.3 mg/L,酵母提取物1.0 g/L。pH=4.5~4.7(磷酸调节)。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂15 g/L,水1 000 mL,自然pH。
1.2 仪器与设备
LD5-10型低速离心机:北京医用离心机厂;EMS-4B磁力搅拌器:天津欧诺仪器仪表有限公司;Agilent1200高效液相色谱系统:美国安捷伦公司;HYG-II回转式恒温调速摇床:上海欣蕊自动化设备有限公司;DL102型电热鼓风干燥箱:天津市实验仪器厂;754PC紫外-可见光分光光度计:上海菁花科技有限公司;FA2204B电子天平:上海精密科学仪器有限公司;ZHJH-1112超净台:上海智诚分析仪器制造有限公司;SS-325型全自动灭菌锅:日本TOMY仪器有限公司;SAB-40E生物传感仪:山东省科学院生物研究所。
1.3 试验方法
1.3.1 发酵产胞外多糖工艺流程及操作要点
配制培养基并灭菌→接种→液体发酵→过滤→浓缩→除蛋白、色素等→醇沉→离心并干燥→粗多糖
操作要点:
(1)接种:按5%接种量向发酵液中接入种子液。
(2)发酵:发酵液酸度4.5%~5.5%,接种温度28~30 ℃;发酵温度27~29 ℃培养时间66~70 h。
(3)过滤、浓缩:选用压滤形式过滤除去发酵菌丝体等,收集澄清发酵液;选用蒸发提取等形式浓缩发酵液,提高多糖浓度;
(4)除蛋白、色素等:选用Servage法去除蛋白质;选用添加活性炭等形式去除色素等;
(5)醇沉:按照4倍体积添加无水乙醇,4 ℃静置过夜。
(6)离心干燥:醇沉过夜后,5 000 r/min离心20 min,倒出有机溶剂收集沉淀部分冷冻干燥,得到粗多糖。
1.3.2 多糖含量测定方法
(1)葡萄糖标准曲线的绘制
准确称取无水葡萄糖标准品10 mg,定容至100 mL容量瓶中,上下摇晃使之完全溶解,配成质量浓度0.1 mg/mL的葡萄糖标准溶液。量取葡萄糖标准溶液0.2 mL、0.4 mL、0.6 mL、0.8 mL和1.0 mL于试管中,加去离子水至1.0 mL,再分别加入1.0 mL 5%苯酚溶液,然后加入5 mL浓硫酸摇匀,此过程需在冰水浴中进行。最后置于30℃水浴中反应30min,于波长490 nm测吸光度值,制作标准曲线。
(2)多糖的提取及含量测定
取培养至稳定期的齐整小核菌发酵液2 mL于离心管中,12 500 r/min离心5 min,取1 mL上清于EP管中,加4倍体积的无水乙醇,4 ℃静置过夜,进行醇沉,沉淀部分加10 mL水复溶,得到溶液①,取1 mL溶液①补水至10 mL得到溶液②。用Sevage法除蛋白,再用去离子水透析48 h,最后将多糖溶液在200~400 nm处进行扫描,收集在波长260 nm和280 nm处无吸收峰和无蛋白的组分,并采用苯酚-硫酸法测定多糖的含量[24-25]。
1.3.3 单因素试验设计
(1)碳源筛选
以基础液体培养基为基础,分别考察质量浓度为100g/L的葡萄糖、蔗糖、麦芽糖、乳糖、果糖、甘露醇6种碳源对发酵效果的影响。于100 mL/250 mL摇瓶中接种对数期齐整小核菌液5%,置于28 ℃培养箱中220 r/min振荡培养5 d,按苯酚硫酸法测定多糖含量,每种碳源做三组平行。
(2)氮源筛选
在碳源筛选的基础上,分别采用胰蛋白胨、酵母浸粉、酵母膏、大豆蛋白胨、蛋白胨作为氮源,每种氮源含量设定为6 g/L,其余步骤与测定碳源相同,根据多糖产量,选择合适的氮源种类。
1.3.4 Plackett-Burman试验设计
按照1.3.3中对碳源和氮源种类的筛选结果和相关文献结论,分别以葡萄糖和胰蛋白胨为碳、氮源,结合影响齐整小核菌发酵状态主要的无机盐NaNO3、KCl和FeSO4,并进一步结合培养基必需的MgSO4和K2HPO4等7个因素,采用PB试验筛选培养基组分中对于齐整小核菌发酵所得期望值影响显著的因素。以筛选培养基各成分中对多糖产量影响最为显著的若干因子。
1.3.5 最陡爬坡试验与Box-Behnken试验设计
在上述试验结果的基础上,进行最陡爬坡试验方案的设计,并进一步进行Box-Behnken设计试验,依据此方案进行试验,根据结果进行分析从而获得最优的培养基配方。
1.3.6 统计分析
采用Design-Expert 8.0.6.1软件进行Plackett-Burman试验和Box-Behnken响应面优化试验设计,运用该软件的数据分析功能进行数据分析,建立回归模型,并对建立的模型进行验证,利用Origin 8.5和SPSS 20.0软件对数据进行分析。
2 结果与分析
2.1 碳源筛选结果
在基础液体培养基的基础上,分别采用葡萄糖、蔗糖、麦芽糖、乳糖、甘露醇和果糖作为碳源,把每种碳源含量设定为100 g/L。制备培养基,检测每种碳源发酵条件下胞外多糖产量,培养基装液量为100 mL/250 mL,再分别以5%的接种量接入种子液,200 r/min、28 ℃培养48 h,进行摇瓶发酵。每种碳源分别做3组平行试验,测定多糖产量,试验结果见图1。由图1可知,当葡萄糖作为碳源时,多糖产量最高,为(16.54±1.16)g/L。因此,最适碳源为葡萄糖。
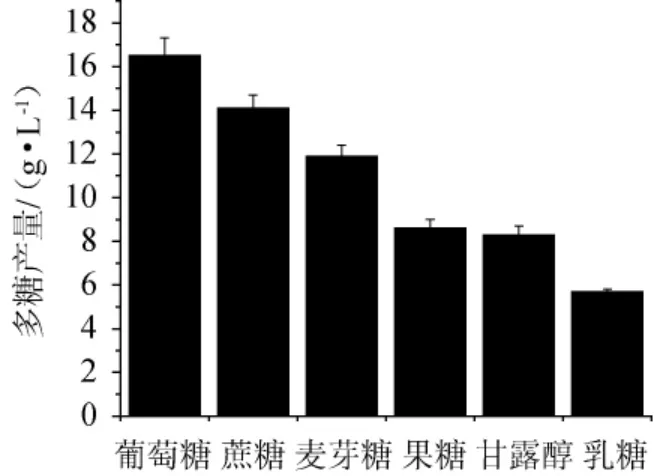
图1 不同碳源对齐整小核菌多糖产量的影响Fig.1 Effect of different carbon sources on polysaccharide yield of Sclerotium rolfsii
2.2 氮源筛选结果
在碳源筛选的基础上考察氮源种类对齐整小核菌产胞外多糖的影响。以基础培养基为初始培养基,在其他组分不变的情况下,分别采用6 g/L胰蛋白胨、蛋白胨、酵母浸粉、酵母膏、大豆蛋白胨作为氮源,替换培养基中的氮源,再分别以5%的接种量接入种子液,200 r/min、28 ℃培养48 h,进行摇瓶发酵。每种氮源培养基平行3次试验,测定每种氮源培养基的多糖产量,以选择适合的氮源种类,结果见图2。由图2可知,当胰蛋白胨作为氮源时,多糖产量最高,为17.23 g/L。因此,最适氮源为胰蛋白胨。
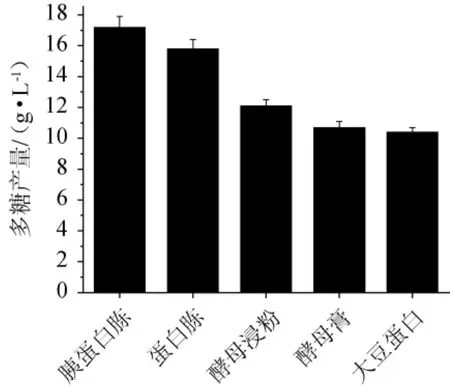
图2 不同氮源对齐整小核菌多糖产量的影响Fig.2 Effect of different nitrogen sources on polysaccharide yield of Sclerotium rolfsii
2.3 Plackett-Burman 设计试验结果
按照1.3.4的方法,采用Plackett-Burman试验,筛选培养基组分(葡萄糖、胰蛋白胨、NaNO3、KCl、K2HPO4、MgSO4和FeSO47个因素分别以X1~X7表示,以及X8~X11四个虚拟项)中对于齐整小核菌发酵所得胞外多糖期望值影响显著的因素。其中各因素的水平设置及结果分析分别如表1、表2所示,对所有的试验结果进行线性回归分析得到的多元一次方程为:Y=15.40+2.92X1+0.069X2+2.51X3-0.23X4-0.35X5-2.04X6-0.69X7。
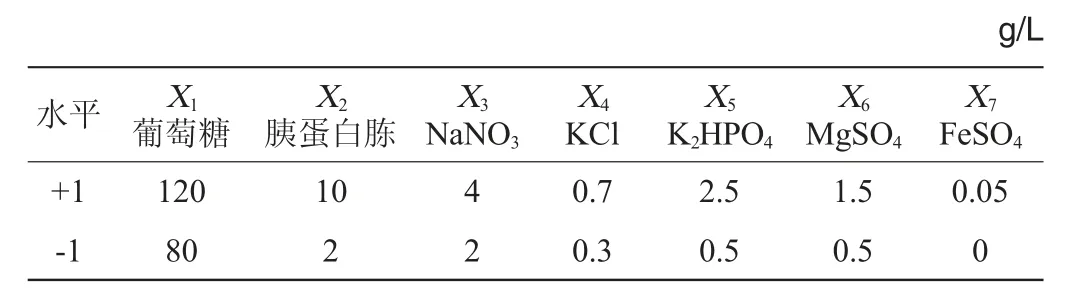
表1 Plackett-Burman试验的因素与水平Table 1 Factors and level of Plackett-Burman experiments
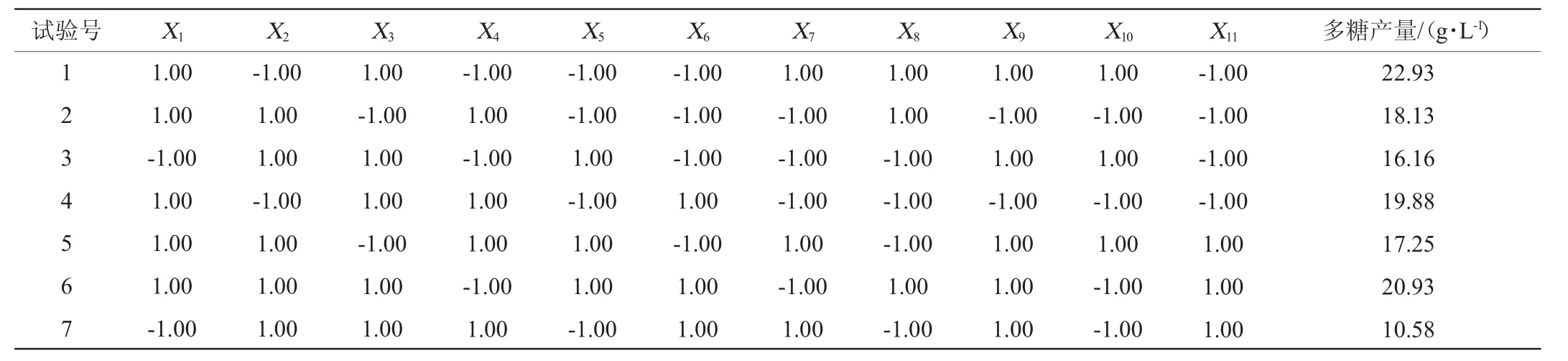
表2 Plackett-Burman试验方案及结果Table 2 Scheme and results of Plackett-Burman experiments
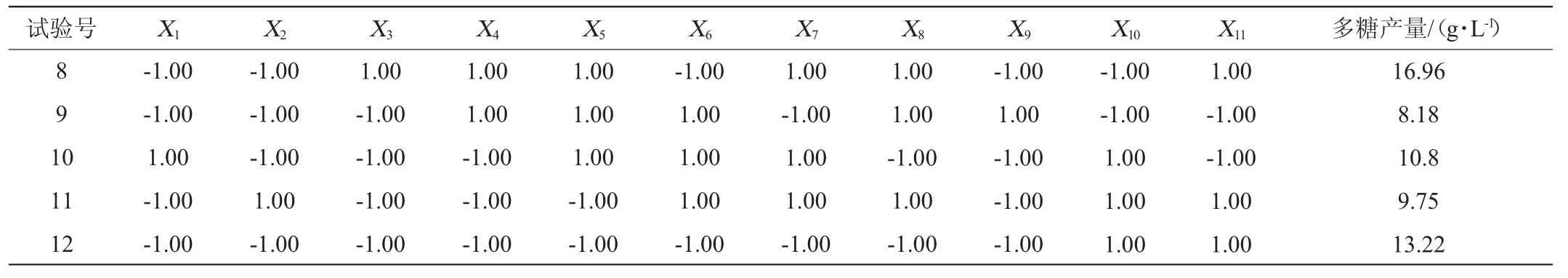
续表
用常规的F检验方法分析模型,齐整小核菌多糖产量影响因素的主效应分析结果如表3所示。由表3可知,线性模型P=0.036 5整体达到显著水平(P<0.05),表明该模型显著可靠,可以较好地描述试验影响因素与多糖产量之间的关系。发酵培养基中对齐整小核菌多糖产量的影响效应大小依次为:葡萄糖、NaNO3、MgSO4、FeSO4、K2HPO4、KCl、胰蛋白胨。其中葡萄糖、NaNO3和MgSO4均是显著影响因子(P<0.05)。因此,根据本试验结果确定对葡萄糖、NaNO3和MgSO4进行最陡爬坡路径设计。

表3 Plackett-Burman试验的回归分析结果Table 3 Regression analysis results of Plackett-Burman experiments
2.4 最陡爬坡试验
通过PB试验结果证实显著影响多糖产量的因素有葡萄糖、NaNO3和MgSO4。进一步通过最陡爬坡路径试验,优化葡萄糖、NaNO3、MgSO4添加量的水平,获得最佳培养基配方,其中试验方案设计及结果如表4所示。
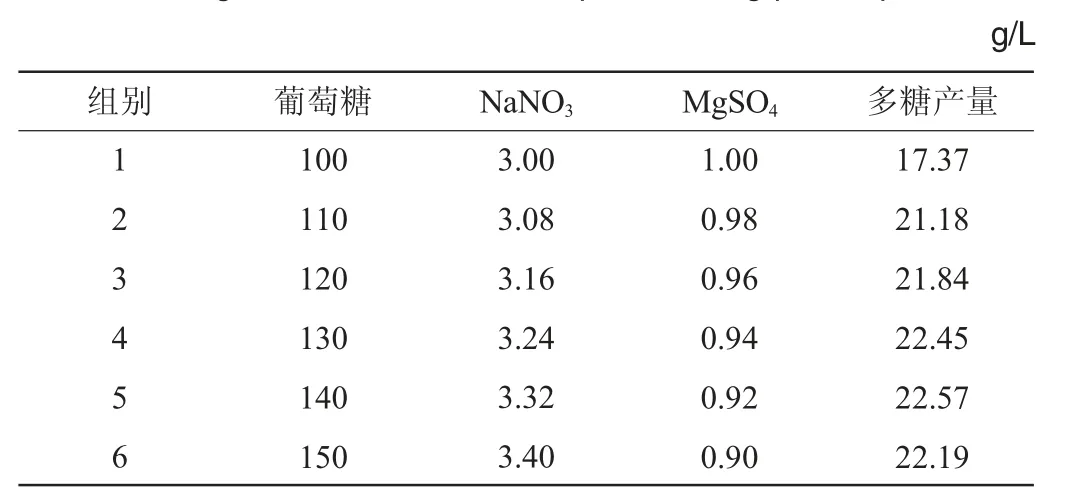
表4 最陡爬坡路径试验设计及结果Table 4 Design and results of the steepest climbing path experiments
结果显示,葡萄糖和NaNO3沿最速上升方向,MgSO4沿最速下降方向按照设计的浓度梯度变化。1~6组多糖产量呈现先上升后下降的变化趋势,当培养基中葡萄糖含量为140 g/L、NaNO3含量为3.32 g/L和MgSO4含量为0.92 g/L时,对应的多糖产量最多为22.57 g/L,为最大响应值区域。
2.5 Box-Behnken试验设计及结果
3个重要因子的最适浓度范围确定后,以葡萄糖(A)140 g/L、NaNO3(B)3.32 g/L、MgSO4(C)0.92 g/L为中心点,进行3因素3水平的响应面分析试验,多糖产量(Y)的Box-Behnken试验设计测定结果见表5。
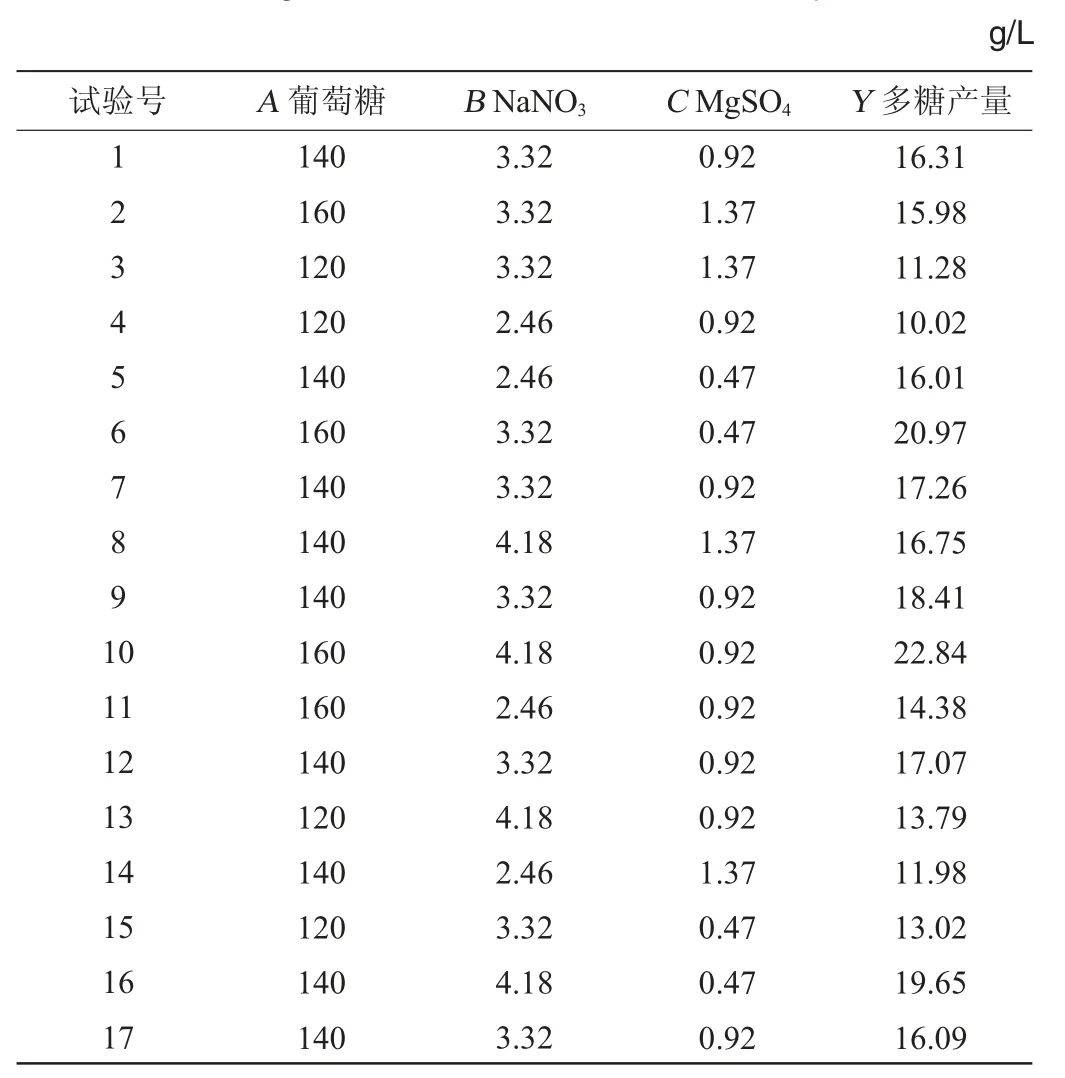
表5 Blackett-Burman试验设计及结果Table 5 Design and results of Blackett-Burman experiments
利用Design-Expert 8.0.6.1软件对表5的数据进行多元回归拟合,得到该模型的二次拟合回归方程为:
Y=17.03+3.26A+2.58B-1.71C+1.17AB-0.81AC+0.28BC-1.28A2-0.49B2-0.44C2,其中Y为多糖产量的预测值,A、B、C分别是葡萄糖、NaNO3、MgSO4质量浓度的编码水平。AB、AC、BC分别是葡萄糖和NaNO3含量、葡萄糖和MgSO4、NaNO3和MgSO4对小核菌多糖产量交互影响的编码水平,响应面试验方差分析结果见表6。
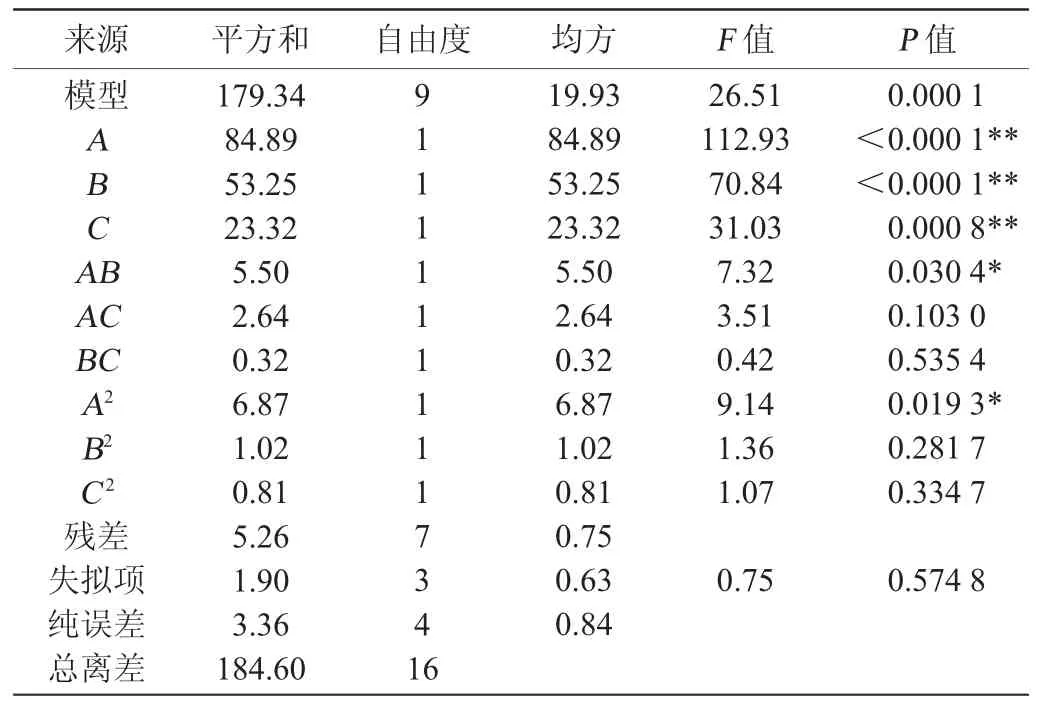
表6 Blackett-Burman试验回归分析结果Table 6 Regression analysis results of Blackett-Burman experiments
如表6所示,该模型的一次项A、B和C对结果影响显著(P<0.05),交互项AB以及二次项A2对结果影响极显著(P<0.01)。此外葡萄糖和NaNO3含量的变化对小核菌多糖产生的交互作用影响较大。该模型选取95%的置信度,二次多项式方差分析结果表明,模型极显著(P<0.01),回归结果比较理想,失拟项没有达到显著水平(P>0.05),表明非试验因素对结果影响有限,所拟合的模型可靠性很高,该模型可以用于小核菌多糖培养基优化的分析和理论预测。
除上述小核菌多糖产量预测值与真实值比对外,利用Design-Expert 8.0.6.1软件来绘制三维响应面图及对应的等高线图,将该模型中单一变量之间相互作用对小核菌多糖产量进行表征。不同影响因子之间交互作用的三维曲面图与相应的等高线图见图3。

图3 各因素交互作用对多糖产量影响的响应面和等高线Fig.3 Response surface plots and contour lines of effects of interaction between each factor on exopolysaccharide yield
2.6 最佳胞外多糖产量及模型验证
用Design-Expert 8.0.6.1软件中Box-Behnken软件对响应面模型进行典型性分析,求得的响应值理论值为23.18 g/L。此时可得发酵培养基的最优配方为葡萄糖135.96 g/L、NaNO33.80g/L、MgSO40.39g/L,胰蛋白胨6.96g/L、KCl0.5g/L、K2HPO41.34 g/L、MgSO40.39 g/L和FeSO40.017 g/L。按照实际可操作条件,将配方调整为葡萄糖136 g/L、NaNO33.8 g/L、MgSO40.4 g/L,胰蛋白胨7 g/L、KCl 0.5 g/L、K2HPO41.3 g/L和FeSO40.1 g/L。按照优化后的参数进行发酵培养,测得小核菌多糖产量实际值为(23.76±1.05)g/L,同初始培养基相比提高了54.42%,与预测值误差为2.5%,可见该模型能够较好的预测小核菌多糖的实际产值。
3 结论
通过对培养基进行优化设计试验,研究了提高齐整小核菌多糖产量的方案,依次通过单因素试验考察不同碳源、不同氮源和无机盐对于齐整小核菌产多糖培养基的影响,并通过Plackett-Burman试验设计、最陡爬坡试验和Box-Behnken试验设计等获得最优培养基配方。最终得到的小核菌多糖最优培养基配方为葡萄糖136 g/L、NaNO33.8 g/L、MgSO40.4 g/L,胰蛋白胨7 g/L、KCl 0.5 g/L、K2HPO41.3 g/L和FeSO40.1 g/L,此培养基得到的多糖产量为(23.76±1.05)g/L,相比原始培养基提高54.42%。
