肝功能异常的评估和临床处理
2021-10-18李晓芸
李晓芸 华 静
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所(200001)
肝脏是体内最大的实质性器官,不仅发挥重要的物质合成和代谢功能,同时也是机体最主要的解毒场所。肝功能试验(liver function test)为临床常规检测项目,系指通过各种生化实验方法检测与肝脏合成、代谢等功能相关的各项指标,可直接或间接反映肝脏的生理生化功能,是判断有无肝损害、评估肝病严重程度、追踪肝病进展以及判断治疗效果和预后的重要方法,对于肝胆系统疾病的诊治具有重要参考价值[1]。本文对临床常用肝功能指标在各种肝脏疾病中的变化特点和意义以及肝损伤的评估和临床处理作一概述。
一、肝功能异常的评估
肝功能异常是指由于某些致病因素导致肝脏生理生化功能发生改变,引起肝功能试验检测水平异常。肝功能检查项目主要包括血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)、γ-谷氨酰转移酶(γ-glutamyl transferase, GGT)、胆红素(bilirubin)、白蛋白(albumin)、凝血酶原时间(prothrombin time, PT)等[2]。根据不同临床意义,可将其分为以下几类:肝细胞损伤标志物、胆汁淤积标志物、胆红素代谢标志物、肝脏合成功能标志物、肝纤维化相关标志物等,通过对这些指标的综合分析,可较全面地判断肝细胞损伤、胆汁淤积和肝纤维化程度,为疾病诊断和治疗提供依据。
1.肝细胞损伤标志物:氨基转移酶简称转氨酶,是一组催化氨基酸与α-酮酸之间氨基转移反应的酶类,ALT和AST是临床应用最广泛的反映肝细胞损伤的标志物。ALT主要存在于肝细胞胞质中,是诊断肝细胞损伤最为敏感且特异的指标。作为肝脏炎症和损伤最直接的表现,ALT水平升高能灵敏地反映肝脏炎症活动性,炎症活动性强则ALT升高幅度大,反之,炎症活动性弱则ALT升高幅度小。临床上常见ALT骤然升高,往往提示肝脏存在急性炎症活动。不同于ALT,AST主要存在于肝细胞线粒体中,因此AST水平升高一般提示肝细胞损伤较为严重。除肝细胞外,AST也分布于心肌细胞和骨骼肌细胞内,因此急性心肌炎或骨骼肌损伤时也可见血清AST水平升高[3]。对于多数肝脏疾病而言,AST的升高幅度一般小于ALT,如AST升幅超过ALT且持续升高时间长,往往提示肝脏炎症损伤的慢性化和疾病进展。
生理状态下,血清ALT和AST水平通常低于40 U/L,多种致病因素引起的肝细胞损伤、坏死都会导致细胞内ALT和AST释放入血,使血清转氨酶水平升高。对血清AST、ALT和AST/ALT比值的分析有助于疾病的诊断、鉴别诊断以及病情严重程度评估。表1列举了引起血清转氨酶升高的常见肝脏疾病。重症肝炎肝衰竭时,肝细胞损伤严重,实验室检查表现为血清转氨酶水平显著降低,血清胆红素水平明显升高,即“胆-酶分离”现象,提示肝细胞破坏严重,病情凶险。因此,尽管转氨酶是反映肝细胞损害的敏感指标,但不能用于准确评估肝损害的严重程度。

表1 引起血清转氨酶升高的常见肝脏疾病
2.胆汁淤积标志物:胆汁淤积标志物主要包括ALP、GGT和5’-核苷酸酶。肝脏中ALP和GGT分布于肝细胞血窦侧、毛细胆管侧和胆管细胞微绒毛上,经胆汁排入胆道系统。胆汁排泄不畅时,毛细胆管内压力增高,诱发ALP、GGT产生和分泌增加,导致其血清水平升高。血清ALP主要来源于肝脏、骨骼和肠道,正常水平为40~110 U/L,但受性别、年龄等因素影响较大[4-5]。生理性ALP升高常见于儿童生长期和妊娠中晚期,排除生理情况以及骨骼疾病、肿瘤可能后,血清ALP明显升高主要提示肝内、外胆汁淤积相关疾病。作为胆汁淤积较特异的指标,当存在肝内、外胆汁淤积性疾病时,ALP常升高至>4×ULN[6]。图1为血清ALP升高的诊断流程。GGT在肾脏、肝脏和胰腺中含量丰富,但血清GGT主要来源于肝胆系统。GGT升高常早于其他血清酶,且持续时间长、敏感性高,常用于辅助诊断胆汁淤积性疾病以及多种类型的肝损害,如急、慢性病毒性肝炎、肝硬化、药物性肝炎、酒精性肝炎等[7]。ALP和GGT升高作为胆汁淤积早期最具特征性的血清学表现,是诊断肝内胆汁淤积的重要指标。
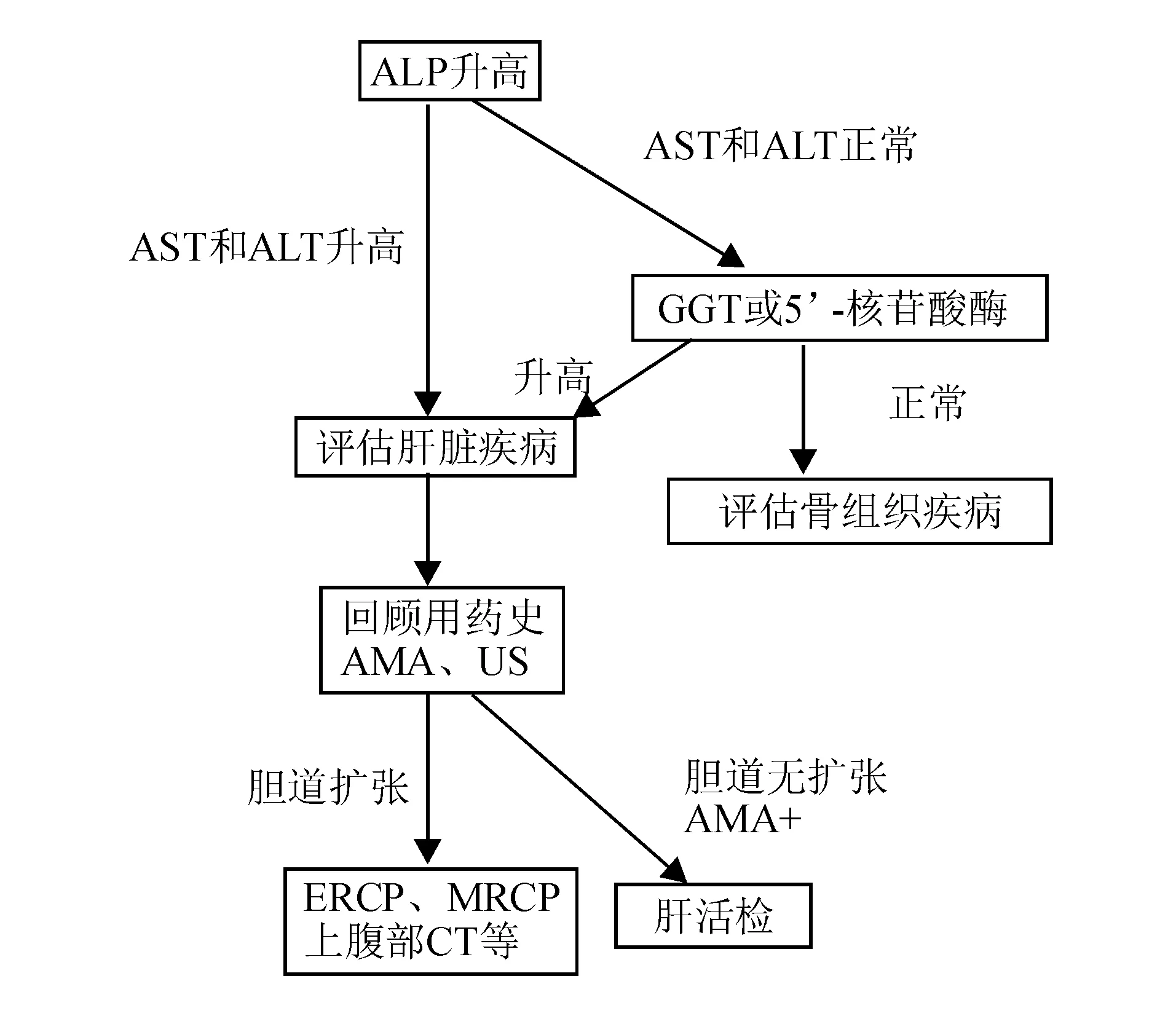
AMA:抗线粒体抗体(anti-mitochondrial antibody);US:超声检查(ultrasonography);ERCP:内镜逆行胰胆管造影(endoscopic retro-grade cholangiopancreatography);MRCP:磁共振胰胆管成像(magnetic resonance cholangiopancreatography)
3.胆红素代谢标志物:胆红素是血液循环中衰老的红细胞在肝、脾、骨髓单核吞噬细胞系统(mononuclear phagocyte system)中分解、破坏的产物。血清胆红素测定包括总胆红素(total bilirubin, TB)、结合型胆红素(conjugated bilirubin, CB)和非结合型胆红素(unconjugated bilirubin, UCB)。多种致病因素可引起血清胆红素水平升高,临床上出现黄疸症状。UCB升高主要见于溶血性疾病和多种遗传性疾病,如Gilbert综合征[8],而结合型高胆红素血症常提示肝胆疾病[9],大多数肝脏疾病患者CB和UCB均可升高。临床上通过检测血清TB、CB、UCB、尿胆红素、尿胆原等可鉴别溶血性疾病与肝胆疾病[4]。图2为孤立性血清胆红素升高的鉴别诊断流程。血清TB水平与肝脏疾病的预后相关,胆红素是终末期肝病模型(Model for End-Stage Liver Disease, MELD)中的一项重要指标,MELD评分可用于终末期肝病患者的生存预测以及肝硬化患者的手术风险评估[10]。
4.肝脏合成功能标志物:反映肝脏合成功能的指标主要包括白蛋白、前白蛋白(prealbumin)和PT[9]。肝脏是人体合成白蛋白的唯一器官,白蛋白在血浆中的半衰期约为20 d,因此其水平可反映肝脏在一定时间内的合成、储备功能[11]。在正常饮食和排除肾功能异常的前提下,白蛋白降低主要见于多种慢性肝病如终末期肝病、肝硬化等,且其降低程度与肝脏合成功能的损害程度呈正比。PT反映血液凝固时间,与肝脏产生的Ⅱ、V、Ⅶ、Ⅸ因子水平及其生物活性相关[12],是评价肝脏合成功能、储备功能、肝病严重程度和预后的重要指标。PT显著延长(与对照相比延长5 s以上),经肠外补充维生素 K不能纠正时,提示急、慢性肝病预后不良。动态监测凝血酶原活动度(prothrombin activity, PTA)有助于判断肝功能的变化,PTA迅速下降至≤40%是诊断肝衰竭的主要指标之一[13]。

DBil:直接胆红素(direct bilirubin),即CB
5.肝纤维化相关标志物:肝纤维化相关血清学标志物主要包括透明质酸(hyaluronic acid, HA)、Ⅲ型前胶原氨基端肽(procollagen type Ⅲ N-terminal peptide, PⅢNP)、Ⅳ型胶原(collagen type Ⅳ, Ⅳ-C)和层粘连蛋白(laminin, LN),均为反映肝纤维化程度的无创性指标和早期诊断纤维化的依据。HA主要由肝星状细胞(hepatic stellate cells)合成,慢性肝炎、肝纤维化、肝硬化时血清HA水平显著升高,是反映肝纤维化程度和判断预后的敏感指标。Ⅳ-C由内皮细胞分泌,正常肝脏中Ⅳ-C含量极少,LN聚集于细胞基底膜的透明层,参与调节细胞生长,随着肝脏炎症和纤维化的进展,两者的肝组织含量和血清水平逐渐升高。
尽管各项肝功能指标在肝病发展过程中各有其临床意义,但亦存在一定的局限性。一是敏感性不高,例如严重肝脏疾病如肝硬化患者的血清ALT、AST、TB水平可能正常;二是特异性较低,多种肝外因素均可导致肝功能指标异常。因此,在临床实践中,通常将多项肝功能指标组合应用以综合评估肝损伤情况,从而尽早发现潜在的肝脏疾病,实现早期诊断和早期干预治疗。图3总结了肝功能指标异常的常见临床模式分类和诊断流程。

BMI:体质指数(body mass index);INR:国际标准化比值(international normalized ratio)
二、肝功能异常的临床处理
1.肝损伤病因分析:基于肝脏内细胞损伤的类型,可将肝损伤分为肝细胞型、胆汁淤积型和混合型三种模式。肝细胞型肝损伤的主要特征为发生于肝细胞炎症和坏死基础上的血清酶学指标显著升高,以ALT和AST升高为主,常见于急、慢性病毒性肝炎、非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)、自身免疫性肝炎等;胆汁淤积型肝损伤以肝内胆汁排出受阻为特征,ALP和GGT显著升高,且升高程度大于AST和ALT,多见于胆道梗阻、肝内胆汁淤积性疾病等;混合型肝损伤则同时具备上述两者的特征,可见于出现胆汁淤积表现的病毒性肝炎、药物性肝病等。
2.肝损伤程度评估:肝损伤程度的分级评估项目主要包括急性或慢性、有无活动性以及严重程度等。血清转氨酶水平是最直接、便捷且无创的评估肝病活动性的指标,但并不能可靠地反映肝脏病变的严重程度。临床上常见慢性乙型肝炎患者血清转氨酶水平正常,但腹部B超检查发现肝脏回声增粗和脾大,提示肝脏病变呈持续性进展,这些患者通常需行肝活检以明确肝脏炎症活动性[14]。
由多项实验室指标组合而成的评分系统能更全面、客观地评估肝脏整体功能。Child-Pugh评分系对肝性脑病、腹水、胆红素、PT和白蛋白五项指标定量分段赋值和累计评分,广泛应用于肝硬化的预后评估以及肝脏肿瘤切除、肝脏介入手术的术前评估和预后预测[15]。MELD评分为前瞻性评分系统,包括INR、胆红素和血清肌酐三个无创变量,用于终末期肝病患者的生存预测、肝硬化患者的手术风险和肝移植等候患者的评估[10]。
3.肝损伤伴肝纤维化的评估:肝纤维化是指肝脏中的胶原蛋白等细胞外基质 (extracellular matrix, ECM)增生与降解失衡, 导致肝脏内纤维结缔组织异常增生、聚集的病理过程,是慢性肝病进展为肝硬化的重要中间环节。早期发现肝纤维化对于判断病情、指导治疗和评估预后具有重要意义。
目前评估肝纤维化的方法主要包括肝穿刺组织病理学检查、无创血清学检查和非侵入性影像学检查。肝脏组织病理学检查可对肝脏炎症和纤维化进行准确分级、分期,是诊断肝纤维化的金标准,但存在检查为有创性、取样局限、难以动态监测等缺点,在临床实践中的应用受限。近年来,各种无创性肝纤维化诊断和评估方法在临床上得到广泛应用,主要包括无创肝纤维化血清学标志物和非侵入性影像学检查。常见的肝纤维化血清学标志物如HA、PⅢNP、LN、基质金属蛋白酶组织抑制剂-1(tissue inhibitor of metalloproteinase-1, TIMP-1)等,可间接反映肝脏ECM沉积情况。联合多项血清学标志物建立的肝纤维化数字模型,如FibroTest、FibroSpect Ⅱ、FibroMeter等具有更高的诊断敏感性、特异性和准确性。这些血清学模型对早期肝纤维化(F0、F1期)与显著肝纤维化(F4期)有较好的鉴别作用, 对中等程度的肝纤维化(F2、F3期)鉴别作用欠佳, 因此尚不能完全满足临床全面评估肝纤维化的需求。
非侵入性影像学检查主要包括瞬时弹性成像(transient elastography, TE)、剪切波弹性成像(shear wave elastography, SWE)、声脉冲辐射力(acoustic radiation force impulse, ARFI)弹性成像和磁共振弹性成像(magnetic resonance elastography, MRE)等[16]。TE是一种无创、快速、简单的定量检测肝纤维化的方法,通过肝脏瞬时弹性图谱测量肝脏硬度值(liver stiffness measurement, LSM),进而判断肝纤维化程度。由法国Echosens公司研制的TE系统FibroScan是最早进入临床的TE技术,现已广泛应用于各种慢性肝病如病毒性肝炎、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)[17]、自身免疫性肝病[18]以及肝移植术后复发患者的肝纤维化评估。TE在临床实践中的应用也存在一些局限性,如肥胖、肋间隙狭窄、腹水等因素可影响LSM检测值,导致其对纤维化分期评估的准确性降低。表2总结了目前常用的肝纤维化和肝硬化的无创性诊断模型/方法。

表2 常用的肝纤维化和肝硬化无创性诊断模型/方法
分析肝损伤的病因、程度、判断是否存在肝纤维化及其预后对肝功能异常的规范化、系统化评估具有重要意义。对于可疑肝脏疾病患者,旨在早期识别肝损伤的临床模式类型,结合病史,综合评估多项血清学指标,灵活应用肝纤维化无创检查技术,明确肝穿刺活检指征,从而为肝功能异常的肝病患者提供个体化的诊疗方案。图4总结了针对肝功能试验检查结果异常的临床处理流程。

ANA:抗核抗体(antinuclear antibody);SMA:平滑肌抗体(smooth muscle antibody);p-ANCA:核周型抗中性粒细胞胞质抗体(perinuclear anti-neutrophil cytoplasmic antibody)
各项诊断界值主要以慢性丙型肝炎为参考
三、总结和展望
作为肝病诊疗中的重要筛查项目,肝功能试验为疾病的诊断和治疗提供了有力依据。由于引起肝功能异常的原因复杂,肝损伤的病因诊断有时较为困难,因此在临床实践中往往需结合病史、病原学、影像学检查甚至肝活检组织病理学检查等多方面的信息以获得明确诊断。相信随着临床医疗水平和科学技术的不断进步,肝功能评估体系将日益完善,在肝脏疾病的诊断和预后评估中发挥更重要的作用。
