超声引导法桡动脉置管对血管损伤并发症发生率及恢复情况的影响
2021-10-18吴豪余挺李麟殷国江谈世刚夏中元
吴豪 余挺 李麟 殷国江 谈世刚 夏中元
动脉穿刺置管监测血压作为临床常用的有创血压监测方法,多用于休克、大手术、时间较长、高龄合并有多种基础疾病以及患有心脑血管疾病需要严密监测血压的病人[1-2]。桡动脉因其位置表浅、穿刺完成后易于监测管理,为临床首选穿刺部位[3]。超声引导可视技术可提高穿刺成功率[4]。当病人存在肥胖、严重低血压、桡动脉细弱、解剖变异、桡动脉弯曲亦或桡动脉痉挛等情况时,常会导致反复穿刺而造成损伤,引起多种并发症,甚至穿刺失败。有研究表明,多次或者长时间穿刺可引起桡动脉内膜损伤、出血和血肿,并进一步导致桡动脉痉挛和狭窄,严重者可发生桡动脉闭塞[5]。超声引导和盲法桡动脉穿刺对穿刺成功率、穿刺时间、穿刺次数以及并发症的研究已有诸多文献报道[6-8]。本研究报道不同穿刺方法对桡动脉直径、远端血流量、血流量恢复的时间及程度、拔除置管后并发症的发生率的影响。
对象与方法
一、对象
2019年9月1日~2020年9月1日行桡动脉置管病人100例,年龄15~75岁,性别不限,ASAⅠ~Ⅱ级。按穿刺方法分为两组,即盲法桡动脉置管组(M组)、超声引导下桡动脉置管组(S组),每组50例。两组病人一般资料比较差异无统计学意义,有可比性,见表1。排除标准:Allen试验阳性或者可疑阳性病人;严重动脉粥样硬化、锁骨下动脉狭窄、外周血管疾病;尿毒症手部动静脉瘘;曾行介入手术从桡动脉穿刺;手部严重外伤史或曾行手术;失血性休克;严重高血压或者术中血压波动幅度过大;不合作。本研究经医院伦理委员会批准,所有病人均签署知情同意书。
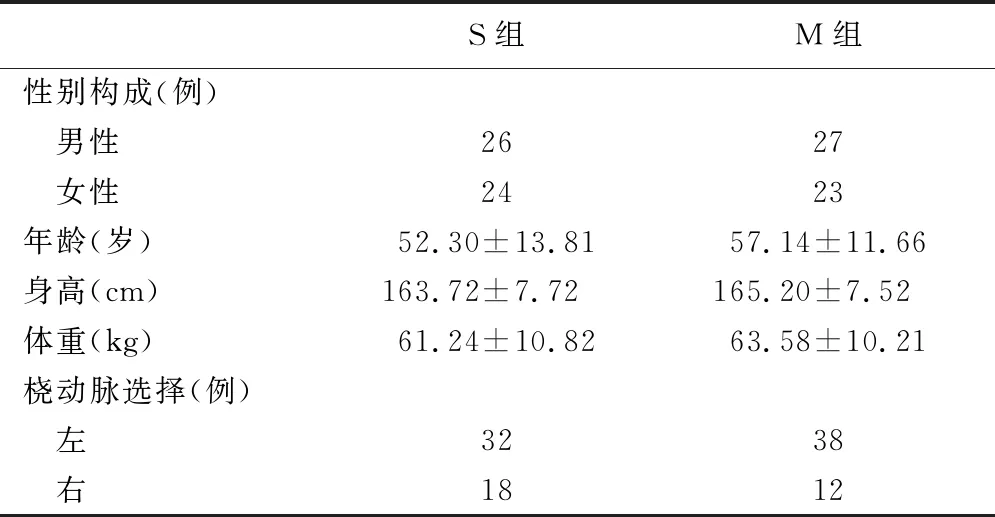
表1 两组病人一般情况比较
二、方法
1.操作前准备: 麻醉开始前评估桡动脉情况,并进行 Allen实验。两组病人均采用22G留置针进行动脉置管,穿刺点选择第二掌横纹上方1 cm处。
2.盲法桡动脉置管(M组):在第二掌横纹上方1 cm处触摸桡动脉搏动,穿刺针与皮肤呈30°~45°,沿动脉走行方向刺入桡动脉,当穿刺针见回血后放平针尾置管,在穿刺点近心端按压桡动脉阻断血流后拔除针芯,接上换能器后固定。
3.超声引导下桡动脉置管(S组):在超声引导下使用平面外方法进行动脉置管。选好穿刺部位,助手将耦合剂涂于探头表面后,操作者用一次性无菌保护套罩于探头外,并用橡皮经箍紧以固定无菌套,外涂一层活力碘,用超声探头定位桡动脉后,观察其管径、深浅、走向,将探头置于第二掌横纹上方1 cm处,在超声图像中央显示桡动脉(图1),并用多普勒模式确认动脉(图2)。定位准确后,在超声探头中线处进针,通过超声实时显像引导穿刺针进入桡动脉,确认套管针进入桡动脉并且位置良好以后,置入套管,在穿刺点近心端按压桡动脉阻断血流后拔除针芯,接上换能器后固定。
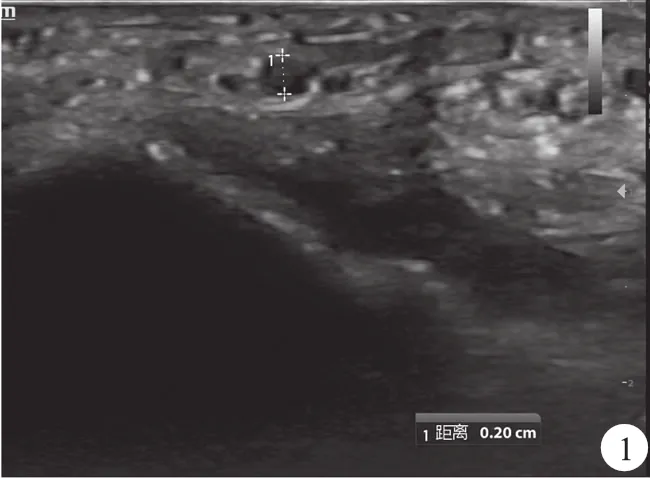
图1 超声显示桡动脉
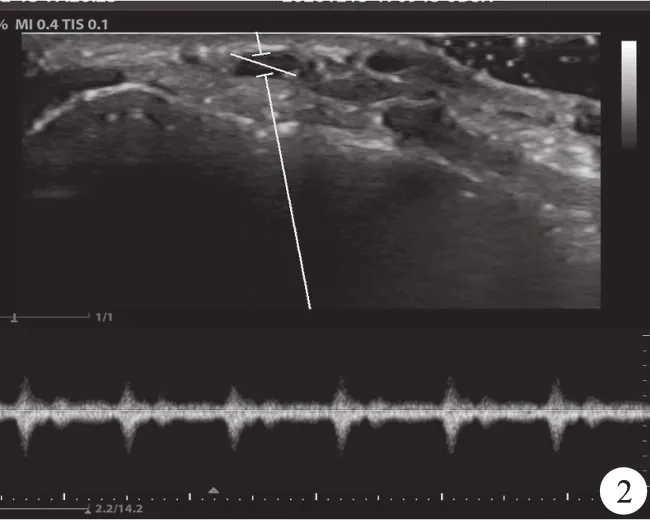
图2 多普勒模式显示桡动脉
4.观察指标:(1)使用超声探测第二掌横纹处桡动脉,选择动脉血流参数计算模式记录T1(动脉置管前)、T2(动脉置管成功后)、T3(拔除动脉置管前)、T4(拔除动脉置管后15分钟)、T5(拔除动脉置管后1小时)、T6(拔除动脉置管后2小时)、T7(拔除动脉后6小时)、T8(拔除动脉后12小时)8个时间点穿刺桡动脉血管直径(D,cm)、时间平均最大速度(TAMax,cm/s)、阻力指数(resistance index,RI)、搏动指数(pulsatility index,PI),并计算第二掌横纹处桡动脉血管横截面积(area,cm2)、血流量(flow,F);(2)比较组内和组间各时间点血管直径(D)、血流量(F)、阻力指数(RI)、搏动指数(PI)的变化以及恢复情况;(3)记录动脉拔管后血肿、血管痉挛、肢体疼痛、感觉异常等并发症的发生率。桡动脉血管横截面积=(D/2)2,单位cm2。血流量F=时间平均最大速度TAMax×血管横切面面积×60 s。
三、统计学方法
结果
两组病人桡动脉血管D、TAMax、桡动脉远端F、RI、PI的变化以及恢复情况:组内比较,与T1时相比,两组病人D在T2时减少,T3时逐渐恢复,T4~T5时再度减少,T6时恢复正常;F在T2时减少,T3时逐渐恢复,T4时再度减少,T5~T8时逐渐恢复,两组病人RI和PI则是在T2升高,T3下降,T4明显升高,T5~T8逐渐下降;S组F、RI、PI在T8时恢复至T1水平(P>0.05),M组F、RI、PI在T8尚未恢复至T1水平(P<0.05);组间比较,T1时两组病人D、F、RI、PI无明显差异(P>0.05),与M组比较,在T2~T5时,S组的D大于M组(P<0.05),在T2~T8时F大于M组P<0.05),RI及PI低于M组(P<0.05)。见表2。

表2 两组病人不同时间点D、TAMax、F、RI、PI比较
S组发生血肿、肢体疼痛、感觉异常并发症3例(6%),M组发生上述并发症10例(20%),两组比较差异有统计学意义(P<0.05)。
讨论
有创血压监测在指导手术、重症、急诊处理中有着不可替代的作用[9-10]。一般情况下,桡动脉手部位置浅表,侧支循环丰富且成功置管后方便管理,是动脉置管的首选部位[11]。传统动脉置管采用触摸穿刺法,无论是动脉与穿刺针位置关系,还是进针深度还是角度,操作者只能依据个人经验及手感判断,由于桡动脉解剖存在变异、桡动脉搏动强度因人的血压而异、外周血管疾病影响或者病人过度肥胖易导致触摸不准确,穿刺存在一定难度。反复穿刺,可能导致血管损伤、局部血肿、血管痉挛,出现穿刺后手部疼痛、感觉异常等并发症[12-14]。超声技术引导下的穿刺置管可以为操作者提供有效的指导[15-17],能准确显示桡动脉周围结构、血管走向以及是否存在解剖变异情况,穿刺过程中根据超声显像对穿刺针的方向、深度以及角度予以引导,使操作更加精准。超声引导在临床应用中的优势已被证实,并推荐超声引导法替代传统盲法[18]。本研究将病人穿刺后桡动脉的血管内径、远端血流量的变化以及穿刺损伤后血流指标恢复的时间和恢复质量纳入比较范围,在超声下测量血管D、TAMax、RI、PI、F以及拔除动脉置管后并发症的发生率作为两种方法的评价指标[19-20],以提供确切的临床依据。
在本研究中,组内比较,与T1时相比,两组病人D在T2时减少,T3时逐渐恢复,T4~T5时再度减少,T6时恢复正常,F在T2时减少,T3时逐渐恢复,T4时再度减少,T5~T8时逐渐恢复,表明动脉穿刺、置管保留以及拔除动脉置管压迫都对D和F产生了明显的影响,在T4时D和F减少比T2更严重,这可能是动脉置管拔管作为二次损伤和压迫止血引起的改变,这提示我们更应该关注二次损伤的严重性,而且F恢复正常比D的恢复更晚,表明血流的恢复速度是延迟于血管直径的,血管直径变窄血流量减少,血管直径恢复血流量并不一定恢复,因此我们认为血管直径作为外周血管血流动力学参数指标之一的准确性值得商榷;两组病人RI和PI则是在T2升高,T3回降,T4明显升高,T5~T8逐渐回降,S组F、RI、PI在T8时恢复至T1水平,M组F、RI、PI在T8尚未恢复至T1水平,RI和PI均为反映血管床阻力的指标,可以反应组织血流灌注情况,其值越低,血流灌注越好,数据表明随着侵入性桡动脉穿刺开始,桡动脉RI、PI间接表现出的血流变化和F的变化以及恢复具有一致性,可以更好的反应血流灌注。组间比较,T1时两组病人D、F、RI、PI无明显差异,与M组比较,在T2~T5时,S组的D大于M组,在T2~T8时F均大于M组,阻力指数及搏动指数均低于M组,表明超声引导法对D和F的影响明显小于盲法,并且各项血流参数恢复的更早,同时S组桡动脉拔管后血管损伤相关并发症更低,从而更加印证了超声引导法较盲法桡动脉穿刺在临床操作中具有更好的优越性。
综上,超声引导法较盲法桡动穿刺脉置管对桡动脉损伤小、穿刺点远端血流影响小,并发症发生率减少,且损伤恢复快。
