木薯MeHSF10基因克隆及表达分析
2021-10-16曾坚张燕秋陈丽萍吴春来胡伟
曾坚 张燕秋 陈丽萍 吴春来 胡伟


摘 要:熱激转录因子(heat shock transcription factor,HSF)是植物中重要的逆境调控因子。许多研究表明HSF可通过对信号通路下游的逆境相关基因进行调控而提高植物适应逆境的能力,如提高植株在干旱和氧化损伤等逆境中的耐受能力。为研究HSF在木薯抗逆和采后储存中的功能,该研究以木薯品种SC124为材料,通过RT-PCR技术从木薯叶片克隆得到一个木薯HSF家族基因,将其命名为MeHSF10。结果表明:(1)该基因全长为1 098 bp,编码365个氨基酸残基,蛋白质相对分子量为40.7 kD,理论等电点为8.15,蛋白的亚细胞定位预测为细胞核。蛋白质序列分析结果表明MeHSF10与麻风树JcHSF和橡胶树HbHSF的相似性最高,分别为80.31%和90.54%。MeHSF10基因的蛋白序列含有HSF蛋白家族的保守结构域,如DBD、HR-A Core、HR-B Core、插入序列和核定位信号 (nuclear localization signal,NLS),表明MeHSF10基因编码的蛋白质属于HSFC家族成员。(2)为分析MeHSF10基因在木薯不同组织中的表达情况,对该基因在木薯11个组织中的表达进行分析,结果表明MeHSF10基因在木薯所有组织中都有表达,在叶片中的表达最高。(3)MeHSF10基因的启动子序列元件分析结果显示其含有脱落酸(abscisci acid,ABA)响应(ABA responsive motif)、干旱诱导 (drought-induced motif)和光响应 (light-responsive motif)等元件。(4)表达分析结果也表明,MeHSF10基因能被干旱和ABA处理显著诱导,MeHSF10基因在木薯块茎的采后生理性变质过程中也被显著诱导表达。综上结果表明,MeHSF10基因可能在转录水平参与ABA介导的木薯干旱胁迫响应和木薯块茎的采后生理性变质,这为进一步研究其在木薯抗逆和采后储存中的功能奠定基础。
关键词:热激转录因子,MeHSF10,非生物胁迫,采后生理性变质(PPD),表达分析
中图分类号:Q943
文献标识码:A
文章编号:1000-3142(2021)09-1576-09
Abstract:Heat shock transcription factor (HSF)is a key adverse regulatory factor in plants. Many studies have shown that HSFs can partake in the downstream of signal transduction pathways and regulate genes expression responsive for a variety of abiotic/biotic stresses,to improve the tolerance to high salinity and oxidative stress in plants. In order to analyze the function of HSF in stress tolerance and post-harvest storage of Manihot esculenta,M. esculenta cv. SC124 was used as cloning material. In this study,a HSF gene designated MeHSF10 was isolated from M. esculenta leaves through RT-PCR method. The results were as follows:(1)The full-length cDNA of MeHSF10 was 1 098 bp,encoded a polypeptide of 365 amino acid residues with a predicted relative molecular mass of 40.7 kD and an isoelectric point of 8.15. Subcellular localization of MeHSF10 was predicted as nuclear localization. Multiple protein sequence alignment showed that MeHSF10 shared a significant degree of sequence similarity with other HSF proteins in Jatropha curcas (80.31 %)and Hevea brasiliensis (90.54 %). The protein sequence of MeHSF10 contained conserved motifs of the HSF family,such as DNA Binding Domain (DBD),HR-A Core,HR-B Core,insert sequence,and nuclear localization sequence signal (NLS),these results suggested that MeHSF10 isolated from M. esculenta was a genuine member of the HSFC family. (2)In order to analyze the expression profiles of MeHSF10 gene in M. esculenta,the expression data of eleven M. esculenta tissues/organ types were analyzed,and the result showed that MeHSF10 gene expressed in all eleven M. esculenta tissues,and the highest expression of MeHSF10 was in leaf. (3)Results of promoter element analysis revealed that MeHSF10 contained drought-induced motif (MBS),ABA responsive motif (ABRE),and several light-responsive motifs. (4)The transcriptome data results also showed that MeHSF10 was upregulated by drought stress and ABA treatment. The expression of MeHSF10 was also induced in M. esculenta post-harvest physiological deterioration (PPD)process. All the above results indicate that MeHSF10 may be involved in ABA mediated drought stress response,and that MeHSF10 is also related with PPD and may operate mainly through ROS-regulated gene networks. Therefore,these results offered critical basic knowledge for future gene function analysis of MeHSF10 in stress tolerance and post-harvest storage of Manihot esculenta.
Key words:heat shock transcription factor (HSF),MeHSF10,abiotic stress,post-harvest physiological deterioration (PPD),expression analysis
植物在漫长的进化过程中已经进化出了应对各种逆境的抵御机制 (Ohama et al.,2017)。研究结果表明,热休克反应在植物响应非生物胁迫过程中具有重要作用,热激转录因子(heat shock transcription factor,HSF)是其中重要的调控因子,HSF可通过对信号通路下游的逆境相关基因进行调控而提高植物适应逆境的能力。HSF能够提高植株在热、干旱和氧化损伤等逆境中的耐受能力,在植物应对非生物胁迫过程中具有非常重要的作用(Guo et al.,2016; Jiang et al.,2018; Zhou et al.,2018)。HSF还能够提高植物适应不同非生物胁迫的能力,如TaHSFA4a可提高水稻在重金属环境中的生存能力 (Shim et al.,2009);SlHsfA1可提高番茄在高温环境的生存能力 (Scharf et al.,2012);CarHsfB2可提高拟南芥在干旱环境中的生存能力(Hao et al.,2016);AtHSFA6a和AtHSFA6b也可提高拟南芥在高盐和低温环境中的生存能力;AtHSFA2可提高拟南芥在高渗、高盐和高氧化水平环境中的生存能力(Miller & Mittler,2006; Banti et al.,2010)。因此,不同物种的HSF基因均能提高不同植株应对不同逆境胁迫的能力。
木薯(Manihot esculenta)是广泛种植于热带及亚热带地区的重要粮食作物。在我国,木薯种植面积5.0×105 hm2,年产量约1.0×1010 kg,年产值超过140亿元,是我国热带和亚热带地区一种重要的经济作物 (张鹏等,2014)。木薯是我国和世界上具有巨大发展潜力的能源植物,可用于生产工业淀粉,燃料乙醇,生物基材料(张鹏等,2014;Hu et al.,2016;颜彦等,2018)。木薯本身拥有较好的抗旱和耐贫瘠等特点,随着绿色能源需求的不断增加,木薯作为生物质能源的潜力越来越被重视。此外,木薯塊根采后易出现“采后生理性变质”(post-harvest physiological deterioration,PPD),导致其储藏期时间短,严重影响了其在工业生产中的开发利用(Zidenga et al.,2012;张振文和李开绵,2012;Xu et al.,2013)。目前,关于HSF基因在木薯中的功能研究还鲜有报道 (Wei et al.,2018,Yu et al.,2019)。因此,克隆木薯HSF相关基因并进行表达分析,对深入研究其在木薯抗逆过程和PPD过程中的表达调控作用具有重要意义。本研究利用前期木薯转录组数据,通过PCR技术克隆到一个热激转录因子MeHSF10基因,并对其编码蛋白序列、保守结构域和进化关系进行初步分析,同时,也对MeHSF10在干旱胁迫、ABA处理和PPD过程中的表达模式进行分析,为研究MeHSF10基因功能及抗逆分子机理提供参考。
1 材料与方法
1.1 材料
本研究选用的木薯材料为SC124品种(Manihot esculenta cv. SC124),由中国热带农业科学院热带生物技术研究所保存。植物RNA提取试剂盒(货号:DP437)购自天根生化科技有限公司,cDNA反转录试剂盒(货号:K1622)购自Fermentas 公司。PCR引物由上海生工生物工程股份有限公司合成。
1.2 材料处理
将木薯茎秆切成合适长度的小节(包含3~4个芽点),将其种入蛭石和营养土比例为1∶1(V/V)的基质中生长。待生长约60 d后,选取生长状况一致的木薯幼苗作为后续实验材料。采用20%(W/V)PEG-6000进行干旱模拟处理,对照植株浇灌水,在处理0、3、5、7 d后采集木薯叶片样品用液氮速冻后放入超低温冰箱保存;使用100 μmol·L-1 ABA进行浇灌,在处理0、3、5、7 d后采集木薯叶片样品用液氮速冻后放入超低温冰箱保存;取生育期10个月的木薯块根,置于25 ℃、70% 相对湿度的培养箱内进行暗培养,分别在0、6、12、48 h取样,采集的木薯样品用液氮速冻后放入超低温冰箱保存,每个样品设3次生物学重复。
1.3 基因克隆
分别使用RNA 提取试剂盒和反转录试剂盒进行RNA提取和反转录。根据木薯同源序列(Manes.02G087400.1)设计引物 (P1:5′-ATGAGCAAAAAAGAAAAAAAAG-3′; P2:5′-CTAAAAGCCACCACCTAAAAGCG-3′),以木薯叶片cDNA为模板进行MeHSF10基因扩增。扩增产物连接至pMD-18T载体,转化大肠杆菌并挑选阳性单克隆进行测序。
1.4 生物信息学分析
使用NCBI中的BLASTp搜索其他物种中和MeHSF10同源的蛋白质序列;使用Plant-mPLoc软件预测亚细胞定位;使用NCBI-CDD数据库预测保守结构域;通过ExPASy ProtParam计算蛋白质的理论等电点和相对分子质量;采用DNAMAN6软件进行序列比对;利用MEGAX中的Neighbor-Joining (NJ)法构建进化树;采用Primer 5.0软件设计引物;利用Plantcare进行启动子元件分析 (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)。
1.5 基因的表达分析
将相应处理的样品提取RNA,建库并测序,这部分工作由上海美吉生物技术有限公司完成。测序平台是Illumina GAII (Illumina,San Diego,CA,USA)。使用FASTX-toolkit (http://hannonlab.cshl.edu/fastx_toolkit/)移除接头序列和低质量序列;利用Tophat 2.0 (Trapnell and Pachter LSalzberg,2009)软件将clean reads和木薯基因组参考序列 (version 4.1)进行比对,将比对结果用Cufflinks (Trapnell et al.,2012)来组装转录组数据,转录本至少存在于两个样本中才保留。ABA处理、聚乙二醇(polyethylene glycol,PEG)处理和PPD过程中的基因表达水平使用FPKM (Fragments per kilobase per million mapped reads)表示。
2 结果与分析
2.1 MeHSF10基因的克隆
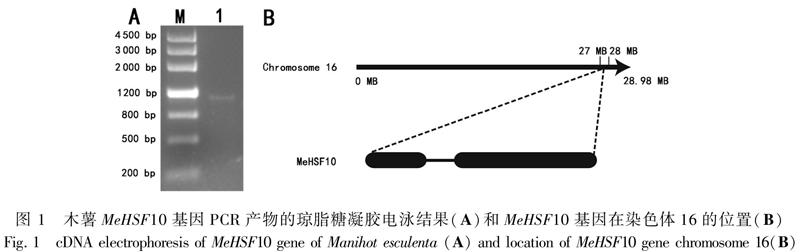
利用拟南芥AtHSF8基因 (登录号:AT3G24520)的蛋白质序列为参考序列,在Phytozome数据库中进行BLASTp比对搜索,得到了一个和木薯相似性较高的基因序列(Manes.16G116200.1)。根据该基因设计引物后进行扩增,对目的基因进行测序后得到一个全长为1 098 bp的片段(图1),编码365个氨基酸,将其命名为MeHSF10基因。MeHSF10基因和参考序列之间存在1个碱基差异,属于同义突变(图2)。MeHSF10基因序列含有1个内含子和2个外显子。MeHSF10蛋白的分子式预测为C1790H2849N501O551S17,相对分子量40.7 kD,理论等电点为8.15,不稳定系数为60.57,属于不稳定蛋白。蛋白的亚细胞定位预测为细胞核。蛋白保守结构域分析显示MeHSF10包含有HSF家族结构域(图3),进一步证明克隆得到的基因为木薯HSF基因。
2.2 MeHSF10氨基酸序列同源性比对和系统发育分析
在NCBI数据库中使用MeHSF10基因的蛋白质序列为探针,进行Blast搜索,下载同源性较高的序列,其中与橡胶树 (XP_021643078.1)和麻风树 (XP_020535025.1)的氨基酸序列相似性最高,分别为90.54%和80.31%。多重序列比对结果显示,MeHSF10基因的蛋白序列含有HSF蛋白家族的保守结构域(图4)。在N端6~100氨基酸残基位置含有高度保守的DNA Binding Domain (DBD),在N端170~210氨基酸残基位置含有HR-A Core、HR-B Core和插入序列,在N端227~242氨基酸残基位置含有核定位信号 (nuclear localization signal,NLS),这些结果表明MeHSF10基因编码的蛋白质属于HSFC家族成员。系统发育分析结果显示,木薯MeHSF10和橡胶树的HbHSF聚在一起,氨基酸序列一致性最高(图5)。
2.3 MeHSF10 基因的组织表达分析
本研究通过下载得到木薯11个没有经过任何处理的组织的表达数据进行研究MeHSF10基因在木薯不同组织中的表达变化情况 (shiny.danforthcenter.org/cassava_atlas/)。它们分别是叶(L),中脉(M),叶柄(P),茎(S),侧芽(LB),顶端分生组织(SAM),根(SR),须根(FR),根顶端分生组织(RAM),分化胚组织(OES),松散性胚性愈伤组织(FEC)。结果显示MeHSF10基因在不同组织中的表达水平不一样,在叶片中的表达水平最高,在分化程度较低的组织FES、RAM和SAM中的表达水平较低(图6)。
2.4 MeHSF10基因在不同胁迫条件下的表达分析
根据基因组数据,通过对MeHSF10基因起始密码子上游1 500 bp的序列进行启动子元件分析,结果表明启动子中包含1个干旱诱导元件MBS、3个ABA响应元件ABRE (表1)。因此,在ABA处理和模拟干旱胁迫下对MeHSF10基因的表达水平进行分析。结果表明MeHSF10基因在ABA处理下表达上调,在模拟干旱胁迫下表达也上调,分别最高提高了2.3倍和2.4倍(图7)。
为研究MeHSF10基因与木薯块根采后生理性变质(PPD)过程之间的关系,对MeHSF10基因在木薯采后生理性变质过程中的表达水平进行了分析。结果显示在采后生理性变质过程中MeHSF10基因的表达明显受到诱导,在6 h时没有显著变化;而12 h时达到最高水平,提高了约4.3倍;48 h后表达水平下降,但仍然高于0 h (图8)。
3 讨论与结论
热激转录因子在自然界中有多个基因家族成员,它们含有不同的保守结构域,如DNA结合功能域(DNA binding domain,DBD)、寡聚化功能域(oligomerization domain,OD)、核定位信号(nuclear localization singal,NLS)等。根据保守结构域OD的特点可以分为HSFA、HSFB和HSFC三个家族 (Guo et al.,2016)。不同植物中拥有不一样的HSF家族数量,例如:拟南芥中有21个,水稻中25个,玉米中25个,小麦中则超过56个。这些植物中都含有HSF基因家族的保守结构域,并有其相关功能研究(Guo et al.,2008;Mittal et al.,2009; Lin et al.,2011;Scharf et al.,2012;Xue et al.,2014),而关于木薯的报道较少。本研究分离的MeHSF10基因序列全长为1 098 bp,编码365个氨基酸。序列分析表明,该基因含有HSFC家族的保守结构域 (李菲等,2017),系统发育分析结果显示MeHSF10与橡胶树HbHSF和麻风树JcHSF的亲缘关系较近。
HSF基因在所有的水稻组织中都有表达,而HSF9则只在向日葵和拟南芥的種子中表达(Almoguera et al.,2002;Scharf et al.,2012),番茄花粉组织中的HSFA2相比其他花组织表现出更高的表达 (Guo et al.,2016)。因此,不同HSF基因会由于功能的差异在不同植物的不同组织中呈现出不同的表达水平。MeHSF10基因的启动子序列分析结果显示其含有大量的光诱导元件,而MeHSF10在叶片中的表达水平最高,因而推测该基因可能与叶片中的光合作用相关。
启动子是基因表达调控的重要元件,MeHSF10基因的启动子序列分析结果显示其含有干旱诱导相关元件MBS和ABRE元件。因此,本研究分别对木薯进行干旱和ABA处理,结果表明MeHSF10基因的表达明显受到干旱胁迫和ABA处理的诱导。在拟南芥中,AtHsfA9通过ABA信号通路提高植株应对干旱胁迫的能力 (Guo et al.,2008),过表达AtHSFA2和AtHSFA8基因可提高拟南芥植株对盐和渗透胁迫的适应能力;过表达OsHSF29和OsHSF17基因可以提高水稻植株对盐和渗透胁迫的适应能力 (Jin et al.,2013)。因此,推测MeHSF10可能通过依赖于ABA信号通路的途径来响应干旱胁迫,但具体是哪些基因参与了MeHSF10介导的分子调控仍不清楚。MeHSF10在木薯生理性变质过程中的高表达则表明,该基因可能和木薯块茎的生理性变质相关。研究报告指出HSF和植物应对氧化胁迫密切相关,在水稻中OsHsfC2a和OsHsfA5是植株ROS感知和含量积累的重要基因(Miller et al.,2008; Mittal et al.,2009)。在烟草中,过表达胡杨PeHSF基因则通过调节叶片中的ROS平衡提高烟草应对非生物逆境胁迫的能力 (Shen et al.,2013)。因此,推测MeHSF10可能和氧化胁迫相关,进而影响木薯块茎的生理性变质。但MeHSF10基因如何参与木薯块茎的生理性变质仍不清楚。因此,对这些结果的进一步研究将有可能为木薯的抗逆和延缓生理性变质提供理论参考。下一步将通过对基因功能的研究来验证该基因在木薯抗旱和延缓生理性变质中的作用。
参考文献:
ALMOGUERA C,ROJAS A,DIAZ-MARTIN J,et al.,2002. A seed-specific heat-shock transcription factor involved in developmental regulation during embryogenesis in sunflower[J]. J Biol Chem,277(46):43866-43872.
BANTI V,MAFESSONI F,LORETI E,et al.,2010. The heat-inducible transcription factor hsfa2 enhances anoxia tolerance in Arabidopsis [J]. Plant Physiol,152(3):1471-1483.
HU W,KONG H,GUO YL,et al.,2016. Comparative physiological and transcriptomic analyses reveal the actions of melatonin in the delay of postharvest physiological deterioration of cassava[J]. Front Plant Sci,7:736.
GUO JK,WU J,JI Q,et al.,2008. Genome-wide analysis of heat shock transcription factor families in rice and Arabidopsis[J]. J Genet Genom,35(2):105-118.
GUO M,LIU JH,MA X,et al.,2016. The plant heat stress transcription factors (HSFs):Structure,regulation,and function in response to abiotic stresses[J]. Front Plant Sci,7:114.
HAO M,WANG C,YANG B,et al.,2016.CarHSFB2,a class B heat shock transcription factor,is involved in different developmental processes and various stress responses in Chickpea (Cicer arietinum L.)[J]. Plant Mol Biol Rep,34(1): 1-14.
JIANG Y,ZHENG QQ,CHEN L,et al.,2017. Ectopic overexpression of maizeheat shock transcription factor gene ZmHsf04 confers increased thermo and salt-stress tolerance in transgenic Arabidopsis[J]. Acta Physiol Plant,40(1):1-12:76/DOI:10.1186/1471-2164-12-76.
JIN GH,GHO HJ,JUNG KH,2013. A systematic view of rice heat shock transcription factor family using phylogenomic analysis[J]. J Plant Physiol,170(3):321-329.
MILLER G,SHULAEV V,MITTLER R,2008. Reactive oxygen signaling and abiotic stress[J]. Physiol Plant,133(3): 481-489.
MILLER G,MITTLER R,2006. Could heat shock transcription factors function as hydrogen peroxide sensors in plants?[J]. Ann Bot-London,98(2):279-288.
MITTAL D,CHAKRABARTI S,SARKAR A,et al.,2009. Heat shock factor gene family in rice:genomic organization and transcript expression profiling in response to high temperature,low temperature and oxidative stresses[J]. Plant Physiol Biochem,47(9):785-795.
LI F,HE XH,ZHANG XM,et al.,2017. Screening and functional analysis of Heat Shock Factor (HSF)family in Medicago truncatula and Medicago lupulina L.[J]. Mol Plant Breed,15(7),2517-2524.[李菲,何小紅,张习敏,等,2017. 蒺藜苜蓿和天蓝苜蓿热激因子(HSF)家族的筛选与功能分析[J]. 分子植物育种,15(7):48-55.]
LIN YX,JIANG HY,CHU ZX,et al.,2011. Genome-wide identification,classification and analysis of heat shock transcription factor family in maize[J]. BMC Genomics,12
OHAMA N,SATO H,SHINOZAKI K,et al.,2017. Transcriptional regulatory network of plant heat stress response[J]. Trends Plant Sci,22(1):53-65.
SCHARF KD,BERBERICH T,EBERSBERGER I,et al.,2012. The plant heat stress transcription factor (Hsf)family:Structure,function and evolution[J]. BBA-Gene Regul Mech,1819(2):104-119.
SHEN Z,DING M,JIAN S,et al.,2013. Overexpression of PeHSF mediates leaf ROS homeostasis in transgenic tobacco lines grown under salt stress conditions[J]. Plant Cell Tiss Org,115(3):299-308.
SHIM D,HWANG JU,LEE J,et al.,2009. Orthologs of the class a4 heat shock transcription factor HsfA4a confer cadmium tolerance in wheat and rice[J]. Plant Cell,21(12): 4031-4043.
TRAPNELL C,PACHTER LSALZBERG SL,2009. TopHat:discovering splice junctions with RNA-Seq[J]. Bioinformatics,25:1105-1111.
TRAPNELL C,ROBERTS A,GOFF L,et al.,2012. Differential gene and transcript expression analysis of RNA-seq experiments with TopHat and Cufflinks[J]. Nat Protoc,7:562-578.
WEI YX,LIU GY,CHANG YL,et al.,2018. Heat shock transcription factor 3 regulates plant immune response through modulation of salicylic acid accumulation and signalling in cassava[J]. Mol Plant Pathol,19(10):2209-2220.
XU J,DUAN XG,YANG J,et al.,2013. Enhanced reactive oxygen species scavenging by overproduction of superoxide dismutase and catalase delays postharvest physiological deterioration of cassava storage roots[J]. Plant Physiol,161(3): 1517-1528.
XUE GP,SADAT S,DRENTH J,et al.,2014. The heat shock factor family from Triticum aestivum in response to heat and other major abiotic stresses and their role in regulation of heat shock protein genes[J]. J Exp Bot,65(2):539-557.
YAN Y,TIE WW,DING ZH,et al.,2018. Cloning and expression analysis of MePYL8 gene in cassava[J]. Mol Plant Breed,16(14):4498-4504.[颜彦,铁韦韦,丁泽红,等,2018. 木薯MePYL8基因克隆及表达分析[J]. 分子植物育种,16(14):4498-4504.]
YU XY,YAO Y,HONG YH,et al.,2019. Differential expression of the Hsf family in cassava under biotic and abiotic stresses[J]. Genome,62(8):563-569.
ZHANG P,YANG J,ZHOU WZ,et al.,2014. Progress and perspective of cassava molecular breeding for bioenergy development[J]. Chin Bull Life Sci,26(5):465-473.[张鹏,杨俊,周文智,等,2014. 能源木薯高淀粉抗逆分子育种研究进展与展望[J]. 生命科学,26(5):465-473.]
ZHANG ZW,LI KM,2012. Review on postharvest deterioration and methods of storage for cassava tuberous root[J]. Chin J Trop Crops,33(7):1326-1331.[张振文,李开绵,2012. 木薯块根采后腐烂及贮藏方法研究进展[J]. 热带作物学报,33(7):1326-1331.]
ZHOU J,XU X,CAO JJ,et al.,2018. HsfA1a is essential for Mi-1.2-mediated resistance to Meloidogyne incognita,and regulates Wfi1 transcription and H2O2 production[J]. Plant Physiol,176(3):2456-2471.
ZIDENGA T,LEYVA-GUERRERO E,MOON H,et al.,2012. Extending cassava root shelf life via reduction of reactive oxygen species production[J]. Plant Physiol,159(4): 1396-1407.
(責任编辑 李 莉)
