紫檀芪通过PI3K/Akt通路对脓毒症大鼠膈肌的保护作用
2021-10-16曾海平吴东方胡云双
曾海平,吴东方,胡云双
1.温州市中西医结合医院 检验科,浙江 温州 325000;2.温州医科大学 检验医学院 生命科学学院,浙江 温州 325035
脓毒症是由严重感染引起的以多器官功能障碍为主要特征的临床综合征,常伴有急性呼吸衰竭,其中呼吸肌无力是重要因素。膈肌作为主要的呼吸肌,膈肌功能障碍可严重损害呼吸泵,进而导致患者长期依赖呼吸机、ICU住院时间延长、呼吸衰竭甚至死亡[1]。目前脓毒症的病理生理机制尚未完全阐明,在脓毒症早期触发的炎症反应中释放大量促炎细胞因子,如TNF-α、IL和PG等,在脓毒症诱导的膈肌功能障碍中起着重要作用[2]。紫檀芪(pterostilbene,PTS)是一种与白藜芦醇结构类似的抗毒性物质,主要存在于蓝莓、葡萄和花生等植物中。近年来有研究表明,PTS具有多种生物活性,包括抗炎、抗氧化、抗衰老和抗病毒活性等[3]。此外,PTS还能介导细胞周期、凋亡和增殖[4]。然而,PTS在脓毒症中的作用,尤其是在脓毒症导致膈肌功能障碍中的作用鲜见报道。本研究拟探讨PTS在脓毒症致大鼠膈肌损伤中的作用,并探讨其可能作用机制。
1 材料和方法
1.1 实验动物及材料 6~8周龄健康雄性Wistar大鼠,体质量180~250 g,购自中国科学院上海实验动物中心,动物在无病原体的条件下饲养于温州医科大学实验动物中心,大鼠可以自由获取食物和水,并在室温和50%~65%相对湿度下保持12 h的光/暗循环。PTS(纯度99%)购自上海义森生物科技有限公司;AChE测定试剂盒购自南京建成生物工程研究所;IL-1β、TNF-α、IL-6、MPO测定试剂盒(ELISA)购自美国Pierce公司;AST、LDH、CK测定试剂盒购自美国Abcam公司;凋亡检测试剂盒(C1088)购自上海碧云天生物技术有限公司;ProteoPrep总蛋白提取试剂盒购自美国Sigma公司;t-Akt、p-Akt、t-PI3K、p-PI3K和β-actin抗体购自美国Epitomics公司。
1.2 脓毒症模型及分组 大鼠按随机数字表法分成3组(每组10只):假手术组、脓毒症组和PTS组。脓毒症组和PTS组大鼠均行盲肠结扎穿刺术诱导盲肠坏死脓毒症模型[5]。大鼠禁食12 h后腹腔注射1%戊巴比妥钠(50 mg/kg)用于手术前麻醉,常规消毒后沿腹中线做2 cm切口,在盲肠总长度一半的距离处,用18号注射针头在肠系膜缘和系膜对侧缘方向各穿孔1次,然后轻轻按压盲肠,肠内容物被轻轻压入腹腔,恢复盲肠正常解剖部位,逐层缝合切口,立即皮下注射无菌0.9%氯化钠溶液(3 mL/100 g)以补偿体液流失。假手术组大鼠进腹定位盲肠后,不穿孔盲肠。
手术前30 min,PTS组大鼠接受PTS腹腔注射(25 mg/kg)1次,假手术组和脓毒症组大鼠腹腔注射等量的无菌0.9%氯化钠溶液,24 h后通过腹腔注射戊巴比妥对所有存活大鼠实施安乐死,随后从左侧膈肌中部采集5 mm宽膈肌,立即测量膈肌收缩力,进行下一步检测。
1.3 膈肌收缩性能测定 将膈肌条垂直悬挂在 37 ℃的Krebs组织液中,将2 个银电极平行放置在肌条上,并连接到电刺激器(ALC-MPA2000-S,Alcott Biotech)。经过15 min的热平衡期后,确定肌条产生最大收缩力的最佳长度(L0),然后将刺激强度设置为电压强度的120%,当L0达到最大收缩反应时调整电压强度,以确保阈上刺激。分别使用10、20、40、60、80和120 Hz频率电刺激膈肌条。疲劳指数(fatigue index,FI):给予肌条刺激频率40 Hz,刺激电压15 V,刺激时间330 ms,串间隔670 ms的刺激,共计300串刺激,计算第120个肌颤搐与第1个肌颤搐的比值,即FI。
1.4 组织病理学观察及膈肌损伤评分(diaphragm damage score,DDS)采集的膈肌组织用4%中性甲醛固定,对每个组织样本进行石蜡包埋,5 μm切片后使用苏木精/伊红染色,乙醇梯度脱水封闭后进行组织病理学观察。膈肌损伤的严重程度根据半定量量表进行评估和分级,包括水肿、中性粒细胞浸润、出血和肌原纤维分布[6]。由两位对分组情况不知情的病理学专家进行描述,严重程度表示为DDS。
1.5 TUNEL法检测膈肌细胞凋亡 根据凋亡检测试剂盒的说明书对组织切片进行TUNEL染色。用荧光显微镜观察TUNEL阳性细胞,凋亡细胞呈黄绿色荧光,正常细胞无荧光,在200倍下随机选择5个视野计数凋亡细胞,取平均数。
1.6 ELISA法检测大鼠膈肌组织中AChE、IL-1β、TNF-α、IL-6、AST、LDH、CK以及MPO活性 将膈肌组织进行匀浆后,按照相应ELISA检测试剂盒的操作说明分别检测膈肌组织中AChE、IL-1β、TNF-α、IL-6、AST、LDH、CK以及MPO活性。
1.7 Western blot检测膈肌组织中蛋白表达 从膈肌组织中分离出总蛋白,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳将蛋白质样品转移到聚偏氟乙烯膜上。在室温下用Western封闭剂(Beyotime)封闭2 h,并在4 ℃下与一抗孵育过夜以进行免疫印迹,用TBST冲洗3次后,在室温下用过氧化物酶结合的二抗室温培养1 h,采用电化学发光溶液进行图像显影,使用Quantity One 4.6.2(BIO-RAD)软件分析图像。
1.8 统计学处理方法 采用SPSS19.0软件包进行统计分析。数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况 假手术组大鼠全部存活,脓毒症组有6只、PTS组有8只存活至术后24 h。此外,进行手术的存活大鼠均出现不同程度的脓毒症症状,如活动障碍、毛发竖立、呼吸短促、结膜下渗出和腹泻等。
2.2 膈肌收缩力-频率关系 脓毒症组膈肌条在所有刺激频率(10~120 Hz)下的收缩力均明显低于假手术组和PTS组(P<0.05),PTS治疗可部分恢复脓毒症时膈肌收缩力的下降(P<0.05),见图1。假手术组、脓毒症组和PTS组的FI分别为84.5±6.8、80.3±7.5和79.6±7.8,3组间差异无统计学意义(P>0.05)。

图1 膈肌条收缩力-电刺激频率曲线
2.3 膈肌组织病理学观察及DDS半定量分析 3组大鼠膈肌组织病理学检测结果显示,假手术组大鼠膈肌组织经HE染色后肌肉组织呈多边形粉红色纤维,肌肉纤维排列整齐紧凑,少有炎性细胞浸润。术后24 h,脓毒症组大鼠膈肌组织在镜下出现明显改变,肌肉组织排列紊乱,伴有大量炎性细胞浸润,细胞间隙增宽。PTS治疗可部分改善CLP后导致的病理改变,肌肉纤维排列相对规律,细胞间水肿和出血减轻,炎性细胞浸润明显减少。半定量分析各组DDS结果表明,脓毒症组DDS评分高于假手术组,而PTS治疗后DDS评分显著降低(P<0.05)。见图2。

图2 各组大鼠膈肌组织病理学表现(×200)及DDS评分
2.4 PTS对膈肌细胞凋亡的影响 TUNEL染色结果显示,与假手术组相比,脓毒症组TUNEL阳性肌肉细胞明显增多(P<0.05),而与脓毒症组相比,PTS组TUNEL阳性细胞显著减少(P<0.05),见图3。
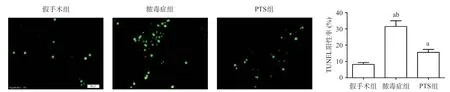
图3 TUNEL染色法测定各组大鼠膈肌细胞凋亡
2.5 PTS对膈肌组织中AChE活性的影响 与假手术组相比,脓毒症组AChE活性明显降低(P<0.05),而与脓毒症组相比,PTS组AChE活性显著升高(P<0.05),见图4A。
2.6 PTS对膈肌组织中促炎细胞因子的影响 与假手术组大鼠相比,脓毒症组大鼠CLP术后24 h膈肌组织中TNF-α、IL-1β和IL-6的含量显著升高(P< 0.05),而PTS治疗后膈肌组织中TNF-α、IL-1β和IL-6的含量均明显降低(P<0.05),见图4B、4C、4D。
2.7 PTS对膈肌组织中肌肉损伤生物标志物的影响 由于骨骼肌损伤没有特异的生物标志物,本研究通过检测膈肌组织中AST、LDH、CK以及MPO活性来评估肌肉损伤。如图4E、4F、4G、4H所示,大鼠膈肌组织中AST、LDH、CK以及MPO活性在术后24 h均显著升高(P<0.05),而PTS治疗后上述生物标志物水平显著下降(P<0.05)。与假手术组比:aP<0.05;与PTS组比:bP<0.05

图4 ELISA法测定各组大鼠膈肌组织AChE活性、IL-1β、TNF-α、IL-6、AST、LDH、CK及MPO含量
2.8 PTS对膈肌组织中PI3K-Akt信号通路的影响 Western blot检测结果显示,大鼠膈肌组织中p-PI3K和p-Akt的蛋白表达量在CLP术后均明显降低(P<0.05),而p-PI3K和p-Akt的蛋白表达量在PTS治疗后均显著增加(P<0.05),见图5。

图5 Western blot检测各组大鼠膈肌组织p-PI3K和p-Akt蛋白表达
3 讨论
脓毒症作为一种常见且难以治疗的危重病,导致沉重的社会和经济负担。本研究通过建立大鼠脓毒症模型,观察PTS对脓毒症大鼠膈肌功能的影响,结果表明PTS可增强膈肌收缩力和AChE活性、减轻炎症反应以及抑制膈肌细胞凋亡,从而对膈肌发挥保护作用,机制研究表明PTS可能通过激活PI3K/Akt信号通路从而抑制肌肉损伤和炎症反应,本研究为治疗脓毒症提供一种新的治疗选择。
CLP作为当前公认的大鼠脓毒症的金标准模型制作方法[7],脓毒症导致膈肌功能障碍是一个非常复杂的病理过程,包括炎症、氧化应激、代谢失衡、线粒体功能障碍、肌肉细胞凋亡等,其中炎症和氧化应激是脓毒症时膈肌功能障碍的两个主要因 素[8]。本研究通过CLP建立大鼠脓毒症模型,CLP术后24 h,大鼠膈肌组织中TNF-α、IL-1β和IL-6等促炎细胞因子水平升高,死亡率升高,同时存活大鼠出现脓毒症综合征,表明成功建立大鼠脓毒症模型,与既往研究相仿[9]。既往研究表明,诸如TNF-α、IL-1β和IL-6等促炎细胞因子对脓毒症的进展有促进作用,促炎细胞因子还可导致膈肌功能障碍和AChE活性下调[10]。当前对PTS的抗炎作用已有较为深入的研究[3],但PTS是否通过抗炎作用从而保护脓毒症大鼠膈肌功能尚未见报道。在本研究中,PTS可降低膈肌组织中促炎细胞因子的表达,同时在显微镜下观察到PTS可明显抑制炎性细胞在肌肉组织中浸润。此外,神经肌肉连接处的AChE活性是膈肌的另一重要特性,患者在全身麻醉后,通常需要肌肉松弛拮抗剂抑制AChE活性发挥治疗作用,从而加速肌肉功能的恢复[11]。因此,抑制脓毒症期间炎症和氧化应激理论上有助于维持膈肌收缩功能和AChE活性。在本研究中,PTS治疗后,膈肌收缩力明显提高,同时脓毒症期间膈肌的AChE活性也得到改善。
本研究还进一步检测了膈肌组织中AST、LDH和CK活性,以间接观察骨骼肌损伤,研究结果表明脓毒症引起膈肌严重氧化损伤,与既往研究结果相 仿[12]。有趣的是,PTS治疗显著降低了脓毒症期间膈肌组织中AST、LDH和CK活性,说明脓毒症引起的膈肌氧化损伤在PTS作用后得到了一定程度的缓解,上述结果符合其对心肌和神经元氧化应激的保护作用[13-14]。MPO是由中性粒细胞合成和分泌的一种酶,MPO可以将H2O2转化为HOCl,HOCl是一种比H2O2更为活跃的活性氧,从而在组织炎症反应和中性粒细胞浸润中发挥关键作用[16]。本研究发现PTS组大鼠膈肌的MPO活性与脓毒症组相比显著降低。同时,脓毒症大鼠膈肌中可见大量中性粒细胞浸润、细胞核增大、骨骼肌纤维间距增大,PTS治疗后,中性粒细胞浸润、细胞核大小、骨骼肌纤维间距和DDS评分均明显减小,这与MPO活性的变化相一致。以上发现提示脓毒症过程中氧化应激和炎症反应的相互作用关系。
PI3K/Akt通路是一条重要的信号转导通路,Akt是PI3K的下游受体,在细胞增殖、分化、凋亡、迁移和转录等多种细胞过程中发挥重要作用[16]。Akt活性下调与细胞炎症反应关系密切,而Akt激活可降低细胞氧化应激并抑制促炎症细胞因子的释放[17]。既往研究证实,PTS可以激活PI3K/Akt信号通路,并在缺血再灌注大鼠脑损伤中发挥保护作 用[18]。本研究表明,PTS改善了脓毒症对大鼠膈肌中PI3K和Akt的抑制作用,从而为证实PTS能激活脓毒症大鼠膈肌PI3K/Akt通路提供了理论依据。
综上所述,本研究发现PTS可保护脓毒症大鼠的膈肌功能和AChE活性,改善脓毒症大鼠膈肌的炎症浸润、氧化损伤和细胞凋亡。此外,本研究表明PI3K/Akt通路是PTS在脓毒症期间保护膈肌免受炎症和氧化应激损伤的重要途径。
