长链非编码RNA LINC00222对肺腺癌细胞增殖、迁移、侵袭和凋亡的影响及作用机制的研究
2021-10-16胡艳正牛彦杰石鹏飞
胡艳正,牛彦杰,石鹏飞
(咸阳市第一人民医院胸外科,陕西咸阳 712000)
非小细胞肺癌(non-small cell lung canter,NSCLC)是临床常见的恶性肿瘤,约占肺癌类型的85%,而肺腺癌是NSCLC 的一种,约占NSCLC 的20%~30%[1]。肺腺癌早期症状不明显,临床检出率低,晚期转移患者较多,预后不佳。因此对其进行积极防治已成为医学领域亟待解决的重要问题。既往研究表明[2-3],长链非编码RNA(LncRNAs)能够调控基因表达,参与肿瘤细胞的多种生物学行为,影响癌症的发生发展。且越来越多研究证明[4-6],LncRNAs 在肿瘤进展和转移中扮演重要角色。故基于分子生物学角度探究肺腺癌的发生发展机制,找寻特异性治疗靶点,对临床攻克具有积极意义。LncRNA LINC00222 是位于6 号染色体,具有5 个外显子的非编码RNA。既往相关研究指出[7],肝母细胞瘤中LINC00222 低表达,参与调控肿瘤的发生发展进程,可作为评估细胞生物学行为及预后的预测标志。然目前有关LINC00222 在肺腺癌发生发展中的生物学功能及分子机制尚不明确且相关研究报道较少。因此,本研究通过构建LINC00222过表达载体,探究了其对肺腺癌细胞增殖、凋亡、侵袭及迁移的影响及分子作用机制,以期探寻新的治疗靶点。
1 材料与方法
1.1 研究对象 选取2019年10月~2020年10月期间在我院行手术治疗的34 例肺腺癌患者的癌组织及其对应癌旁正常组织,所有组织由术中获取经病理确诊后制成组织标本于低温液氮中保存备用。人肺腺癌细胞系A549,LTEP-a-2 及人正常肺胚细胞系MRC-5 购自中国科学院细胞库,于含10 ml/dl胎牛血清1640 培养液,37℃,5 ml/dl CO2培养箱孵育培养,每48 h 传代一次。
1.2 试剂及仪器 1640 培养液购自美国GIBCO公司;pCDNA3.1 载体、empty vector 空载体及GSK-3β 3’UTR 野生型(WT)或突变型(MUT)双荧光素酶报告基因载体购自中国金斯瑞公司;Lipo2000,Trizol 试剂盒购自美国Invitrogen 公司;M-MLV 逆转录反应试剂盒购自日本Takara 公司;CCK-8 反应液、Hoechst33342 10 染液购自日本 Dojindo 公司;酶标仪购自美国 Bio-Tek 公司;Matrigel 购自美国 BD 公司;倒置荧光显微镜购自美国Leica 公司;免疫印迹鼠抗兔p-GSK-3β,β-catenin,GSK-3β单克隆抗体及辣根过氧化物酶标记二抗购自美国 CST 公司; ECL 发光液购自中国碧云天公司;RIP 试剂盒购自美国 Sigma 公司。
1.3 方法
1.3.1 LINC00222 生物信息学分析:通过检索生物信息学网站及Gene Bank 数据库,利用Primer5.引物设计软件以GAPDH 为内参检索设计LINC00222 引物序列,LINC00222 上游 :5’-GGCTCTGATCAGGCTAAGAG CA-3’,下游:5’-TGTTCGTCTGTAACAGGTGTCATGG-3’;GAPDH 上游:5’-TGGACGACTAACTGGTTAG G-3’,下游:5’-GGTATGCACTGTAGTCATCAG-3’,均由GenePharma 公司合成,于-20℃保存。
1.3.2 LINC00222 过表达载体及质粒构建:将LINC00222 序列全长连接至pCDNA3.1 载体构建pCDNA- LINC00222 质粒,同时构建empty vector空载体作为对照。融化的Jm109 感受态细胞加入构建质粒进行转化挑取白色克隆,于LB 培养液震荡过夜培养;将菌液移入EP 管离心弃上清,分次加入Buffer S1/S2/S3 反应获得白色沉淀,离心,弃甩出液;分次加入Buffer W1 /W2/W3 液,离心,弃甩出液,获得质粒DNA 并测定其浓度及纯度。
1.3.3 细胞转染实验:转染前一天以2×105个/孔接种于6 孔板,每孔加入无抗培养液;双无培养液稀释质粒DNA, Lipo2000 溶于双无培养液,室温混匀静置制成转染液加入每孔进行转染,每4~6 h 更换一次培养液,37℃,5ml/dl CO2培养箱培养12~48 h 行基因表达检测。
1.3.4 实时荧光定量PCR 实验:采用Trizol 试剂盒提取组织、细胞总RNA 并检测其浓度及纯度;按照M-MLV 逆转录反应试剂盒及其反应体系进行逆转录获取cDNA,并以此为模板进行PCR 扩增及基因检测。引物由 Invitrogen 公司合成,LINC00222 引物序列上游:5’-GCGTGTGTACTGCCAAGGAGCA-3’,下游:5’TGTTCGTGTCTAAGAGCTGTCAACG-3’;内参GAPDH 序列上游:5’-TGCACGACGAACTG CTTACG-3’,下游:5’-GCGATGCACTGTGCTCAT CAG-3’。反应条件95℃10 min,95℃15 s,60℃60 s,72 ℃10 min,70 ℃30 s,循环40 次。使用美国Applied Biosystems 7900 仪器及2-ΔΔCt法进行基因表达检测分析。
1.3.5 细胞增殖实验:含10 ml/dl 胎牛血清1 640培养液培养细胞接种于6 孔板,转染6 h 后更换正常培养液;24 h 收集制成细胞悬液接种于96 孔板,100 μl/孔,37℃,5ml/dl CO2培养箱培养;每孔加入CCK-8 反应液,采用酶标仪分别于0,24,48,72,96 h 测定细胞450 nm 处吸光度值并绘制生长曲线。
1.3.6 细胞凋亡实验:细胞培养、铺板、转染,制成细胞悬液;将105个细胞悬浮于培养液,加入Hoechst33342 10 染液,混匀孵育,离心弃上清;加入PBS 液悬浮细胞,避光加入PI 染液,混匀;取细胞悬液滴于载玻片,封片,共聚焦显微镜下观察细胞凋亡情况(细胞凋亡时细胞核呈浓染红色)。
1.3.7 细胞迁移实验:采用Marker 笔于6 孔板背面均匀画线横穿过孔;细胞培养、铺板、转染24 h后用枪头垂直入背面横线划痕;PBS 液清洗,加入1640 培养液,拍照并标记位置,37℃,5 ml/dl CO2培养箱培养48 h 取出6 孔板,再次同位拍照记录。
1.3.8 细胞侵袭实验:稀释Matrigel,包被于Transwell 小室上室温风干,每孔加入含 10g/L BSA的无血清培养液孵育;常规消化、离心取沉淀,PBS 液清洗,10 g/dl BSA 的无血清培养液重悬,密度105个/ml;取细胞悬液加入Transwell 小室,24孔板下室加入含 10 ml/dl 胎牛血清1640 培养液,培养箱培养24 h;取出小室,PBS 液清洗,95ml/dl酒精固定,DAPI 染色;随机选取5 个视野于倒置荧光显微镜下计数 ,取平均值。
1.3.9 免疫印迹实验:细胞转染、培养后用冷PBS 液清洗收集于EP 管,离心、弃上清, 加入RIPA 液裂解(蛋白磷酸化水平检测时按100:1 比例在裂解液中加入Na3VO4),提取总蛋白。同方法获取沉淀依次加入细胞浆蛋白抽提试剂A 和B,涡旋、水浴、离心,取沉淀加入含 PMSF 细胞核蛋白抽提剂,提取细胞核蛋白。配置SDS-聚丙烯酰胺凝胶体系行上样与电泳分离、转印及封闭;TBST 液洗膜,加入p-GSK-3β 一抗,β-catenin抗体及 GSK-3β 抗体,孵育过夜;洗膜加入二抗辣根过氧化物酶,室温孵育,PVDF 膜滴加 ECL发光液,检测条带。
1.3.10 双荧光素酶报告实验:利用生物信息学方法预测LINC00222 与GSK-3β 的结合位点并经体外克隆扩增,设计具有预测靶位点的GSK-3β 3’UTR 野生型(WT)或突变型(MUT)双荧光素酶报告基因载体,突变的3’UTR 区作为对照组。转染前24 h 将A549,LTEP-a-2 细胞接种至24 孔板培养,使用Lipofectamine 2000 将构建的荧光素酶报告基因载体和含有海肾荧光素酶的对照载体共转染,在转染48 h 后使用双荧光素酶报道基因测定系统测定荧光素酶活性,测定LINC00222 对GSK-3β 荧光素酶活性的调控情况,实验重复3 次。
1.3.11 RNA 结合蛋白免疫沉淀实验:细胞经转染、培养,加入甲醛固定,PBS 液清洗,甘氨酸停止液终止反应;加入含 PMSF 的 PBS 刮除液收集细胞至EP 管,离心、弃上清,滴入Complete lysis buffer裂解液重悬,冰上裂解,离心,弃上清,加入超声液重悬(冰上操作),离心取上清加入DNA 酶处理样品。EP 管洗磁珠,加入反应体系,旋转过夜;利用RIP 试剂盒行样本收集及检测。
1.4 统计学分析 采用SPSS 20.0 统计软件进行实验数据录入分析,所有实验均重复3 次取平均值数据,采用均数±标准差(±s)表示,组间比较采用独立样本t检验,多组比较采用方差分析,重复测量数据采用重复测量方差分析。P<0.05 为差异具有统计学意义。
2 结果
2.1 肺腺癌组织及癌旁正常组织中LINC00222 表达 qRT-PCR 检测34 例肺腺癌组织中LINC00222 mRNA 相对表达,结果显示:肺腺癌组织中LINC 00222 相对表达量(0.324±0.186)显著低于癌旁正常组织(1.056±0.547),差异有统计学意义(t=7.388,P<0.001)。Western blot 实验检测肺腺癌组织LI 中NC00222 蛋白表达,结果显示:肺腺癌组织中LINC00222 蛋白表达(0.427±0.149)同样较癌旁正常组织明显降低(0.997±0.162),差异有统计学意义(t=15.100,P<0.001)。
2.2 肺腺癌细胞系中LINC00222 低表达 qRTPCR 检测显示:人正常肺胚细胞系MRC-5 及肺腺癌A549,LTEP-a-2 细胞系中LINC00222 表达量分别是1.147±0.251,0.283±0.176,0.159±0.153,较正常肺胚细胞系相比,肺腺癌细胞系中LINC00222 显著低表达(F=21.926,P=0.002)。
2.3 LINC00222 转染效率验证 分别转染pCDNALINC00222 及empty vector 载体至A549,LTEP-a-2细胞系,qRT-PCR 检测显示:与转染empty vector载体(1.001±0.004) 相比,转染pCDNA-LINC 00222载体后A549(8.351±1.554),LTEP-a-2(12.347±2.143)细胞中LINC00222 表达显著提高,差异有统计学意义(F=42.538,P<0.001)。
2.4 LINC00222 抑制肺腺癌细胞增殖 见图1。CCK-8 法检测显示:与转染empty vector 载体相比,转染pCDNA-LINC00222 载体后A549,LTEP-a-2细胞增殖能力显著降低(P<0.05)。

图1 CCK-8 检测转染pCDNA-LINC00222 后A549,LTEP-a-2 细胞增殖(*P<0.05,**P<0.01,***P<0.001)
2.5 LINC00222 促进肺腺癌细胞凋亡 见图2。Hoechst 33342/PI 染色法检测显示:与转染empty vector 载体相比,转染pCDNA-LINC00222 载体后A549,LTEP-a-2 细胞凋亡数目显著增加(P<0.01)。

图2 Hoechst 33342/PI 染色法检测转染pCDNA-LINC00222 后A549,LTEP-a-2 细胞凋亡情况(**P<0.01)
2.6 LINC00222 抑制肺腺癌细胞迁移及侵袭 见图3。划痕实验及Transwell 实验检测细胞迁移、侵袭能力,结果显示:与转染empty vector 载体相比,转染pCDNA-LINC00222 载体后A549,LTEP-a-2细胞迁移、侵袭能力受到明显抑制。

图3 划痕实验(A)、Transwell 实验(B)检测转染pCDNA-LINC00222 后A549,LTEP-a-2 细胞迁移、侵袭情况
2.7 过表达LINC00222 增强GSK-3β 激酶活性,抑制β-catenin 核转位 为验证肺腺癌中LINC00222对GSK-3β 激酶活性的影响,研究分别转染pCDNA-LINC00222 及empty vector 载体至A549,LTEP-a-2 细胞。qRT-PCR 法检测显示:转染后A549,LTEP-a-2 细胞中两组GSK-3βmRNA 表达无显著差异(P>0.05),见图4。Western blot 法检测转染后GSK-3β 在Ser9 磷酸化水平表达差异显示:转然后A549,LTEP-a-2 细胞GSK-3β 磷酸化水平显著降低,GSK-3β总蛋白无明显差异,见图5,提示过表达LINC00222 增强GSK-3β 激酶活性。

图4 qRT-PCR 检测转染pCDNALINC00222 后A549,LTEP-a-2 细胞中GSK-3β mRNA 水平表达

图5 Western blot 法检测转染pCDNALINC00222 后A549,LTEP-a-2 细胞中P-GSK-3β 和GSK-3β 蛋白表达
下游基因β-catenin 是否转入细胞核继续发挥作用由GSK-3β 催化活性直接调控影响。研究对肺腺癌中LINC00222 影响β-catenin 核转位的作用机制进行了验证。Western blot 法检测显示,转染过表达LINC00222 后,细胞核内β-catenin 蛋白表达降低(P<0.05);当加入TWS119 抑制GSK-3β活性后,β-catenin 蛋白水平明显恢复,见图6,提示LINC00222 通过调控GSK-3β 催化活性进而抑制β-catenin 核转位。

图6 Western blot 法检测转染pCDNA-LINC00222 或pCDNA-LINC00222+TWS119 后A549,LTEP-a-2 细胞核内β-catenin 蛋白表达(*P<0.05,**P<0.01).
2.8 荧光素酶报告基因验证LINC00222 与GSK-3β 靶向关系 见图7。为探究LINC00222 在肺腺癌中是否直接调控GSK-3β 表达,研究构建了GSK-3β 的荧光霉素报告基因载体,利用生物信息学检测分析发现GSK-3β 是LINC00222 的靶标,通过双荧光素酶标记实验验证了LINC00222与GSK-3β 存在相互结合位点,提示两者具备可能的调控关系。后将GSK-3β-3’UTR 质粒及empty vector 和pCDNA-LINC00222 载体共转染A549,LTEP-a-2 细胞,采用荧光霉素报告基因实验检测各组细胞中GSK-3β 表达活性,结果显示:与empty vector 组相比,A549,LTEP-a-2 细胞转染pCDNALINC00222 后含有野生型GSK-3β-3’UTR 报告质粒荧光素酶活性显著降低(P<0.05),而含有突变型GSK-3β-3’UTR 的报告质粒荧光素酶活性降低不明显(P>0.05)。表明在基因水平上GSK-3β 受LINC00222 直接调控,GSK-3β 蛋白是LncRNA LINC00222 的靶标。
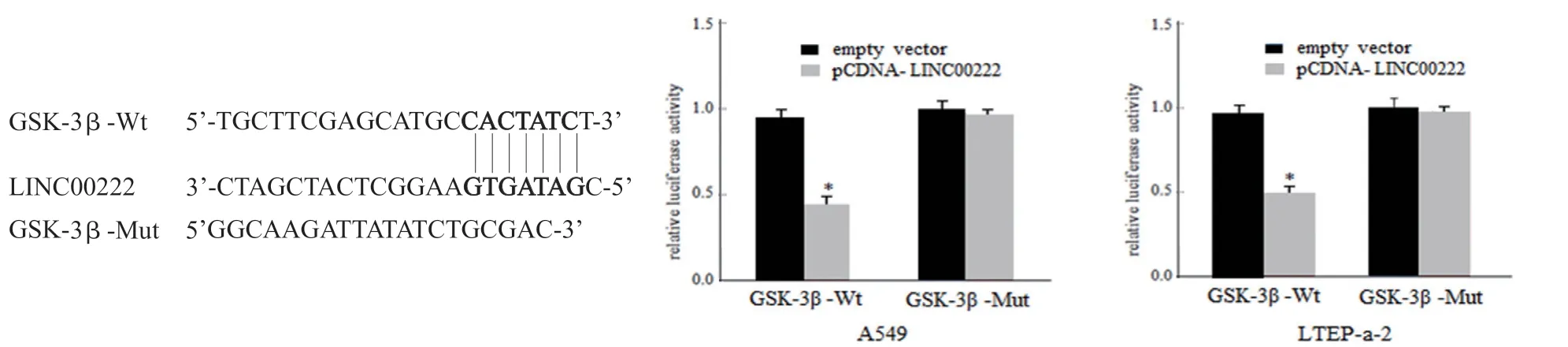
图7 荧光霉素报告基因实验验证LINC00222 与GSK-3β 的调控关系(*P<0.05)
2.9 LINC00222 与GSK-3β 结合再次验证 见图8。研究利用RPISeq 在线预测软件对LINC00222与GSK-3β 蛋白的结合进行了预测,通过转染pCDNA-LINC00222 载体,采用RIP 法检测显示:LINC00222 与GSK-3β 蛋白相互结合。qRT-PCR法检测显示,GSK-3β 蛋白共沉淀中LINC00222表达显著高于IgG 蛋白共沉淀(P<0.01)。进一步证实LINC00222 通过与GSK-3β 蛋白相互结合调控GSK-3β 催化活性进而抑制β-catenin 核转位。

图8 LINC00222 与GSK-3β 结合验证
3 讨论
近年越来越多研究发现,癌症的发生发展是多基因、多因素共同作用的结果,表明 LncRNAs 在疾病的发生发展中扮演重要角色,参与调节肿瘤细胞的全部过程,与肿瘤患者的预后密切相关。SHI 等[8-10]研究指出,LncRNAs 在胰腺癌、NSCLC 及前列腺癌中与患者预后密切相关,是影响患者预后的潜在因素。大量研究证实[11-12],LncRNAs 在多种细胞过程中发挥着分化和发展、基因印迹及抗病毒反应等多种功能,可通过与染色质修饰复合物作用,参与并影响细胞核转录活性;部分LncRNAs 可作为转录后修饰因子,对蛋白质翻译、mRNA 衰变及维持蛋白质稳定等进行调控。此外,ZHANG 等[13-14]研究证实,乳腺癌、肝癌、卵巢癌及NSCLC 中多种LncRNA 均差异性表达,对肿瘤细胞的增殖、凋亡等生物学行为发挥促癌或抑癌作用,揭示了异常表达的LncRNA 是癌的一个标志,可作为肿瘤潜在生物标志物。LncRNA 与黏附蛋白相关基因及细胞黏附基因等的表达密切相关[15],从侧面反映了LncRNA 参与癌症发生发展的作用机制。因此,探寻新的与肺腺癌相关的LncRNA,找寻安全有效的新的基因靶点,对肺腺癌临床诊治及提高患者预后具有重要意义。
LncRNAs 按其基因组位置可分为基因间、基因内、双向、正义及反义LncRNAs,而基因间LncRNAs 由两个编码基因间转录产生,参与各级邻近基因的调节,也可作为转录调节器同RNA 间的相互作用来改变mRNA 的稳定性[16-17]。而指导LncRNA,分子支架和诱捕LncRNA 是目前已被证实的LncRNA 作用模式。UCSC 基因组浏览器显示,LINC00324 及LINC00222 均为基因间LncRNA。研究证实,LINC00324 在NSCLC 中低表达,抑制细胞增殖、侵袭及迁移,促进细胞凋亡,发挥抑癌作用[18];系统性红斑狼疮患者中LINC00324 表达上调,是评估疗效的辅助指标[19];LINC00324 参与胃癌、白血病的发生发展[20]。目前有关LncRNA LINC00222 在肿瘤中的作用研究较为缺乏,推测其在肺腺癌中应与LINC00324 发挥同样作用。为验证其猜想,本研究经检测显示肺腺癌组织及细胞系中LINC00222 显著低表达,通过构建LINC00222过表达载体,实验探究发现过表达LINC00222 能够抑制肺腺癌细胞增殖、迁移及侵袭,促进细胞凋亡,提示LINC00222 发挥抑癌基因作用。
肿瘤发生发展过程中Wnt 信号通路发挥重要作用,GSK-3 亚型GSK-3β 作用于众多结构蛋白、信号蛋白及转录因子,调控细胞的分化、凋亡,发挥抑癌作用[21]。正常生理条件下,Wnt/β-catenin 信号通路未被激活,GSK-3β 通过与Axin/GSK-3β/APC/β-catenin 形成蛋白复合物,磷酸化β-catenin使其降解。当肿瘤处于病理状态时,Wnt 通路激活造成蛋白复合物解聚,抑制、介导β-catenin 磷酸化,激活下游基因表达,诱导肿瘤发生[22]。GSK-3β 催化活性是Wnt/β-catenin 信号通路的关键[23]。研究表明[24-25],GSK-3β 参与调节细胞信号,细胞生长、分化、凋亡和转录因子调节器官生长、死亡,起到抑癌作用;当抑制GSK-3β 活性后,β-catenin 转位入核,诱导下游基因表达,Wnt 通路激活,促进细胞生长;Wnt 信号通路中GSK-3β 至关重要,其可磷酸化底物从而激活或失活Wnt 通路。且研究显示,GSK-3β 介导Wnt/β-catenin 致癌通路活性进而参与结肠癌的发展进程[26]。CEBPA 介导的lncRNA PLIN2 上调通过GSK3 和Wnt/β-catenin 信号通路促进慢性粒细胞白血病的发展[27]。MicroRNA-940靶向INPP4A 或GSK-3β,激活Wnt/β-Catenin 通路,调节膀胱癌细胞的恶性行为[28]。故本研究探究了肺腺癌中LINC00222 是否通过调控GSK-3β/β-catenin 信号通路进而发挥作用,发现过表达LINC00222 能够降低GSK-3β Ser9 位点磷酸化水平,增加GSK-3β 激酶催化活性,抑制β-catenin核转位,当降低GSK-3β 催化活性时该抑制作用明显减弱,提示LINC00222 可能通过调节GSK-3β 激酶活性影响下游β-catenin 核转位,进而影响肺腺癌细胞的生物学行为。另研究通过生物学信息软件预测LINC00222 与GSK-3β 结合位点经体外克隆扩增,设计构建了具有预测靶位点的GSK-3β 3’UTR 野生型或突变型报告基因载体,经双荧光素酶基因实验验证发现,GSK-3β 受LINC00222直接调控,GSK-3β是LINC00222 的靶标;RIP 实验也验证了LINC00222 与GSK-3β 蛋白存在相互结合,且发现GSK-3β 蛋白共沉淀中LINC00222表达显著升高,推测可能是由于两者的结合阻止GSK-3β磷酸化,增强GSK-3β活性,抑制β-catenin核转位发挥作用进而调节细胞过程。然而肺腺癌发病机制复杂,其更深入的作用机制还需后续大量研究进一步证实。
综上所述,肺腺癌中LINC00222 低表达,其可能通过调控GSK-3β 催化活性,抑制β-catenin核转位,进而调控肺腺癌细胞的增殖、迁移及侵袭,为肺腺癌的治疗提供了新的研究方向。
