CT引导经皮射频消融术治疗肝癌分析
2021-10-15郭小军孔延亮成正祥
郭小军,孔延亮,刘 涛,成正祥,张 睿,樊 雷
(铜川市人民医院 肿瘤科,陕西 铜川 727000)
肝脏恶性肿瘤在临床具有较多分型,总体可分为原发性和继发性(即转移性)两大类[1],其中原发性肝脏恶性肿瘤以原发性肝癌最多见,而原发性肝癌又以原发性肝细胞癌为最多见,早期诊断较为困难[2]。继发性肝脏恶性肿瘤则指全身各器官的原发癌或肉瘤转移至肝脏所致,多见胃、结直肠、子宫、肺、乳腺等器官恶性肿瘤的肝转移[3]。由于原发性肝癌发病的隐匿性,一旦临床发现多数已为晚期,且多由肝硬化发展而来,而转移性肝脏肿瘤则为全身各种恶性肿瘤的晚期改变,多已丧失外科手术治疗机会[4-5]。射频消融术(radiofrequency ablation, RFA)作为一种微创治疗肝癌的方法,近年来已被临床广泛应用于治疗肝脏肿瘤,其安全性及有效性也得到临床认可[6-7]。本研究探讨CT引导下经皮RFA治疗肝脏恶性肿瘤的疗效。
1 资料与方法
1.1病例选择 2016年3月至2018年10月铜川市人民医院肿瘤科收治的肝脏恶性肿瘤共76例,男46例,女30例,年龄48~68岁,平均年龄(60.9±5.5)岁,原发性肝癌76例,依据美国癌症联合委员会(AJCC)制订的TNM(tumor-node-metastasis)病理分期标准进行分期,Ⅰ期:29例(38.2%);Ⅱ期:19例(25.0%);ⅢA期:12例(15.8%);ⅢB期:8例(10.5%);ⅢC期:4例(5.3%);ⅢNOS:3例(4.0%);Ⅳ期:1例(1.3%)。采用随机数字法分为观察组38例和对照组38例,所有患者均依据组织病理学或细胞学结果诊断为肝脏恶性肿瘤,肿瘤大小无差异无统计学意义(P>0.05)。纳入标准:①患者KPS评分≥70分;②Child-Pugh肝功能分级为A级/B级;③病灶数为1~3个,且单发病灶直径<5 cm,多发病灶最大直径<3 cm。④无顽固性大量腹腔积液;⑤符合相关手术指征;⑥经患者及家属同意。排除标准:①意识障碍;②不可纠正的凝血功能障碍;③肝转移瘤遍布全肝;④全身感染、败血症;⑤疾病终末期、多器官功能衰竭;⑥除肝脏之外,尚有其他脏器有恶性肿瘤转移。本研究通过我院医学伦理委员会审核,所有患者均对本研究知情并签署知情同意书。
1.2治疗方法
1.2.1CT引导下RFA治疗 采用奥林巴斯公司生产的Olympus-CelonPower双极射频消融系统、西门子公司生产的SOMATOM Emotion 6螺旋CT完成治疗。治疗前对患者进行常规检查,包括血常规、凝血功能、肝肾功能及心电图等,检查有无禁忌证,询问有无过敏史,术前禁饮食6 h,并做好患者的呼吸配合训练;术前认真阅读CT等影像学资料,并对患者进行详细的体格检查,确定最佳的进针路线和布针方案。①RFA治疗:针对<2 cm的肿瘤进行1点次治疗,根据CT显示病变的部位,于体表用胶布粘贴好定位器,行包括病灶上下层面在内的CT扫描,一般以层厚5 mm为基础,必要时调整层厚为3 mm;当射频消融仪上的温度达到75 ℃时开始计算时间,5~15 min即可[2-4]。对于直径>2 cm的肿瘤,根据肿瘤大小、形状及位置制定多点重叠消融的方案。②根据扫描图像,确定显示病灶最大层面作为穿刺点,然后依据术前预定布针方案及扫描情况,选择并记录最佳的进针方向、角度及进针所需深度;③于确定的穿刺点处做常规局部消毒,铺无菌洞巾,用2%盐酸利多卡因注射液由浅入深行局部麻醉至腹膜,然后保留针头行穿刺部位再次扫描,确认进针方向后退出针头;④嘱患者闭气,根据预定的进针角度及深度,快速进针到达预计的深度,再次扫描进针部位以确定针尖是否到达病灶预定位置,若单发病灶较大(直径>3 cm,且≤5 cm),或肿瘤病灶≤3个且最大直径≤3 cm,可根据病灶情况予以多针联合消融;⑤经CT扫描证实射频消融针位置无误后,将射频消融针连接主机,行射频消融治疗,治疗全程注意观察患者病情变化,待治疗结束,再次扫描可见病灶全部消融,局部可见少许液化灶形成,退针,局部无菌纱布加压包扎;⑥行包括病灶及上下层面在内的再次CT扫描,观察肝周及腹腔内有无积液、积血等情况,期间注意观察病情变化。
1.2.2TACE治疗 选择股动脉建立通路后注入造影剂,通过血管造影明确病灶位置、大小及血管分布,选择肿瘤病灶的供血动脉,通过导管像向病灶内注入化疗药物,本研究选择表阿霉素60~90 mg/m2体表面积,静脉注射,3~5分钟内注入体内;氟脲嘧啶0.15~0.3 g/d,分3~4次服。疗程总量10~15 g;卡铂300 mg/m2,先用5%葡萄糖液制成10 mg/ml溶液,再加入5%葡萄糖液250~500 ml,静脉滴注。
1.3观察指标 所有患者在术后定期进行增强CT、MRI检查,评估肿瘤体积大小。根据《肝癌局部消融治疗规范的专家共识》,完全消融是指1个月后增强CT显示肿瘤整体无强化,否则需要补充消融治疗;局部复发是指增强CT显示消融区域内或者紧邻消融区域位置处出现肿瘤复发。并根据WHO 实体肿瘤评价标准[8]对疗效进行评估,其中完全缓解(CR)指影像学提示肿瘤完全消失并维持一段时间、部分缓解(PR)指影像学提示肿瘤缩小,最大径乘积较治疗前减少超过50%、疾病稳定(SD)指肿瘤最大径乘积较治疗前减少小于25%或增加小于25%、疾病进展(PD)指肿瘤最大径乘积较治疗前增加超过25%或发现新病灶。客观缓解率(ORR)为获得CR和PR患者在所有患者中的比例。对所有患者进行至少2年的随访,对比两组6个月、1年及2年的生存率;统计两组并发症发生情况,包括:发热、局部疼痛、转氨酶升高、腹腔内出血、气胸、胆管损伤等。
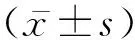
2 结 果
2.1两组临床效果比较 观察组ORR为81.58%,对照组ORR为57.89%(χ2=5.814,P<0.05),观察组整体临床效果显著优于对照组(Z=6.457,P<0.05),见表1。

表1 两组临床效果比较[例(%)]
观察组术后1周复查CT显示,病灶区CT值下降,内部呈低密度区,周围组织界限清楚,增强CT扫描后,消融病灶内和周边组织未见明显强化;术后1个月再次复查,病灶区密度较前进一步下降,与周围组织界限清晰,未见肿瘤复发,患者术前术后的CT表现见图1~2。
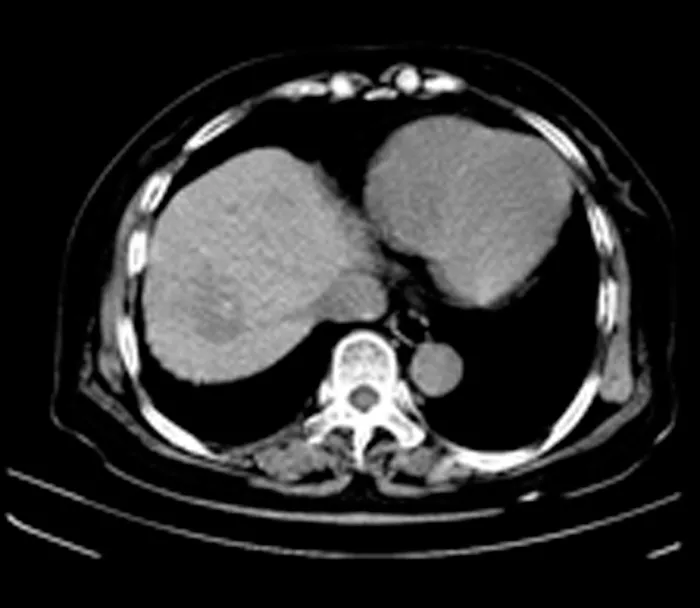
图1 经皮RFA术前CT检查
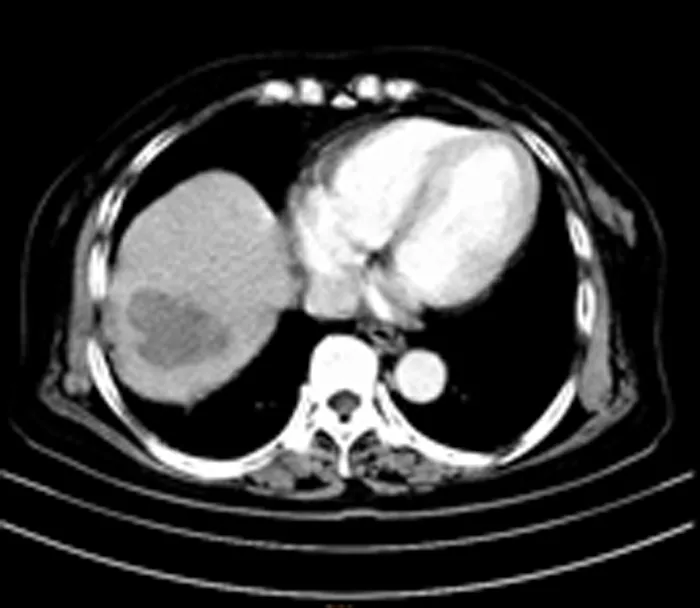
图2 经皮RFA术后1月CT检查
2.2两组生存率比较 两组6个月生存率比较差异无统计学意义(P>0.05),而观察组治疗后1年及2年的生存率显著优于对照组,差异均具有统计学意义(P<0.05),见表2。

表2 两组生存率比较[例(%)]
2.3术后并发症情况 观察组发热6例、局部疼痛4例、出现转氨酶升高11例,对照组发热4例、局部疼痛5例、出现转氨酶升高13例,两组并发症发生率比较差异无统计学意义(P>0.05),给予对症治疗后所有患者均恢复,同时两组均无腹腔内出血、气胸、胆管损伤等情况发生。
3 讨 论
我国原发性肝癌高发,诊断时多已是中晚期,加之合并有不同程度的肝硬化、肝功能储备不足或合并其他病症,80%以上患者无手术指征[9-10]。有学者认为,手术切除是可切除转移性肝癌的首选治疗方法,转移瘤的切除可以延长生存[11]。但由于转移瘤的位置、大小、数目或剩余肝组织不能代偿正常肝功能等原因,大约80%~90%的患者确诊时已失去外科手术机会[12]。
既往临床上多采用TACE对肝癌患者进行治疗,其临床效果也得到证实,但临床发现TACE治疗无法完全使患者的肿瘤灶坏死,治疗后复发或进展的比例较高[13]。RFA是全世界最常见的热消融模式,并且目前被认为是用于早期原发性肝癌除手术外的最佳治疗方式[14-15]。RFA依赖高频电流通过嵌入在肿瘤中的电极使电极周围有电流作用的组织离子相互摩擦产生热量,导致组织凝固性坏死。该技术因具有疗效良好、操作简便、对患者损伤小等优点而受到普遍关注[16-17]。我国于2011年提出并制订了肝癌RFA治疗的专家共识[18]。CT具有分辨率高、无应用盲区,不受骨骼、气体等因素干扰等优势,因此CT引导下经皮RFA治疗肝脏恶性肿瘤具有极大的实用性[19]。
本研究分别采用RFA和TACE对肝癌患者进行治疗,结果显示观察组治疗后的ORR显著高于对照组,同时观察组治疗后整体临床效果显著优于对照组(P<0.05);且观察组治疗后1年及2年的生存率显著优于对照组(P<0.05),本研究结果与部分研究结果保持一致[11]。此外本研究中两组并发症发生率比较差异无统计学意义(P>0.05),所有患者均无腹腔内出血、气胸、胆管损伤等情况发生,也提示两种治疗方法都具有一定的安全性。
综上,RFA治疗能够有效清除肝癌患者的肿瘤灶,提高近期和远期的疗效,且具有一定的安全性,但需要注意的是,不是所有的肝脏恶性肿瘤均适合经皮RFA,机体状况较差、心肺功能严重障碍、全身多处转移等患者仍为经皮RFA的禁忌证。
