自分散反应性TiO2的制备及其对棉织物的整理
2021-10-15陈雨洁陈嘉毅王春霞
王 矿 陈雨洁 陈嘉毅 任 煜 王春霞
(1.盐城工学院,江苏盐城,224001;2.南通大学,江苏南通,226019)
TiO2资源丰富、价格低廉[1],具有优异的化学稳定、抗菌、防紫外、自清洁等性能,被广泛地应用到纺织、医疗、电子等各个领域[2‐4]。TiO2的制备方法有水热法[5‐6]、醇盐水解法[7]、气体燃料燃烧法[8]等。水热法简单方便、无需过高温,被广泛应用到TiO2的制备中。水热法以水为溶剂,在一定温度、压强下使钛源溶解‐沉积生成TiO2,常用的钛源包括有机钛醇盐类[9]、无机钛盐类[10]。
TiO2粒径小,比表面积大,表面能高,粒子间有较强的范德华力,使得粒子极易团聚。且TiO2表面的极性基团和非极性基团含量不多,与其他物质作用弱,所以TiO2不易稳定地分散在液相体系 中,阻碍 了在纺织 印染行业 的应用发 展[11‐12]。目前,TiO2负载棉纤维的方法有溶胶‐凝胶法、直接浸渍法、粉体烧结法等。这些方法并不能使TiO2牢固负载在棉纤维上,其耐久性很差。本研究将TiO2进行化学改性,增加表面反应基团,制备自分散反应性TiO2,使其通过静电斥力均匀分散在水中,能与棉纤维上的羟基反应,生成共价键结合。探究了自分散反应性TiO2与棉织物结合的反应机理,为棉织物负载纳米粒子提出一种新的思路。
1 试验部分
1.1 试验材料与仪器
织物:平纹机织棉织物,经纱和纬纱号数均为20 tex,经密和纬密均为300 根/10 cm,单位面积质量(120±10)g/m2。
药品:TiO2(自制)[13],硅烷偶联剂KH‐550,三聚氯氰,无水乙醇,甲基橙,四氢呋喃,无水碳酸钾,质量分数25%氨水,对氨基苯磺酸钠、丙酮、氯化钠和碳酸钠均为分析纯。
仪器:FA1004N 型电子天平,JB‐3 型磁力恒温搅拌器,SD101‐1 型电热鼓风干燥箱,H1750 型大容量高速离心机,DHJK‐4002 型低温恒温搅拌反应浴,RE52‐3 型旋转蒸发仪,SHZ‐D(Ⅲ)型循环水真空泵,KQ5200DE 型数控超声波清洗器,XH‐KG55B 型振荡式染样机,DF‐101S 型恒温加热磁力搅拌器,PHS‐3C 型便携式pH 计,DZF‐6034 型真空干燥箱。PANalytical X 型射线衍射仪,Nova Nano SEM 450 型场发射扫描电子显微镜,ESCALAB 250Xi 型X 射线光电子能谱仪,TU‐1901 型双光束紫外可见分光光度计,YG(B)912E 型纺织品防紫外性能测试仪。
1.2 TiO2的氨基化改性
首先将硅烷偶联剂KH‐550(0.1 g)、氨水(0.5 mL)溶解于乙醇溶液中(50 mL,去离子水∶无水乙醇=1∶9);然后加入TiO2(0.2 g),超声波处理30 min,室温磁力搅拌24 h;最后,将反应液离心处理、用去离子水和和无水乙醇各洗涤3 次,在60 ℃下烘干,制得TiO2/KH‐550[14]。
1.3 4⁃(4,6⁃二氯⁃1,3,5⁃三嗪⁃2⁃亚氨基)苯磺酸钠的合成
首先将三聚氯氰(2 mmol)溶解于四氢呋喃中(15 mL),搅拌至完全溶解,置于0 ℃的低温反应器中;然后将无水碳酸钾(4 mmol)加入至上述溶液中,搅拌10 min 后加入对氨基苯磺酸钠(2 mmol),继续在0 ℃下反应180 min,旋转蒸发去除四氢呋喃,冷却至室温,加入去离子水(60 mL)使碳酸钾充分溶解,转移至低温下静置2 h;最后取出样品做离心处理,用无水乙醇洗涤5次,在60 ℃的真空干燥箱中烘干,得到4‐(4,6‐二氯‐1,3,5‐三嗪‐2‐亚氨基)苯磺酸钠(以下简称SAT)。
1.4 自分散反应性TiO2的制备
TiO2/KH‐550(0.5 g)和丙酮(20 mL)置于圆底烧瓶中,加入SAT(0.688 3 g),磁力搅拌10 min。用碳酸钾溶液(1.25 mol/L)调节体系pH 值至5~6,40 ℃下反应3 h,将沉淀离心处理,用无水乙醇洗涤3 次,在45 ℃的真空干燥箱中烘干,得到自分散反应性TiO2。
1.5 分散及储存稳定性测试
将样品分散在去离子水中(pH≈7),超声波处理30 min,再用去离子水稀释至透明,继续超声波处理30 min。用Nano‐ZS 粒度及Zeta 电位分子量分析仪测定粒径大小、多分散性指数(PDI)和Zeta 电位,每个样品分别测试3 次,取平均值。
将样品(0.3 g)加入到去离子水(35 mL)中,超声波处理60 min,静置1 h 和1 个月后分别观察分散液的情况。
1.6 自分散反应性TiO2对棉织物的整理
首先将一定量(0.05 g、0.1 g、0.2 g、0.3 g)的自分散反应性TiO2、氯化钠(0.05 g)、去离子水(30 mL)和棉织物(1 g)置于锥形瓶中,超声波处理30 min。然后取碳酸钠(0.45 g)加入到上述分散液中,在温度90 ℃下振荡反应120 min,取出织物水洗烘干,所得到的棉织物分别标记为TiO2‐0.05 棉织物、TiO2‐0.1 棉织物、TiO2‐0.2 棉织物和TiO2‐0.3 棉织 物。
1.7 棉织物的结构表征
采用PANalytical X 型射线衍射仪分析物相。用Nova Nano SEM 450 型场发射扫描电子显微镜观察物理形貌。利用ESCALAB 250Xi 型X 射线光电子能谱仪分析元素组成。使用TU‐1901型双光束紫外可见分光光度计分析可吸收光。
1.8 棉织物的性能测试
依据GB/T 18830—2009《纺织品 防紫外线性能的评定》,用YG(B)912E 型纺织品防紫外性能测试仪测试棉织物的防紫外线性能,每个样品测6 次取平均值。通过降解甲基橙溶液来测试自清洁性能。在棉织物表面滴1 滴甲基橙溶液(质量浓度1 g/L),用300 W 氙灯分别照射0 h、4 h、8 h、12 h、16 h、20 h 和24 h 后进行拍照,观察织物表面颜色的变化[15]。
2 结果与讨论
2.1 自分散反应性TiO2与棉织物结合的反应机理分析
图1 为自分散反应性TiO2与棉织物结合的反应机理。根据三聚氯氰的3 个氯原子在不同温度范围内的活性不同,制备了具有自分散反应性TiO2[16]。首先,利用KH‐550 与TiO2在氨水存在下反应制得TiO2/KH‐550。然后,在温度0 ℃下,通过三聚氯氰中的1 个氯原子与对氨基苯磺酸钠中的氨基反应合成SAT。随后,在温度40 ℃下,通过TiO2/KH‐550 中的氨基与SAT 中1 个氯原子发生亲核取代反应,得到自分散反应性TiO2。最后,在90 ℃碱性条件下自分散反应性TiO2中的1 个氯原子与棉织物中的羟基反应,将自分散反应性TiO2通过共价键结合的方式负载到棉织物上。

图1 自分散反应性TiO2与棉织物结合的反应机理
2.2 分散及储存稳定性分析
表1 为TiO2、TiO2/KH‐550 和自分散反应性TiO2的粒径、PDI和Zeta 电位测试结果。由表1可以看出,TiO2/KH‐550 和自分散反应性TiO2的粒径尺寸均增加,这是因为TiO2表面包覆了一层有机分子。Zeta 电位的数值与胶态中的分散稳定性相关,(0~±5)mV 表示很快沉淀聚集,(±10~±20)mV 表示稳定性很差,(±20~±30)mV表示稳定性一般,(±30~±40)mV表示较好的稳定性[17]。TiO2、TiO2/KH‐550 和自分散反应性TiO2的Zeta 电位分别为-19.0 mV、+25.1 mV 和-35.0 mV。经过改性后的TiO2分散性提高,在水中静置1 个月后自分散反应性TiO2的Zeta 电位为-32.1 mV,说明自分散反应性TiO2具有良好的储存稳定性。PDI用于描述聚合物分子量的分布,PDI越大,分子量分布越宽,反之分子量分布越均匀。TiO2/KH‐550 和自分散反应性TiO2的PDI大于TiO2,这是因为引入了有机分子。自分散反应性TiO2的PDI小于TiO2/KH‐550 是由于自分散反应性TiO2分散性更好,分子量分布更均匀。

表1 样品粒径、PDI 和Zeta 电位
图2 为TiO2、TiO2/KH‐550 和自分散反应性TiO2在水中静置前后分散情况。图中自左向右依 次 是TiO2、TiO2/KH‐550 和 自 分 散 反 应 性TiO2。 图2(a)超 声 处 理60 min 后,TiO2、TiO2/KH‐550 和自分散反应性TiO2均可分散在水中;图2(b)静置1 h 后,TiO2和TiO2/KH‐550 基本沉淀瓶底,溶液较清,而自分散反应性TiO2仍均匀分散在水中,倒置后瓶底几乎没有沉淀;图2(c)静置1 个月后,TiO2和TiO2/KH‐550 完全沉淀到瓶底,溶液分层,而自分散反应性TiO2仍能均匀分散在水中,倒置后瓶底仅有少许沉淀,说明SAT 对TiO2改性使其具有良好的分散稳定性。

图2 分散液静置前后分散情况
2.3 结晶结构分析
图3 为棉织物处理前后的X 射线衍射图(以下简称XRD 图)。如图3 中TiO2的XRD 图所示,2θ为25.28°、36.98°、37.93°、48.34°、53.99°、54.93°、62.69°、68.83°、70.09°和75.02°处均出现的衍射峰,与XRD 标准卡(PDF#21‐1272)对应的晶 面 为(101)、(103)、(004)、(200)、(105)、(211)、(204)、(113)、(220)和(215),这些为锐钛矿TiO2的 特征 峰;2θ为27.32°、36.09°、41.22°、44.14°、54.36°和56.45°处出现的衍射峰,与XRD标准卡(PDF#21‐1276)对应的晶 面为(110)、(101)、(111)、(210)、(211)和(220),这些为金红石TiO2的特征峰,即制备的TiO2为混晶TiO2。如 图3 中 棉 织 物 的XRD 图 所 示,2θ在14.9°、16.6°、22.65°和34.4°出现的衍射峰对应的晶面为纤维素的(101)、(110)、(002)和(040)[18]。如图3中TiO2‐0.3 棉织物的XRD 图所示,既出现了棉织物的特征峰又出现了TiO2的特征峰,这说明自分散反应性TiO2成功地负载到棉织物上。

图3 处理样品X 射线衍射图
2.4 表面形貌观察
图4 为棉织物处理前后的SEM 照片。图4(a)为棉织物的SEM 照片,原棉织物呈现扁平带状,有转曲,表面光滑无颗粒附着。图4(b)为TiO2‐0.3 棉织物的SEM 照片。由图4 可知,TiO2‐0.3 棉织物表面附着了一些颗粒状物质,可以判断TiO2已经负载在棉纤维上。由于自分散反应TiO2表面带有磺酸基阴离子,能够产生静电斥力,且颗粒之间存在空间位阻,从而均匀分散在水中,导致了TiO2能够均匀地负载在棉织物上。

图4 棉织物的SEM 照片
2.5 元素组成分析
图5 为棉织物和TiO2‐0.3 棉织物的X 光电子能谱(以下简称XPS)图。由图5 可知,棉织物由C 和O 组成,而TiO2‐0.3 棉织物含C、O、Ti、N,其中Ti 分 别 来 自 于TiO2,N 来 自 于SAT 和KH‐550,进一步说明自分散反应性TiO2成功负载到棉织物上。
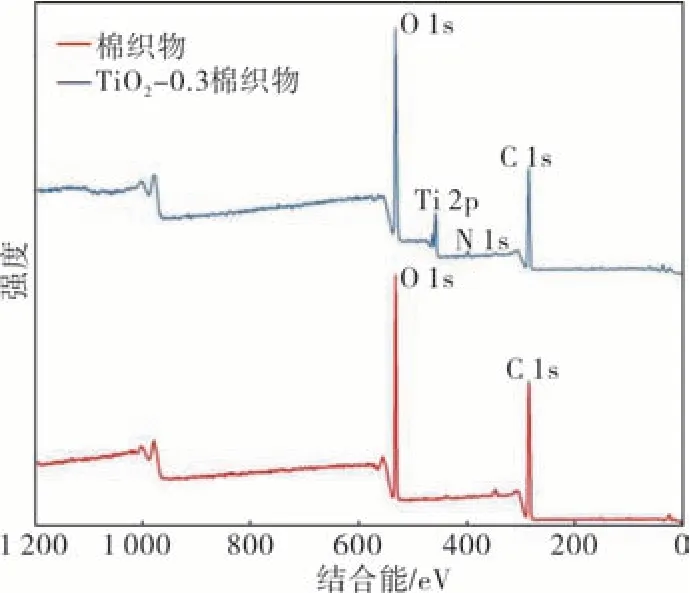
图5 棉织物X 光电子能谱图
2.6 光学性能分析
棉织物的紫外线可见光漫反射光谱如图6 所示。由图6 可知,棉织物基本不吸收光,而经过自分散反应性TiO2整理的棉织物对200 nm~360 nm 范围内的紫外线具有一定的吸收作用,且随着自分散反应性TiO2整理量的增加,对紫外线的吸收强度增加。

图6 棉织物的紫外线可见光漫反射光谱图
2.7 防紫外线性能分析
棉织物的UVA 透过率、UVB 透过率和UPF如表2 所示。由表2 可知,经过自分散反应性TiO2整理的棉织物UVA 和UVB 透过率都明显低于原棉织物,说明UVA 和UVB 较难穿透整理后的棉织物。原棉织物的UPF为5.95,防紫外线性能很差,负载自分散反应性TiO2棉织物的防护系数UPF远远大于原棉织物,说明经过自分散反应性TiO2整理的棉织物获得优异的紫外线防护性能,并且随着自分散反应性TiO2整理量的增加,棉织物UPF增加,防紫外线性能提高。

表2 棉织物的防紫外线性能
2.8 自清洁性能分析
滴有甲基橙溶液的棉织物经氙灯照射不同时间后的外观如图7 所示。由图7 可知,在原棉织物上滴一滴甲基橙溶液后放在氙灯下曝晒24 h 后,甲基橙溶液的颜色有了轻微的变淡,但不明显。而经自分散反应性TiO2整理的棉织物,在24 h 曝晒之后,相比最初已经出现了明显的变淡,说明自分散反应性TiO2对棉织物整理可以赋予其自清洁性能。其中,0.3 g 自分散反应性TiO2整理的棉织物照射约20 h 后,颜色基本消失,展现出相对较好的光催化自清洁效果。

图7 滴有甲基橙溶液的棉织物外观
3 结论
首先利用硅烷偶联剂KH‐550 对TiO2进行改性,然后进一步利用SAT 改性,得到自分散反应性TiO2。制备的自分散反应性TiO2具有良好的分散性,Zeta 电位为-35 mV。经过1 个月静置储存后仍保留较好的分散效果,Zeta 电位为-32.1 mV。通过浸染法将自分散反应性TiO2负载到棉织物上,整理后的棉织物获得了优异的防紫外线和自清洁性能。其中,用0.3 g 自分散反应性TiO2整理的棉织物具有更好的防紫外线和自清洁性能,UPF为62.07,经过24 h 光照后可以完全降解甲基橙污渍。
