伊蚊5-HT受体家族生物信息学分析和时空表达谱的构建
2021-10-14李妙珍李奕勋廖承红
李妙珍,李奕勋,陈 静,张 磊,廖承红,韩 谦
(海南大学 生命科学与药学院/热带动物医学与病媒生物学实验室,海口 570028)
5-羟色胺(5-hydroxytryptamine,5-HT)又称血清素,是广泛分布于脊椎动物和无脊椎动物的中枢神经系统和外周神经组织中的一种重要的神经递质[1]。5-HT通过与5-HT受体(5-hydroxytryptamine receptor,5-HTR)结合调控许多重要的生理和行为过程,如运动[2]、繁殖[3]、性活动、进食[4]、情绪和感情[5]、睡眠[6]、食欲等[7]。5-HT受体分型复杂,至少有7大类14种亚型在人类基因组中被发现,除5-HT3受体是配体门控离子通道外,其余5-HT受体都是G蛋白偶联受体。根据保守的氨基酸序列和第二信使激活系统,昆虫的5-HT受体可分为5-HTR1、5-HTR2和5-HTR73种[1]。
5-HT和5-HTR在昆虫的免疫系统中发挥关键的调节作用,研究发现菜青虫中的(Pieris rapae)5-HTR1B和5-HTR2B能介导5-HT引起的血细胞吞噬作用[8],该研究在分子水平上证实了昆虫也与哺乳动物一样,可以通过5-HT来调节神经系统与免疫系统的相互作用,为利用5-HT类药物特异性干扰昆虫免疫系统,增强生物杀虫剂效力提供了可能性。研究还发现通过激活神经元释放出的大量的5-HT,会抑制黑腹果蝇(Drosophila melanogaster)的进食和交配行为[4]。同样,在蜜蜂(Apis mellifera)大脑中注射5-HT,其进食行为受到抑制,但是在肠道中注射5-HT则会刺激肠道肌肉的收缩[9]。在埃及伊蚊(Aedes aegypti)中,使用CRISPR-Cas9技术敲除5-HTR2B会导致埃及伊蚊的生长抑制,并且减少成蚊的脂质积累[10]。目前,研究人员还对5-HTR1A的激动剂衍生物进行设计、合成和生测,发现其能够影响昆虫的生长和幼虫的活性[11],此结果更加表明了5-HT受体可作为有害昆虫的药物靶标。随着全球杀虫剂的滥用,传统小分子杀虫剂的耐药性成为控制节肢动物传播传染病的一个难题,需要具有新的作用方式和对抗性害虫种群活性的杀虫剂化学制剂作为替代。破坏节肢动物G蛋白偶联受体(GPCR)靶标的小分子杀虫剂逐渐成为人们关注的重点,将用于开发下一代杀虫剂[12−13]。
埃及伊蚊(Aedes aegypti)是基孔肯尼雅热、黄热病和登革热等急性传染病的主要传播媒介,每年会造成数亿人感染病毒[14],严重威胁人类健康。已有研究报道,埃及伊蚊吸血行为与5-HT的浓度有关[10]。目前,有关埃及伊蚊5-HT受体家族的功能与结构尚未分析透彻。本研究首先对文献已报道的昆虫5-HT受体蛋白进行生物信息学分析,然后采用多序列比对和系统进化树构建法对5-HT受体基因进行进化分析,最后对每个受体进行不同发育时期的表达谱分析,为埃及伊蚊5-HT受体蛋白的功能研究提供基础,进而为新型杀虫剂寻找靶标。
1 材料与方法
1.1 蚊虫来源埃及伊蚊(Rockfeller株)来自军事科学院军事医学研究院微生物流行病研究所。
1.2 埃及伊蚊5-HT受体基因家生物信息学分析通过比对NCBI和VectorBase 2个数据库序列,获取埃及伊蚊5-HT受体序列,并下载5-HT受体蛋白的氨基酸序列。利用TMHMM Server v2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)程序在线对蛋白序列进行跨膜结构预测;利用在线工具SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对埃及伊蚊5-HT受体蛋白的二级结构进行预测;使用Signal P 5.0在线软件预测埃及伊蚊5-HT受体的信号肽;使用在线软件Clustal Omega对不同昆虫的5-HT受体氨基酸序列进行多序列比对,用邻接法(Neighbor-Joining)对氨基酸序列构建进化树。Bootstrap设为1 000,其余参数采用默认设置,分析不同昆虫的5-HT受体的进化关系。
比较Protein Data Base数据库中已知5-HT受体蛋白的晶体结构,采用GeneDoc计算数据库序列相似性分析,发现埃及伊蚊5-HTR7B与已知人类5-HTR1B的序列相似性最高,为38.61%。利用SWISSMODEL(https://swissmodel.expasy.org/interactive),以Hsap5-HTR1B蛋白的晶体结构[15](PDB:V)为模板,构建埃及伊蚊5-HTR7B三级同源模型。
1.3 埃及伊蚊5-HT受体基因家族的表达谱构建(1)埃及伊蚊总RNA的提取。分别收集50只1龄幼虫,50只2龄幼虫,30只3龄幼虫,10只4龄幼虫,4只白色雌蛹,4只白色雄蛹,4只黑色雌蛹、4只黑色雄蛹,2只雄蚊,2只未吸血的雌蚊,实验重复3次;解剖20只未吸血雌蚊,分别收集其头、胸、腹、附肢4个部位,实验重复3次。采用Trizol法[16]提取埃及伊蚊不同样品的总RNA,用1%的琼脂糖凝胶电泳检测RNA的完整性,用微量核酸检测仪检测RNA浓度和纯度。(2)cDNA模板的合成。使用TAKARA逆转录试剂盒合成cDNA:gDNA Eraser Buffer 2.0 μL, gDNA Eraser 1.0 μL,Total RNA 1.0 μL,RNase Free dH2O 6.0 μL,混匀后,42 ℃反应2 min,转移至冰上,再加入PrimeScript RT Enzyme Mix 10.0 μL,RT Primer Mix 1.0 μL,5×PrimeScript Buffer 2 (for Real Time) 4.0 μL,RNase Free dH2O 4.0 μL,混匀,37 ℃反应15 min,85 ℃反应5 s,−20 ℃保存备用。(3)荧光定量PCR检测不同发育时期和不同组织中的表达量。采用荧光定量试剂盒(ROCHE)对各个基因进行qRT-PCR分析。反应体系为:实时荧光定量PCR预混液5 μL,上、下游引物各0.5 μL(10 μL·mL−1),模板cDNA 1 μL,ddH2O 3 μL。使用Roche公司的LightCycler96进行实时扩增检测。反应采用两步法PCR扩增标准程序:95 ℃ 20 s,95 ℃ 5 s,58 ℃ 30 s,共40个循环。以RPS17为内参基因[16],每个样品设置3次重复,实验所用引物见表1。

表1 荧光定量PCR引物Tab. 1 Primers for fluorescence quantitative PCR
1.4 统计学分析根据定量检测结果,以2−△△Ct法[17]计算样品间基因表达量的差异倍数,用Graphpad Prism 6.0软件T检验法进行数据的统计分析,用LSD法进行多重比较检验,显著性检验水平P< 0.05。
2 结果与分析
2.1 5-HT受体氨基酸序列分析及三级结构建模根据数据库数据分析,发现埃及伊蚊有5-HTR1A、5-HTR1B、5-HTR1D、5-HTR2B、5-HTR7A、5-HTR7B共3个5-HT受体家族6个亚基,TMHMM数据跨膜螺旋结构分析结果表明,它们均有7个跨膜区,属于典型的G蛋白偶联受体;利用SignalP 5.0在线软件预测埃及伊蚊5-HT受体蛋白的氨基酸序列[18],发现除5-HTR7B有可能存在SP信号肽外,其他亚基均不存在信号肽。表2结果表明,埃及伊蚊5-HT受体蛋白主要由α螺旋、延伸链以及无规则卷曲构成,并且还有少量的β-转角,其中α螺旋的比例非常高,约占二级结构组成原件的28.09%~47.64%,5-HTR7B的α螺旋比例最高,为 47.64%;5-HTR1D的α螺旋比例最低。每种受体蛋白都含有无规则卷曲,其中5-HTR1A的无规则卷曲比例为49.14%,是6种受体中比例最高的;5-HTR7B的无规则卷曲比例最少。在埃及伊蚊5-HT受体家族的二级结构中,β-转角的含量相对较少,其中5-HTR1B的β-转角比例最少,5-HTR1D的β-转角比例最高,为6.71%。

表2 埃及伊蚊5-HT受体蛋白二级结构的主要元件比例Tab. 2 The proportion of major secondary protein structure of 5-HT receptor protein in A. aegypti.
用Proteindatabase中已知Hsap5-HTR1B(图1-A)的晶体结构做为模板,根据SWISS-MODEL同源建模软件构建埃及伊蚊5-HTR7B(图1-B)的三级结构。其GMQE值为0.4,QMEAN值为−3.93,均在合理范围之内[19−20]。拉氏图是用来描述蛋白质结构中氨基酸残基二面角ψ和φ是否在合理区域的一种可视化方法,可以反映出蛋白质构象是否合理[21]。结果表明,埃及伊蚊5-HTR7B所有氨基酸都存在在绿色和浅绿色的允许区域,无氨基酸在白色不允许区域(图1-C),证明这些氨基酸残基具有较好的构象空间[22]。结合GMQE值、QMEAN值和拉氏图可知,所建模型合理[23−27]。同源建模结果显示,Aae5-HTR7B具有7个α螺旋,是典型的7次跨膜G蛋白偶联受体。与Hsap5-HTR1B相比,在α4~α7间的loop差别较大。应用Clustal Omega 软件[28]对埃及伊蚊5-HT受体基因家族成员完整ORF进行同源性和保守域比对,结果表明,埃及伊蚊5-HT受体基因家族之间相似性较低,其保守域的同源性约为40%(图2),主要集中在跨膜区。
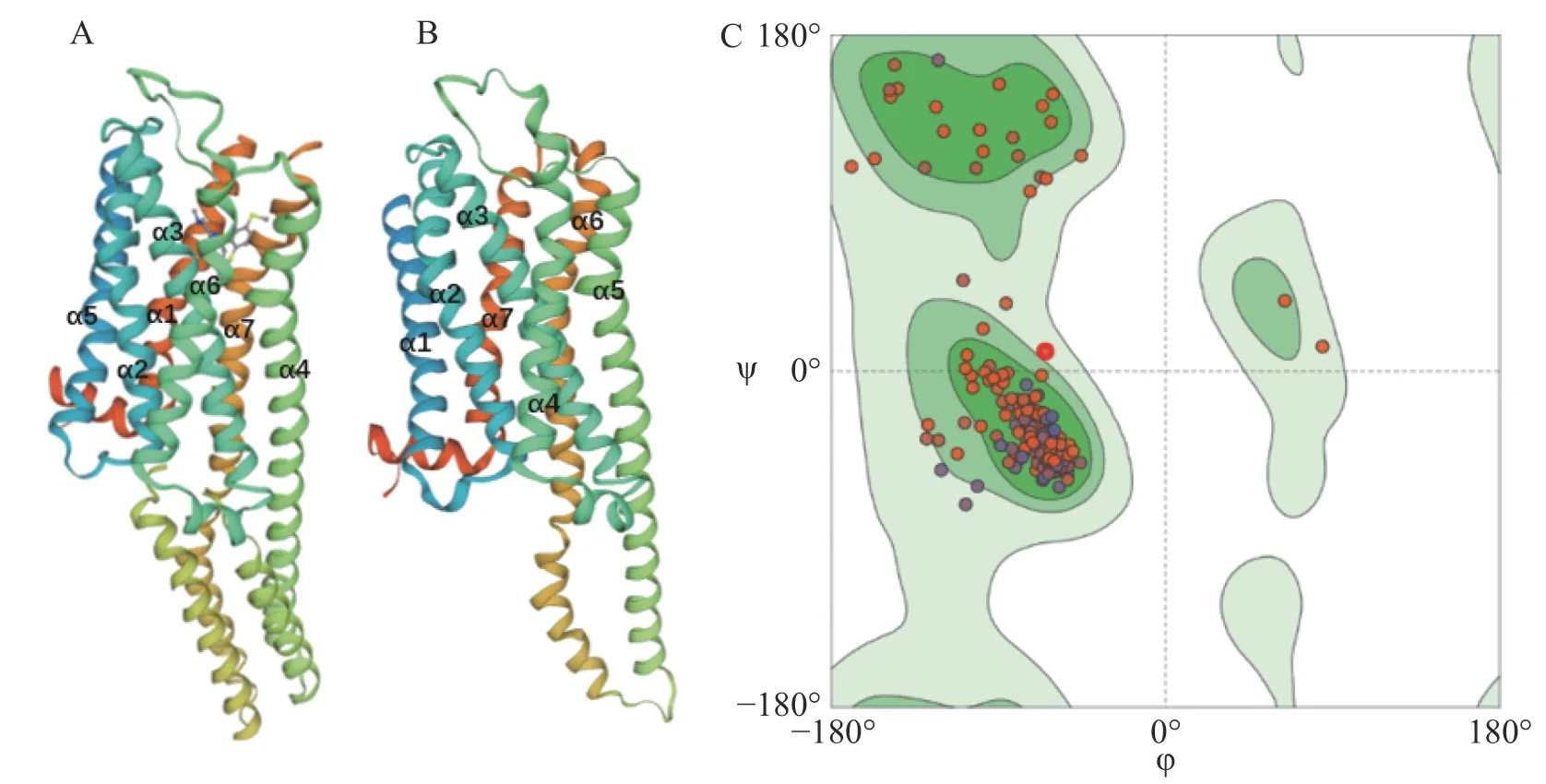
图1 埃及伊蚊5-HT受体蛋白的三级结构建模Fig. 1 Tertiary structure modeling of 5-HT receptor protein in A. aegypti

图2 埃及伊蚊5-HTR家族保守结构域序列比对Fig. 2 Alignment of conserved domains of 5-HT proteins family in A.aegypti
2.2 埃及伊蚊5-HT受体的系统进化分析利用MEGA7的邻接法对6个受体基因构建系统进化树(图3)。高粱蚜虫(Melanaphis sacchari)作为半翅目昆虫[29],与埃及伊蚊亲缘关系较远,因此,可以其作为外群构建系统进化树。结果表明,该进化树分为3个分支,Aae5-HTR1D与淡色按蚊的5-HTR1D在同一分支;Aae5-HTR1A与黑腹果蝇5-HTR1A为同一分支,其和致倦库蚊5-HTR2同源性较高;Aae5-HTR2B从黑腹果蝇5-HTR2B分支上演化而来,并且与Aae5-HTR1D更接近;Aae5-HTR7A、5-HTR7B受体与黑腹果蝇5-HTR7聚类为一支。
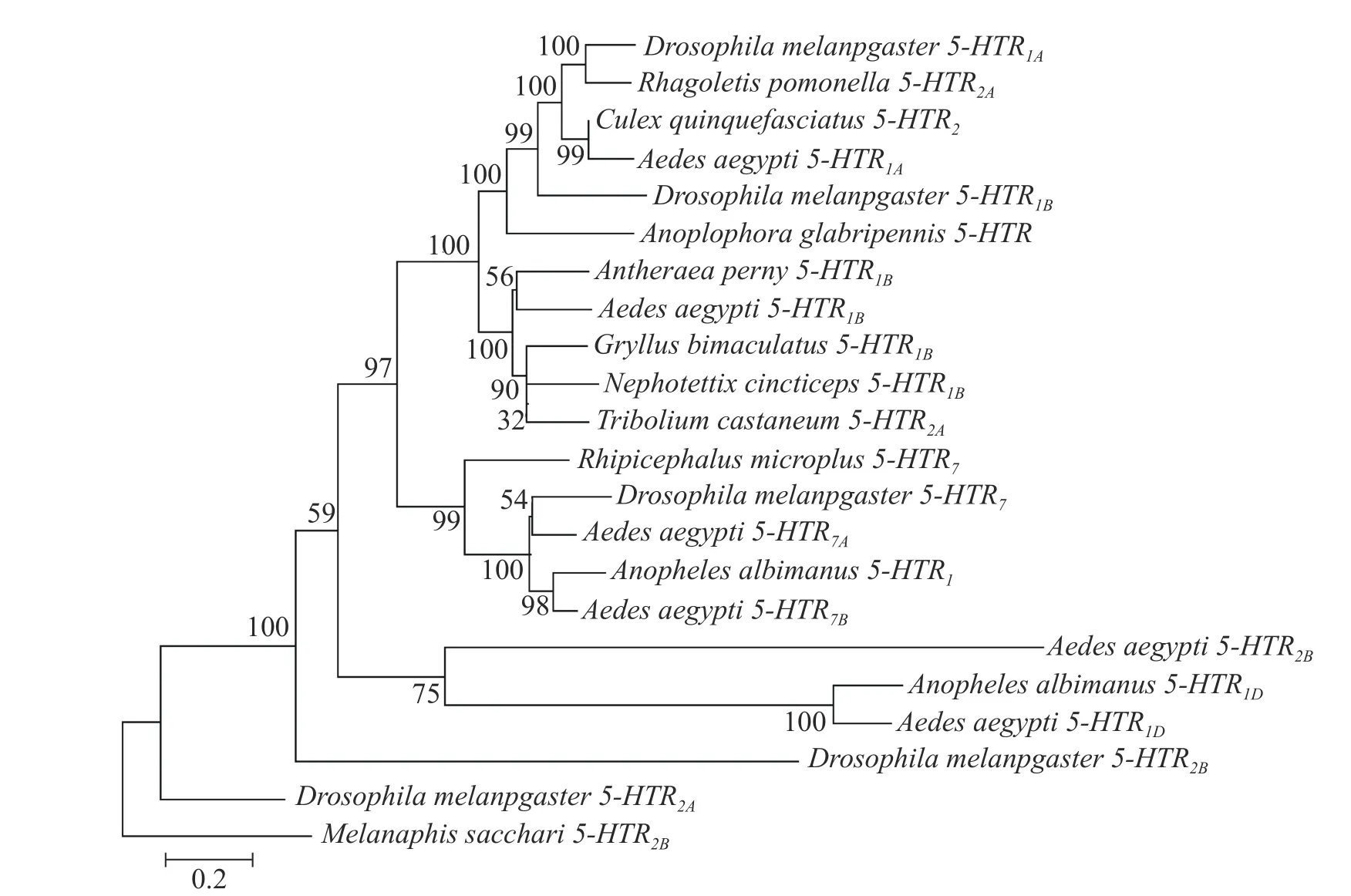
图3 埃及伊蚊5-HT受体蛋白系统进化树(Boostrap值为1 000)Fig. 3 Phylogenetic tree of 5-HT receptor proteins in A. aegypti
2.3 埃及伊蚊5-HT受体基因发育表达模式5-HT受体基因在各发育时期均有表达,如图4-A—4-E结果所示,5-HTR1A、5-HTR1B、5-HTR1D、5-HTR2B、5-HTR7A5个受体基因在1龄到4龄幼虫中表达水平较低,到蛹期有显著增加(P< 0.05),而5-HTR7B基因在1 ~4龄阶段,表达量与蛹期水平相近,随幼虫发育到成虫,表达量逐渐增高(图4-F)。结果同时表明,显示6个受体基因的表达在雌雄成体中具有明显的性别差异,所有的雄性成体的表达量均高于雌性成体(图5-A—5-F),这与家蚕的表达模式不同[30]。

图4 埃及伊蚊5-HT受体不同发育时期表达谱Fig. 4 Expression profile of 5-HT receptor in A. aegypti at different developmental stages
2.4 埃及伊蚊5-HT受体基因组织表达模式6个亚基在不同组织中的表达模式差异较大。Aae5-HTR1A在蚊虫头部的表达量最高,其次是胸腔,在腹部也有较少的表达量,但其在腿部并无表达(图5-A);Aae 5-HTR1B在头部有较高的表达丰度,但是在胸腔、腹部和附肢中表达量较少(图5-B);Aae5-HTR1D在各个组织中的表达量相比于其他受体是最低的,并且它是唯一只在胸腔和腹部表达的5-HT受体,其表达丰度最高的组织是胸腔,在腹部也有较少的表达量(图5-C);Aae5-HTR2B在头、胸、腹和附肢中均存在表达丰度,其中头部的表达量最高,腹部的表达量最少(图5-D);Aae5-HTR7A是唯一在附肢中具有高表达的受体,但其在头部中没有表达丰度,在腹部中存在较少的表达(图5-E);Aae5-HTR7B与Aae5-HTR2BD的组织表达丰度相似。
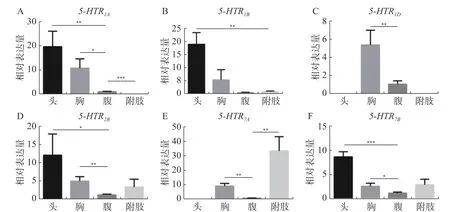
图5 埃及伊蚊5-HT 受体不同组织表达谱Fig. 5 Expression profile of 5-HT receptor in A. aegypti at different tissues
3 讨 论
本研究通过生物信息学方法分析了埃及伊蚊5-HT受体的结构,通过同源建模确定5-HT受体具有7个跨膜区,是典型的G蛋白偶联受体,并且跨膜区结构保守。该结果与果蝇、家蚕等昆虫的受体家族结构一致[30−31]。
不同的5-HT受体在昆虫体内分布不同,与5-HT结合在昆虫体内发挥的生理功能也不同[1]。有研究表明,Dm5-HTR1A、Dm5-HTR2A和Dm5-HTR7在头部表达,主要参与果蝇的短期学习和记忆[32];黑腹果蝇Dm5HT1A受体、Dm5HT1B受体和Dm5HT7受体在幼虫嗅觉选择行为及食欲和厌恶联想嗅觉学习和记忆中具调节性[33]。当黑腹果蝇5-HT受体缺失或表达下调的情况下,果蝇由于血细胞吞噬能力的降低从而在被病原菌感染后更容易死亡。本研究发现Aae5-HTR1A、Aae5-HTR1B、Aae5-HTR1D、Aae5-HTR7B在头部特异性高表达,而蚊虫头部具有很多气味性受体,因此,这4个受体可能与蚊虫的吸血、交配、寻找宿主等行为有关,但后续仍需对此进行验证。有研究报道Aae5-HTR2B基因被敲除后埃及伊蚊的生长和繁殖受到影响[10]。本研究还发现Aae5-HTR1D在头部和四肢中并无表达,但是在胸腔中具有显著性高表达,暗示其可能与胸腹部消化功能相关。而Aae5-HTR7A在头部没有表达,是唯一在四肢中特异性高表达的5-HT受体,蚊虫附肢中存在丰富的感受器,能感受外界环境的气味以及环境的温湿度/盐度,因此,推测该受体可能参与外界温湿度或者气味的感知[34]。通过构建埃及伊蚊5-HT受体基因家族时空表达谱还发现,埃及伊蚊5-HT受体在蚊虫的各个时期都有表达,说明5-HT受体在埃及伊蚊的整个生活史中均发挥作用,可能是蚊虫基本生理活动必需的。其中,Aae5-HTR1D、Aae5-HTR1B、Aae5-HTR7A在幼虫阶段的表达较低,但是在蛹期和成蚊期表达量高,暗示这些受体可能主要与蚊虫的幼虫后期发育及成体的生理功能有关。
目前研究认为,在昆虫体内5-HT作为重要的神经递质,对昆虫的生长发育以及行为活动等方面都具有许多重要作用,而其发挥作用主要通过分布在体内不同位置的受体介导。因此,通过对埃及伊蚊5-HT受体家族的序列分析和表达谱构建,进而进一步研究其功能,将对探索控制蚊虫及传播病原寻找新型药物提供新的思路。
