NdCl3-AlCl3-NH4HCO3体系稀土沉淀热力学分析
2021-10-14林春雷徐略渭何秉轩
王 强,林春雷,徐略渭,何秉轩,梁 勇
(1.赣州稀土龙南冶炼分离有限公司,江西 赣州 341000;2.江西理工大学 材料冶金化学学部,江西 赣州 341000)
稀土氧化物的生产通常采用酸溶—萃取—沉淀—煅烧工艺处理稀土精矿。沉淀过程中,通常选择碳酸氢铵或草酸作沉淀剂。其中,碳酸氢铵沉淀法成本低、操作简单[1-4];但以碳酸氢铵沉淀稀土时,常出现杂质铝共沉淀问题[5-8]。为了解碳酸氢铵沉淀稀土过程中杂质铝的行为,以钕为例,根据相关热力学数据,分析了NdCl3-AlCl3-NH4HCO3体系中碳酸氢铵沉淀稀土时各组分的行为,以期为稀土沉淀过程优化提供一定参考。
1 NdCl3-AlCl3-NH4HCO3体系中的平衡关系
根据热力学数据,NdCl3-AlCl3-NH4HCO3体系中可能存在的平衡关系及平衡常数(K)见表1。

表1 NdCl3-AlCl3-NH4HCO3体系中的平衡关系及平衡常数(K)
由表1看出:当总碳(C总)浓度为1.0 mol/L、总铝(Al总)浓度为7.5 mmol/L、总钕(Nd总)浓度为1.0 mol/L条件下,NdCl3-AlCl3-NH4HCO3体系中游离物质平衡关系满足以下系列方程。


(1)
(2)

(3)
c(Nd总)=c(Nd(OH)3(aq))+c(Nd(OH)2+)+c(Nd3+)=1.0 mol/L。
(4)
(5)
(6)

(7)

(8)
(9)

(10)
(11)
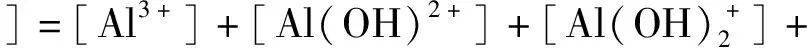

7.5 mol/L。
(12)
由表1看出,不同pH条件下,沉淀情况不同:酸性条件下,首先生成Nd2(CO3)3沉淀;随pH增大,开始生成Al(OH)3沉淀,然后生成Nd(OH)3沉淀,最后发生Al(OH)3的溶解与Nd2(CO3)3的转变。
当有Nd2(CO3)3生成时,由表1式a可得:
(13)
当体系中Al(OH)3沉淀稳定存在时,根据表1式c可得:

[Al3+][OH-]3=10-32.89。
(14)
当体系中开始生成Nd(OH)3沉淀时,由表1式b可得:

[Nd3+][OH-]3=10-21.49。
(15)
所以,在pH<2.8条件下,体系内无沉淀生成;pH在2.8~3.7范围内,开始有Nd2(CO3)3沉淀生成;pH在3.7~7.0范围内,Al(OH)3与Nd2(CO3)3共沉淀;pH在7.0~11.7范围内,体系中同时存在Nd2(CO3)3、Al(OH)3、Nd(OH)3沉淀,但Al(OH)3开始逐渐溶解;pH继续提高至11.7~12.4范围内,Nd2(CO3)3与Nd(OH)3同时存在;pH高于12.4后,体系中仅有Nd(OH)3沉淀。根据这些数据,绘制出25 ℃条件下NdCl3-AlCl3-NH4HCO3体系溶解组分lgcB-pH曲线,如图1所示。

图1 20 ℃ 条件下,NdCl3-AlCl3-NH4HCO3体系各组分的lg cB-pH曲线
由图1看出,体系中C总浓度为1.0 mol/L时,随pH增大,体系共有6个沉淀阶段:线①为生成Nd2(CO3)3沉淀的界限,此处pH=2.8;线②为Al(OH)3开始沉淀的界限,此处pH=3.7;线③为生成Nd(OH)3沉淀的界限,此处pH=7.0;线④为Al(OH)3完全溶解的界限,此处pH=11.7;线⑤为Nd2(CO3)3完全转变的界限,此处pH=12.4。
pH在0~2.8之间,主要发生游离组分之间的转变,溶液中Nd3+和Al3+的浓度不随pH增大而发生变化,表明该pH范围内无沉淀产生。pH增大至2.8,溶液中Nd3+浓度逐渐降低,Al3+浓度保持不变,表明只有Nd2(CO3)3一种沉淀;当pH增大至3.7时,Al3+浓度开始下降,以Al(OH)3形式与Nd2(CO3)3共沉淀;当pH达到7.0~11.7范围时,同时存在Al(OH)3、Nd2(CO3)3、Nd(OH)3沉淀,且Al(OH)3逐渐发生反应

同理,可以绘制出25 ℃条件下,总碳浓度分别为0.5、1.0、1.5、2.0 mol/L时,钕和铝的lgcB-pH关系曲线,如图2所示,图中实线表示溶液中Nd总浓度,虚线表示溶液中Al总浓度。

图2 不同总碳浓度对溶液中的总钕、总铝浓度的影响

2 结论
根据热力学数据,分析NdCl3-AlCl3-NH4HCO3体系平衡关系,可以得出:25 ℃条件下用碳酸氢铵沉淀稀土,在总碳浓度为1.0 mol/L时,控制pH在2.8~7.0范围内,均沉淀Nd2(CO3)3;但pH在3.7~7.0范围内,铝易以Al(OH)3形式与碳酸稀土共沉淀。所以,在用碳酸氢铵沉淀稀土时,预先除铝可获得高质量碳酸稀土沉淀。
