重瓣红玫瑰花渣总黄酮的提取及体外活性研究
2021-10-14张胜楠李荣乔
张 璐,刘 京✉,李 锦,张胜楠,李荣乔
(石家庄以岭药业股份有限公司,河北 石家庄 050035)
玫瑰(Rosa rugosaThunb.)属蔷薇目蔷薇科落叶性灌木,在我国具有悠久的栽培历史,目前在全国各地均有种植,其中以华北、西北、西南等地为主[1-2]。山东平阴县是中国最大的玫瑰花种植基地,玫瑰花资源十分丰富,其“平阴重瓣红玫瑰(Rose rugosa cv. Plena)”是原国家卫生部于2010 年认证的新资源食品和药食同源品种,在食品、医药等领域有着广阔的应用前景[3-4]。
重瓣红玫瑰花在提取玫瑰精油后剩余大量的固体花渣,这些花渣的营养成分丰富,但目前生产中大部分作为废弃物直接处理掉了,这不仅污染了环境,也是对资源的浪费[5-6]。研究发现,玫瑰精油的提取只是将玫瑰花的香气等可挥发性成分提取出来,而其他(如蛋白质、膳食纤维、矿物质、多酚类和黄酮类等)非挥发性成分都留在了提取后剩余的花渣中,具有很高的再利用价值[7-10]。因此,提取玫瑰花渣中的功效成分,提高花渣的再利用率具有重要的研究意义和应用前景。
目前,关于玫瑰花中功能性成分开发较多[11-12],但是从花渣中提取功能性成分的研究报道较少。玫瑰花渣成分复杂,含有多酚类、黄酮类等多种化学成分,具有减少和消除自由基、抗氧化活性、抗血栓、抗癌、抗炎、抗菌、免疫调节、降血脂和预防心脏病等生理活性[13-15]。同时,玫瑰花渣中还含有蛋白质、VC和膳食纤维等多种营养成分,其中所含氨基酸中必需氨基酸所占比例较高,所含不饱和脂肪酸中亚油酸所占比例较高,总脂肪含量较低[7,9]。在花渣成分提取技术研究中,主要的提取方法有溶剂提取法[10,16]、碱提取[17]、加热提取[18]、酶辅助提取[19]、微波辅助提取[20]、超声波辅助提取[21-22]等。超声辅助提取法在多酚提取中表现出较高的提取效率,近年来被广泛应用于植物源化合物的提取。谢琼等[23]用超声提取了玫瑰花渣中的总黄酮,确定了超声提取的最佳工艺条件。张佳婵等[8]采用醇提法提取了玫瑰花和花渣中的黄酮成分,所得黄酮冻干粉对羟自由基、ABTS+自由基和DPPH 自由基均具有清除能力。马猛华等[9]提取了玫瑰花渣中的多糖和黄酮类化合物,优化了各自的提取工艺。
目前研究较多的是大马士革玫瑰花渣、苦水玫瑰花渣等的成分提取及其功能性分析,而对于重瓣红玫瑰花渣的研究相对较少[21,24-26]。基于此,本项目以重瓣红玫瑰花精油提取后产生的玫瑰残渣废弃物为原料,研究其中黄酮类化合物的提取工艺,同时考察黄酮类化合物的抗氧化活性和抑菌活性,以期为提高重瓣红玫瑰花的综合利用价值提供一定的理论基础。
1 材料与方法
1.1 实验材料
重瓣红玫瑰花渣:山东省平阴玫瑰精油生产基地;芦丁标准品(HPLC≥98%):北京索莱宝科技有限公司;DPPH(纯度>96%)、ABTS(纯度>98%):上海麦克林生化科技有限公司;羟自由基测试盒:南京建成生物工程研究所;氢氧化钠、过硫酸钾、硝酸铝、无水乙醇、亚硝酸钠,均为分析纯:国药集团化学试剂有限公司。
指示菌:金黄色葡萄球菌Staphylococcus aureusATCC 25923、蜡样芽孢杆菌Bacillus cereusATCC 11778、大肠杆菌Escherichia coliATCC 44752:河北科技大学酶工程实验室保存。
1.2 仪器与设备
紫外可见分光光度计(Evolution 220):美国Thermo 公司;全自动菌落计数仪(Scan-1200):法国Interscience 公司;超净工作台(SW-CJ-1FD):苏州安泰空气技术有限公司;恒温培养箱(SPX-150)、水浴恒温震荡器(SHZ-A)、数显鼓风干燥箱(GZX-9140MBE):上海博讯实业有限公司;电子天平(JJ-1000):常熟市双杰测试仪器厂;恒温摇床(ZHWY):上海智城分析仪器制造公司;牛津杯(内径6.0 mm,外径7.8 mm):武汉药科新技术开发公司;离心机(4-16KS):德国Sigma 公司。
1.3 实验方法
1.3.1 样品预处理
玫瑰花固体渣放置于40 ℃烘箱内恒温干燥4 h,烘干后粉碎,将所得粉末状样品后,低温密封保存备用。
1.3.2 黄酮标准曲线的绘制
本试验以芦丁为标准品对玫瑰花渣中总黄酮含量进行测定。配置不同浓度的芦丁溶液,利用亚硝酸钠、硝酸铝、氢氧化钠等试剂与芦丁标准品溶液进行反应,利用紫外分光光度计在510 nm处测得吸光值,并以吸光值为纵坐标,芦丁浓度为横坐标做标准曲线。
1.3.3 玫瑰花渣中总黄酮提取条件的优化
1.3.3.1 乙醇浓度的优化 准确称取重瓣红玫瑰花渣粉1.0 g,按照1∶15 的料液比,分别溶于体积分数为55%、60%、65%、70%、75%的乙醇溶液中,于40 ℃、120 r/min 水浴震荡1.5 h,离心除蛋白后得到样品,按照标准曲线方法进行操作,测定黄酮含量。
1.3.3.2 提取时间的优化 准确称取玫瑰花渣粉1.0 g,按照料液比1∶15 溶于体积分数60%的乙醇,将溶解好的溶液置于恒温震荡器中40 ℃、120 r/min 水浴震荡,设置时间为0.5、1.0、1.5、2.0、2.5 h,离心除蛋白后得到样品,按照标准曲线的测定方法测定黄酮含量。
1.3.3.3 提取料液比的优化 准确称量玫瑰花渣粉1.0 g,分别按照料液比为1∶15、1∶20、1∶25、1∶30、1∶35 溶解于体积分数为60%的乙醇,将溶解好的溶液置于恒温震荡器中,40 ℃、120 r/min水浴震荡1.5 h,离心除蛋白后得到样品,按照标准曲线的测定方法测定黄酮含量。
1.3.3.4 提取温度的优化 准确称取玫瑰花渣粉1.0 g,按照料液比为1∶30 的比例,溶于体积分数为60%的乙醇,分别置于40、50、60、70、80、90 ℃恒温震荡器,水浴震荡提取1.5 h,离心除蛋白后得到样品,按照标准曲线方法测定黄酮含量。
1.3.4 玫瑰花渣中总黄酮超声波辅助提取条件的正交实验
采用L25(56)正交实验对玫瑰花渣中总黄酮提取条件进行优化,确定最佳的提取工艺条件。正交表如表1 所示:
1.3.5 玫瑰花渣总黄酮的抗氧化性的测定
1.3.5.1 对 DPPH·自由基的清除效率 参照Ravindran 等[27]的方法,将上述条件下得到的黄酮提取液,稀释5 个合适梯度,分别对不同浓度的样品进行一组实验:在第一只试管中加入1 mL黄酮提取液和3 mL、50 µg/mL 的DPPH 溶液,充分混匀后于室温下避光反应30 min;在第二只试管中加入1 mL 黄酮提取液和3 mL 无水乙醇;在第三只试管中加入1 mL 无水乙醇和3 mL 的DPPH 溶液。蒸馏水调零后,于517 nm 下测定每组三支试管的吸光值,分别将吸光值记作Ac、Ad、Ak。按照公式(1)计算黄酮提取液对DPPH·自由基的清除率:
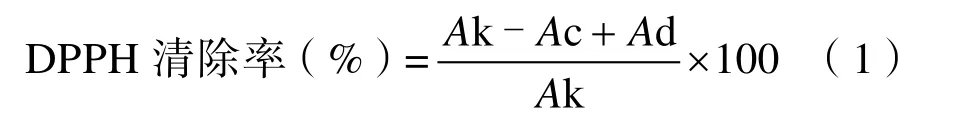
1.3.5.2 对ABTS+自由基的清除效率 参照Yan等[1]的方法,将7 mmol/L 的ABTS 和2.45 mmol/L的过硫酸钾按照1∶1(v/v)均匀混合后,室温下避光放置24 h 备用。用95%乙醇溶液稀释配置好的ABTS 溶液至波长734 nm 处的吸光度值在(0.7±0.02) nm 内,作为 ABTS+测定溶液。取制备好的黄酮提取液进行试验:0.4 mL 待测样液,加入ABTS+测定溶液3.6 mL,静置5 min,于734 nm波长处测定吸光度。按照如下(2)公式计算黄酮提取液对ABTS+自由基的清除率:

式中:Amax 为ABTS+测定溶液的吸光值;As 为样品管的吸光值。
1.3.5.3 对羟自由基清除效率 将提取后的黄酮提取液使用羟自由基测定试剂盒进行羟自由基(·OH)清除率的测定,将所得结果代入(3)公式,计算的羟自由基清除率:
抑制羟自由基能力(U/mL)=

式中:标准品浓度为8.824 mmol/L,取样量为1 mL,n 为样品测试前稀释倍数。
1.3.6 玫瑰花渣总黄酮的抑菌性研究
采用牛津杯扩散法[28],选用金黄色葡萄球菌Staphylococcus aureusATCC 25923、蜡样芽孢杆菌Bacillus cereusATCC 11778、大肠杆菌Escherichia coliATCC 44752 为指示菌进行抑菌实验。将指示菌的菌悬液(108CFU/mL)按照1%的添加量加入到与营养琼脂培养基中,倾倒灭菌平板,在平板的牛津杯中添加50 µL 玫瑰花渣的黄酮提取液,预扩散后恒温培养箱培养,抑菌圈测量仪测定抑菌圈直径。
1.4 数据分析
每个实验组设三个平行,数据采用Microsoft Office Excel 2007 进行处理,正交设计助手专业版V3.1 破解绿色版对数据进行分析。
2 结果与分析
2.1 玫瑰花渣中总黄酮提取条件的优化
2.1.1 乙醇浓度对玫瑰花渣中黄酮提取的影响
不同浓度乙醇提取重瓣红玫瑰花渣中黄酮结果见图1。图1 结果显示,随着乙醇浓度的提高,黄酮提取量先增大后减小,这可能是因为乙醇浓度较大时,玫瑰花渣中的其他成分会被浸提出来从而影响了玫瑰黄酮的析出。在乙醇浓度为60%时黄酮含量最高,达到7.47 mg/g。周小琦[14]的实验结果为当乙醇浓度为65%时黄酮含量最高为3.68 mg/g。

图1 乙醇浓度对玫瑰花渣中黄酮提取的影响Fig. 1 Effect of ethanol concentration on the extraction of flavonoids from rose residue
2.1.2 提取时间对玫瑰花渣中黄酮提取的影响
不同提取时间对玫瑰花渣黄酮提取的影响见图2。由图2 结果可知,随着提取时间的增大,黄酮提取量先增大后减小,可能是随着时间的延长,花渣中其它杂质也会浸出,因此最佳提取时间为1.5 h,黄酮含量达到11.48 mg/g。

图2 提取时间对玫瑰花渣中黄酮提取的影响Fig. 2 Effect of extraction time on the extraction of flavonoids from rose residue
2.1.3 提取料液比对玫瑰花渣中黄酮提取的影响
不同提取料液比对玫瑰花渣中黄酮提取的结果见图3。由图3 可知,料液比为1∶30 的时候,黄酮的提取量最高,达到了15.83 mg/g,这可能是因为溶剂量大时,黄酮溶出的较多。因此,本研究选择重瓣红玫瑰花渣黄酮的最佳提取料液比为1∶30。

图3 料液比对玫瑰花渣中黄酮提取的影响Fig. 3 The effect of ratio of material to liquid on the extraction of flavonoids from rose residue
2.1.4 提取温度对玫瑰花渣中黄酮提取的影响
不同提取温度对玫瑰花渣黄酮影响的结果见图4。由图4 可知,黄酮提取量随温度的升高先增大后减小,可能温度过高会破坏黄酮结构,所以最适宜提取温度为80 ℃时,黄酮提取量达到22.43 mg/g。
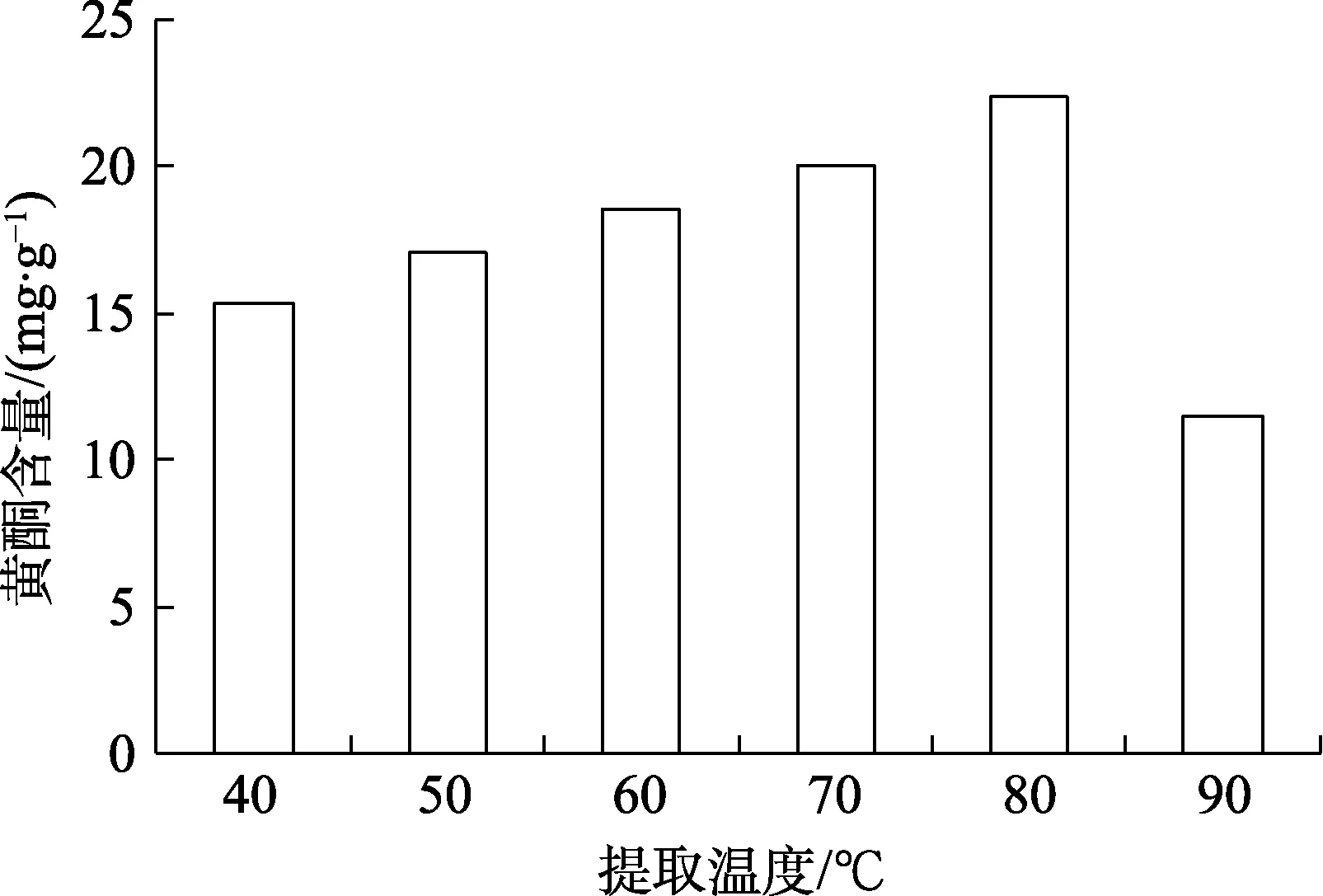
图4 提取温度对玫瑰花渣中黄酮提取的影响Fig. 4 Effect of extraction temperature on the extraction of flavonoids from rose residue
2.2 玫瑰花渣中总黄酮超声波辅助提取条件的优化
对超声辅助提取的提取条件进行正交试验优化,优化的结果见表2。由表2 结果可得出最优组合为A3B3C3,即超声处理时间为45 min、超声温度为60 ℃、超声功率为140 W,在此条件下黄酮含量达到58.53 mg/g。宋可珂[29]筛得最优提取妙峰山玫瑰黄酮条件下,含量达到66.040 mg/g。牛元[30]采用紫外分光光度计法测定黄酮含量,苦水玫瑰花蕾中黄酮含量为93.056 mg/g。
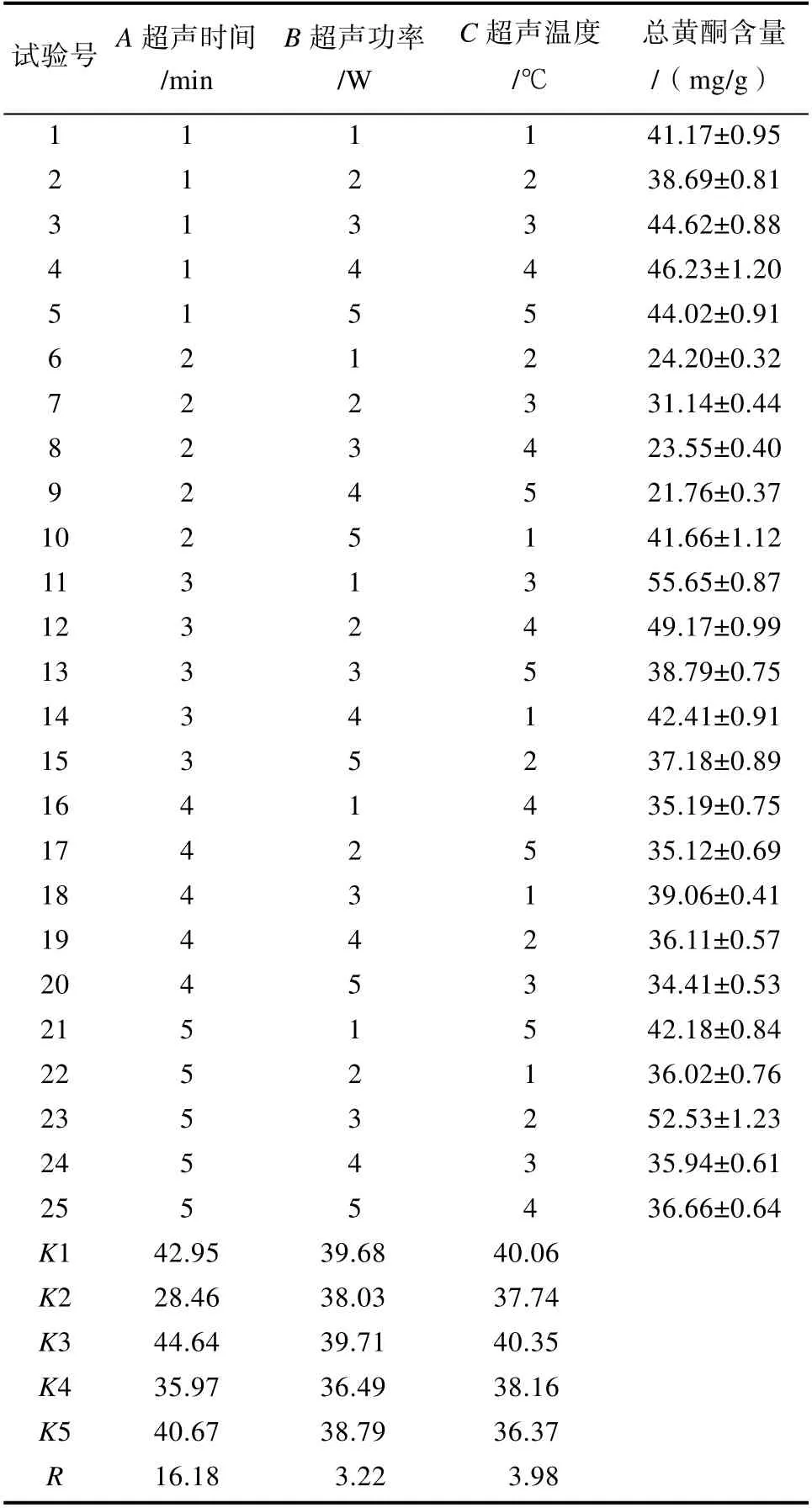
表2 正交优化实验结果Table 2 Results of orthogonal experiments
2.3 黄酮的抗氧化性的测定
2.3.1 黄酮对DPPH·自由基的清除效率
根据实验结果所得吸光值,代入计算公式,得到黄酮对于 DPPH·自由基的清除率最高为91.58%。杨虎[21]筛得最优提取玫瑰黄酮条件下,对DPPH·的清除率为88.28%。
2.3.2 黄酮对ABTS+自由基的清除效率
经计算,黄酮对 ABTS+自由基的清除率为73.71%。陆秀云[26]玫瑰废水中黄酮对ABTS+的最大清除率为98.96%。
2.3.3 黄酮对羟自由基清除效率
经计算,黄酮提取液对羟自由基的抑制能力为467.91 U/mL。
2.4 黄酮的抑菌性研究
由玫瑰花渣黄酮的抑菌实验结果见表3、图5。由表3、图5 可知,黄酮提取液对大肠杆菌没有明显的抑菌效果,对金黄色葡萄球菌和蜡样芽孢杆菌具有抑制性,尤其是对金黄色葡萄球菌的抑菌效果最好,其抑菌圈均大于14 mm。
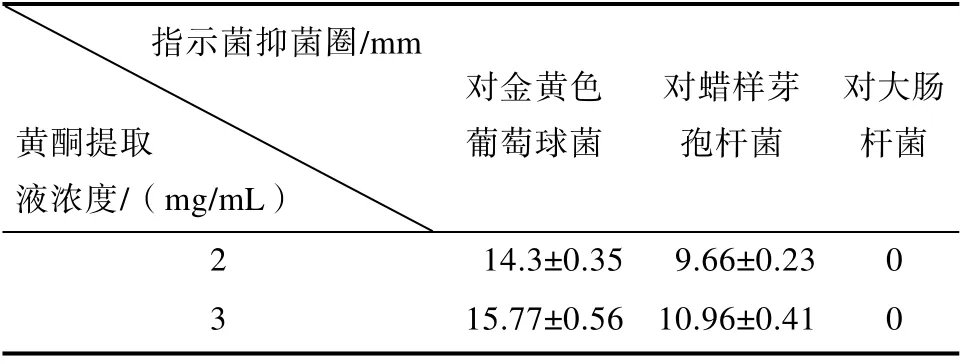
表3 黄酮提取液对细菌的抑菌圈Table 3 Bacteriostatic circle of flavonoid extract on bacteria

图5 黄酮提取液对蜡样芽孢杆菌(a)和金黄色葡萄球菌(b)的抑菌效果Fig.5 Antibacterial effect of flavonoid extract on A (Bacillus cereus) and B (Staphylococcus aureus)
3 结论
根据上诉实验结果,可以得到结论:经过优化后得到黄酮提取的最佳工艺为在乙醇浓度为60%、料液比1∶30,80 ℃水浴震荡1.5 h,超声处理45 min,超声功率140 W,超声温度60 ℃,此时的所得黄酮提取量为58.53 mg/g,超声法具有提取时间短、提取率高、溶剂需要量少等优点[23]。此时黄酮对DPPH·自由基的清除率为91.58%,对ABTS+自由基的清除率为73.71%,对羟自由基的抑制能力为467.91 U/mL,且对蜡样芽孢杆菌和金黄色葡萄球菌具有良好的抑制效果。
