蓝隐藻PC645的存在状态及其聚集态复合物的分离
2021-10-14王玉璇任慧慧郭志强
王玉璇,李 琴,王 静,张 昆,陈 敏,任慧慧,郭志强
(烟台大学生命科学学院,山东 烟台 264005)
隐藻(cryptophytes)是一类单细胞光合藻类[1],其光合色素除了普遍存在于光合放氧生物中的叶绿素(chlorophyll, Chl)a以及杂色植物特有的Chl c之外,部分种属中还发现存在藻胆蛋白,表明此类隐藻在进化上与含有藻胆蛋白为特征的红、蓝藻有着特殊联系[2]。目前认为,隐藻是以红藻和一种未知的宿主为前体,经二次内共生后产生的次级真核自养生物[3-5],其藻胆蛋白的β亚基来源于红藻,但其α亚基的进化来源至今不明[6-7],是极为特殊的一类藻胆蛋白类型。迄今为止已发现的隐藻藻胆蛋白有8种[8-9],但与红、蓝藻中存在的藻胆蛋白不同:一种隐藻中只含有一种藻胆蛋白,或藻红蛋白(phycoerythrin,PE) 或藻蓝蛋白(phycocyanin,PC),不含别藻蓝蛋白(allophycocyanin,APC)[10];隐藻的藻胆蛋白不构成藻胆体样的组装结构;且其基本构成单元为异二聚体(α1β)(α2β),而非红、蓝藻藻胆蛋白的三聚体或六聚体;最为特殊的是,隐藻藻胆蛋白的存在位置不是贴附在叶绿体类囊体膜的外表面,而是存在于类囊体膜腔内部[11]。至于其在膜腔中的存在状态,目前众说纷纭。有报道认为是紧密结合于类囊体膜的内表面[12];有的认为组装成棒状结构横跨类囊体腔,两端与膜组分相接触[13];或一部分结合于膜表面,一部分散布于膜腔中[12,14]。最新的隐藻光合系统结构模型显示,隐藻藻胆蛋白是以游离的方式密集填充于类囊体膜腔[15],认为隐藻藻胆蛋白的异二聚体是稳定的、唯一的存在状态,不形成更高级的聚合形式,与膜上的Chl-蛋白复合物之间也没有倾向性的结合关系[16-17]。但在实验室的前期工作中,我们曾在充分洗涤后的类囊体膜上观察到藻蓝蛋白的存在[18],并分离到PC-Chl a/c-蛋白复合物[19],早期也有分离到与膜紧密结合的PE-Chl-蛋白复合物的报道[14],此外,还发现蓝隐藻的藻胆蛋白PC645在溶液中的存在状态并非均一的(结果未报道)。显然,隐藻藻胆蛋白在类囊体膜腔中的存在状态、自我组装形式以及与膜的结合关系,都还有待于更多的实验证据。本研究以含有藻蓝蛋白的蓝隐藻为材料,从未处理的细胞破碎液中,分离PC645及其可能存在的聚合或结合形式,分析、比较其聚合状态与分离条件的关系,进而探究隐藻藻蛋白的天然存在形态,为后续结构及功能研究提供理论依据。
1 材料与方法
1.1 不同存在形式的PC645的分离
蓝隐藻(Chroomonasplacoidea)的培养、收集和细胞破碎条件参照前期文献[20],新鲜藻液破碎后,以50 mmol/L pH 7.0的磷酸盐(PBS)缓冲液(K2HPO4·3H2O 、NaH2PO4·2H2O)配制的蔗糖溶液进行密度梯度离心分离,采用的不连续梯度从上至下设计为:0.4 mol/L 1.0 mL、0.5 mol/L 2.0 mL、0.6 mol/L 1.0 mL、0.8 mol/L 1.0 mL、1.0 mol/L 1.0 mL、1.5 mol/L 4.0 mL,每管上样量为2.0 mL。在25 ℃,30 000 r/min (BECKMAN Optima LXP制备型超速离心机,SW 41 Ti Rotor)的条件下分别离心2、4、6、8、12、22 h后,离心管取出拍照。
1.2 PC645的分离和纯化
参照文献[21]分离纯化PC645,利用TU-1900紫外-可见分光光度计测定光吸收值,收集A645/A280≥7的PC645洗脱成分。
1.3 藻蓝蛋白大分子复合的相对定量分析
取纯化后(A645/A280≥7)的藻蓝蛋白,采用pH 7.0、50 mmol/L的PBS缓冲液调整浓度至A645=5.0,经660倍稀释后,使其在580 nm激发光下的660 nm发射峰的相对荧光强度小于1000(落在BandⅡ藻蓝蛋白相对荧光强度范围内),将此稀释度的纯藻蓝蛋白PC645的相对浓度作为1.0,再将其进一步稀释为原来0.75,0.56,0.42,0.32,0.24,0.18倍,以相对浓度(相对稀释度)为横坐标,660 nm相对荧光发射强度为纵坐标做标准曲线,分析相对荧光强度与PC645相对含量的线性关系。
1.4 pH对藻蓝蛋白复合物的影响
1.4.1 破藻时PBS缓冲液pH对藻蓝蛋白复合物含量的影响 分别在pH 4.92、5.91、6.47、6.98、8.04、8.67的66.7 mmol/L的PBS缓冲条件下破碎藻体细胞藻,破碎液均以pH 7.0,浓度为300 mmol/L 的PBS缓冲液配制的蔗糖溶液进行蔗糖密度梯度离心(梯度分布同1.1)6 h,每管上样量为2.0 mL。离心管取出拍照。
1.4.2 PBS缓冲液的pH对分离条件的影响 分别使用pH为4.92、5.91、6.47、6.98、8.04、8.67的66.7 mmol/L的PBS缓冲液配制蔗糖梯度溶液,均使用pH 6.98、66.7 mmol/L的PBS缓冲液配制蔗糖密度梯度(梯度分布同上), 每管上样量为2.0 mL。超速离心6 h后取出离心管拍照。
1.5 磷酸盐缓冲液浓度对藻蓝蛋白复合物的影响
1.5.1 破藻时PBS缓冲液的浓度对藻蓝蛋白复合物含量的影响 分别采用50、100、200、300、400、500 mmol/L的pH 7.0的PBS缓冲条件下破藻,以300 mmol/L的pH 7.0的PBS缓冲液配制蔗糖溶液(梯度分布同1.1),每管上样量为2.0 mL。超速离心6 h后取出离心管拍照。
1.5.2 PBS缓冲盐的浓度对藻蓝蛋白复合物分离条件的影响 采用50 mmol/L、pH 7.0的PBS缓冲液破藻,分别使用50、100、200、300、400、500 mmol/L的pH 7.0的PBS缓冲液配置蔗糖溶液(梯度分布同1.1),每管上样量为2.0 mL。超速离心6 h后取出拍照。
1.6 光谱测定
将梯度离心后得到的各个条带分别取出,经50 mmol/L、pH 7.0的PBS缓冲液同倍数稀释后,采用LS55荧光分光光度计测定室温荧光光谱;TU-1900紫外-可见分光光度计测定吸收光谱。
2 实验结果
2.1 离心时间对藻蓝蛋白复合物分离的影响
由于采用速度离心法时,在其他条件一致的情况下,条带所处的具体梯度位置完全取决于离心时间。因此实验首先摸索了离心时间对分离效果的影响。压力破碎后的蓝隐藻细胞破碎液经过6 h以上的蔗糖密度梯度超离心后均可观察到3个条带,以离心22 h所得条带最为集中,且条带之间界限清晰(图1),从上至下依次称为BandⅠ、Ⅱ、Ⅲ。蓝色的BandⅠ除非离心22 h,否则通常位于0.4 mol/L蔗糖密度带,呈现出582 nm、625 nm和645 nm三个典型的PC645吸收峰和肩峰,以及370 nm左右的吡咯结构的吸收峰(图2);给予580 nm(对应藻蓝蛋白主要吸收区)激发光时产生660 nm PC645特征荧光发射峰。因此该条带应该是主要以小分子质量异二聚体形式存在PC645蛋白条带。当离心22 h,墨绿色的BandⅡ可迁移到1.0~1.5 mol/L的蔗糖密度带之间,其余离心时间下则主要分布于0.8~1.5 mol/L的蔗糖区域。其吸收光谱中的428 nm及677 nm吸收主峰来自Chl a;464 nm峰则源于Chl c;490~495 nm峰为类胡萝卜素的吸收,说明该条带中含有大量的叶绿素-蛋白复合物;而583 nm和626 nm的起伏吸收峰则表明条带中含有藻蓝蛋白。分别给予对应于Chl a和c的435 nm和460 nm的激发光,均产生685 nm左右属于Chl a的荧光发射,说明叶绿素之间保持着良好的能量传递关系;当给予580 nm的激发光时,主要产生660~662 nm属于藻蓝蛋白的特征荧光发射;同时在发射波长为660 nm的荧光激发光谱中(图4),激发贡献主要来源于580 nm和625 nm的藻蓝蛋白,而430~440 nm属于Ch la和460 nm属于Chl c的荧光贡献很微弱,显然660 nm荧光主要产自非结合状态的藻蓝蛋白,表明此条带存在相当比例的游离的藻蓝蛋白组分。由于该组分离心迁移位置明显低于异二聚体形式为主的BandⅠ,因此应为聚合的大分子PC645复合物。此外,该条带在580 nm激发光下同时也表现出685 nm附近的Chl a的发射肩峰,在发射波长为700 nm的荧光激发光谱中可以看出Chl a、Chl c、PC645均对700 nm的荧光发射有贡献,显示PC645吸收的光能还有一定比例传递给了Chl a,说明此条带中还有一部分PC645是以结合态存在的,且与Chl a之间依然保持能量传递关系。上述结果表明BandⅡ可能是藻蓝蛋白-Chl a/c-蛋白复合物与大分子藻蓝蛋白复合物的混合条带。Band Ⅲ则位于离心管底部的1.5 mol/L蔗糖密度带,为带有墨绿色沉淀的浅绿色条带,光谱中属于Chl a、Chl c和PC645的吸收峰均有出现,且分子质量很大,主要是细胞器、类囊体膜碎片等大颗粒物质。

图1 蓝隐藻细胞破碎液的蔗糖密度梯度离心

图2 超离心分离各条带吸收光谱
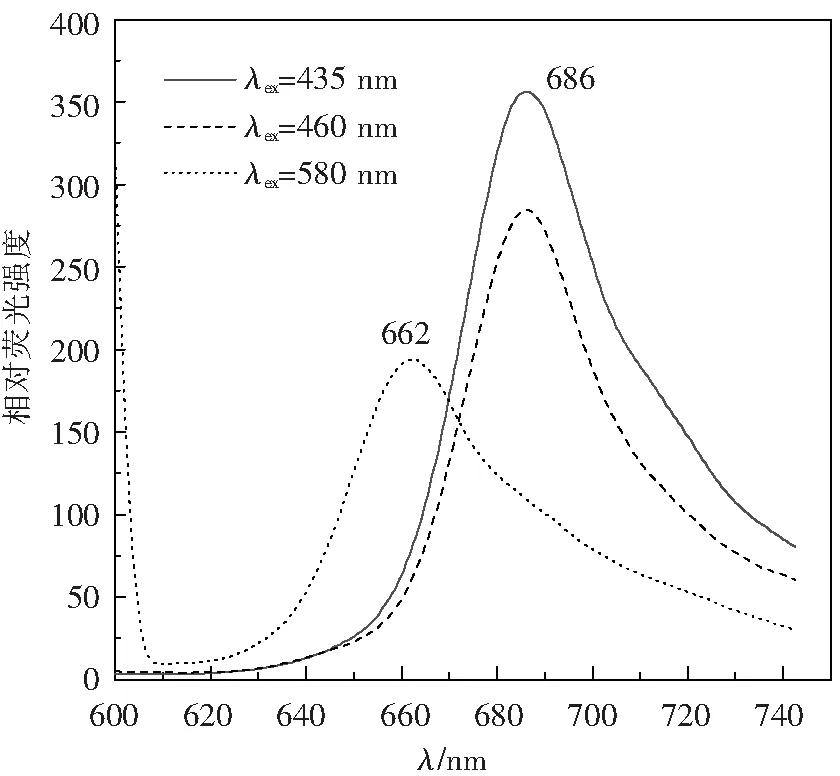
图3 BandⅡ荧光发射光谱

图4 BandⅡ荧光激发光谱
2.2 藻蓝蛋白及复合物相对定量方法的建立
以往的文献对大颗粒聚合态隐藻藻胆蛋白的形成没有报道,为了更好地检测BandⅡ中藻蓝蛋白复合物的含量变化,我们尝试建立以580 nm光激发,以PC645的660 nm特征荧光为指标,观测游离存在的PC645复合物相对含量的检测方法。藻胆蛋白具有很高的荧光光量子产率,微量时即可产生明显的荧光信号;而且藻胆蛋白色基与蛋白质是共价结合的,不会在分离过程中因色基脱落造成误判。
纯化后的PC645经梯度稀释,在与BandⅡ中藻蓝蛋白相近的浓度范围附近,在580 nm的激发光下,其660 nm荧光与A645(浓度)之间呈现良好的线性关系,相关系数0.999 8(图5)。BandⅡ中的Chl a 和 Chl c对580 nm激发光会产生微弱的吸收,但两者发射的荧光主要分别在680~685以及630~640 nm;而结合态的PC645将激发能传给了Chl a,并发射属于Chl a的685 nm荧光。因此660 nm相对荧光强度的大小反映的是BandⅡ中游离存在的藻蓝蛋白复合物的相对含量的高低。

图5 纯化的PC645的 660 nm荧光标准曲线
2.3 pH对藻蓝蛋白复合物的影响
2.3.1 破藻时PBS缓冲液pH对PC645复合物含量的影响 图6显示,藻细胞破碎时缓冲液pH变化对BandⅠ和Band Ⅲ的影响不明显,但BandⅡ的迁移位置和颜色发生了变化。pH越低,BandⅡ越集中于高密度区。pH为4.92时,BandⅡ位于1.5 mol/L蔗糖密度梯度的上部;pH为8.67时BandⅡ已移动到0.8 mol/L的蔗糖密度下部。说明pH降低,PC645复合物的分子密度或分子质量呈增加的趋势。荧光光谱分析显示(图7),迁移位置不同的Band Ⅱ 的光谱性质无明显变化,只影响到相对强度。图8的趋势分析表明,pH较低时,BandⅡ相对荧光强度较高,相应的条带中PC645复合物的含量更高,尤以pH 4.92时复合物荧光最强、含量最高。但是由于PBS缓冲液配制条件限制,无法研究更低pH 破藻对藻蓝蛋白复合物形成的影响。pH 6.5~7.0的中性条件下BandⅡ相对荧光强度有所起伏,pH 7.5以上的碱性条件下呈现出大幅度持续降低趋势。上述结果说明,酸性条件下有利于PC645复合物的聚合和稳定,此时条带中复合物不仅分子质量更大,相对荧光强度也更高,说明其活性保持的更好,显示聚合态的PC645很可能是其传能的活跃状态。

图6 破藻时pH变化对PC645复合物分离的影响
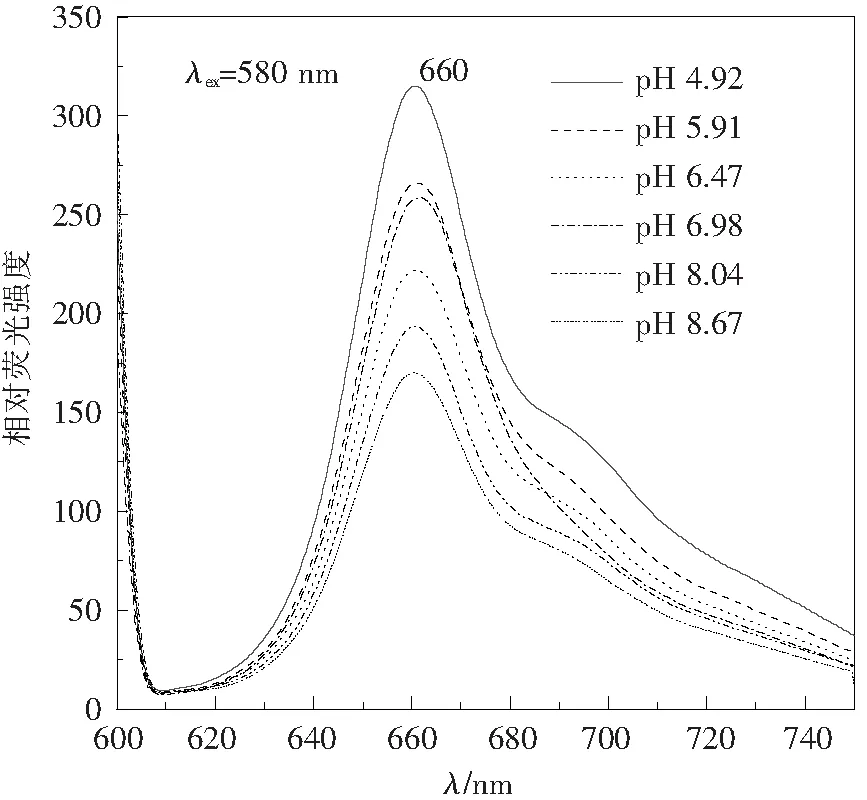
图7 破藻时pH对PC645复合物荧光发射光谱的影响

图8 破藻时pH变化对PC645复合物660 nm荧光峰值的影响趋势
2.3.2 离心分离时PBS缓冲液pH变化对PC645复合物含量的影响 离心分离时PBS缓冲液的pH变化同样影响PC645复合物所在的BandⅡ的迁移率(图9)。

图9 离心分离时不同pH对PC645复合物的影响
由图9可见,随着pH的增加,BandⅡ从1.5 mol/L的蔗糖密度区扩散进入1.0 mol/L甚至0.8 mol/L蔗糖梯度区,表明条带中成分在碱性条件下趋于解离,分子质量或密度降低。离心分离时不同pH条件下条带的光谱性质相似,但相对荧光强度发生变化(图10)。pH 7以下时,荧光发射峰位稳定于660~662 nm,光谱形态基本不变;但pH 8以上时,光谱形态发生明显变化,荧光发射强度明显下降,提示藻蓝蛋白复合物不仅聚合程度降低,甚至亚基也有变性的趋势。中性或微碱性条件时(pH 6.5~7.0),荧光强度有一个随pH变化的平台期,而pH 4.92 ~ 6.5范围内,复合物光谱稳定,峰值也渐高(图11)。再次说明,较低的pH有利于藻蓝蛋白复合物的形成与稳定。在此实验条件下,pH 4.92为最佳分离条件。
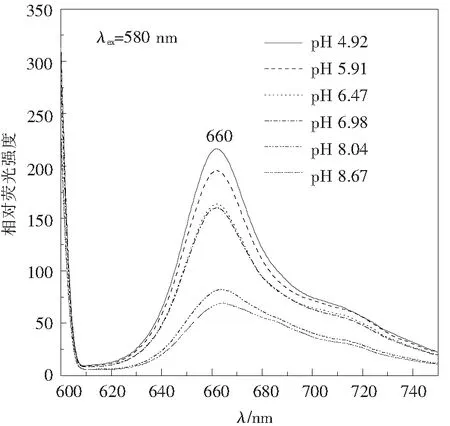
图10 离心分离时pH对PC645复合物荧光发射光谱的影响

图11 离心分离时pH对PC645复合物 660 nm荧光峰值的影响趋势
2.4 缓冲液磷酸盐浓度变化对藻蓝蛋白复合含量的影响
2.4.1 破藻时PBS缓冲液浓度对藻蓝蛋白复合物含量的影响 磷酸盐是藻胆蛋白分离和保存常用的缓冲盐,红、蓝藻的藻胆体在磷酸盐浓度过低会出现解离。如图12的结果显示,破藻时磷酸盐的浓度在50~500 mol/L范围内,藻体破碎液离心后产生的各条带颜色、相对迁移位置基本不变。盐浓度达到500 mmol/L时,BandⅠ的迁移位置向下蔓延,说明有一定比例的藻蓝蛋白异二聚体发生一定程度的聚合,出现分子质量或密度介于BandⅠ和Band Ⅱ之间的大颗粒成分,值得进一步观察。由图13看出,6个PBS浓度的破藻条件下荧光峰形相近,在580 nm激发光下主要发射660 nm的荧光,说明存在相当数量的游离大分子藻蓝蛋白复合物;而在685~687 nm左右的肩峰,应该是结合态PC645将能量传递给了Chl a或者叶绿素在580 nm处的弱吸收导致。图14的660 nm荧光峰值变化趋势显示,破藻时PBS浓度为50 mmol/L时,BandⅡ的相对荧光强度最高,可近似认为游离藻蓝蛋白复合物含量最高;随着盐浓度的升高,荧光强度反而降低,达到500 mmol/L时又呈现增高的反弹趋势。因此,在此实验条件下,破藻时50 mmol/L的PBS,最适合BandⅡ中游离藻蓝蛋白复合物的分离。

图12 破藻时PBS浓度对PC645复合物分离的影响
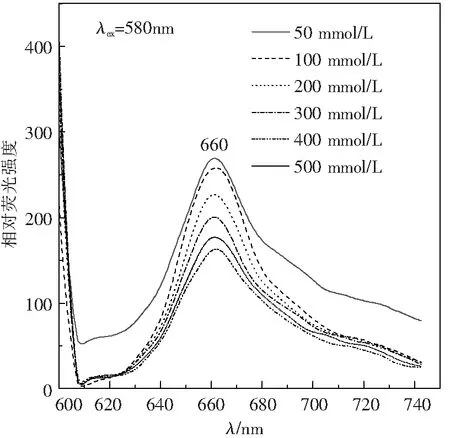
图13 破藻时PBS浓度对PC645复合物荧光发射光谱的影响

图14 破藻时PBS浓度对PC645复合物660 nm荧光峰值的影响趋势
2.4.2 磷酸盐缓冲液的浓度对藻蓝蛋白复合物含量的影响 离心分离时盐浓度梯度使原有的蔗糖梯度密度变化,因此条带的所处的位置普遍发生变化。低盐浓度时,BandⅡ迁移较快;而盐浓度升高到400 mmol/L以上时,BandⅡ甚至仍滞留在0.6 mol/L蔗糖梯度区(图15)。但分离条带的数量、颜色和条带之间的相对位置未发生变化,不影响富含PC645复合物的BandⅡ的观察和荧光分析。如图16和17所示,在破碎藻细胞时采用50 mmol/LPBS条件下所得的藻液,其Band Ⅱ在580 nm激发光下产生的660 nm特征荧光峰值随着PBS浓度的增加而增大,之后又呈下降的趋势,分离介质中PBS浓度为300 mmol/L时相对荧光强度最高。在此分离条件下,似乎过高或过低的离子强度都不利于复合物的聚合。

图15 离心分离时PBS浓度对PC645复合物分离的影响

图16 离心分离时不同PBS浓度对PC645复合物荧光发射谱的影响

图17 离心分离时不同PBS浓度对PC645复合物660 nm荧光峰值的影响趋势
3 讨 论
隐藻藻胆蛋白作为进化上比较特殊的一类藻胆蛋白,与已被人熟知的红、蓝藻中的藻胆蛋白相比,存在许多不同或特异之处,但目前对其了解远不及红、蓝藻中的藻胆蛋白透彻。并且现有对隐藻藻胆蛋白的报道又大多集中于游离的异二聚体或者更小的单体[22-24],对于异二聚体之间的相互作用,以及作为隐藻主要的捕光复合物与类囊体膜上Chl-蛋白之间的接触机制还存在争议。VESK等[25]采用了包括生化分离、固定化染色及免疫细胞化学等多种方法试图对PE545进行定位,但他们给出的结论是上述方法均无法确定PE545在膜腔中的状态。为此,实验采用物理性压力破碎处于对数生长期的蓝隐藻细胞后,将未经处理的细胞破碎液进行温和的蔗糖密度梯度离心,以期得到天然状态的不同PC645形式,并了解不同形式的性质、功能和定位。
据报道,隐藻藻胆蛋白与Chl a之间的能量传递效率很高,可达98%~99%[16],但在580 nm激发光下,活体蓝隐藻细胞中以及分离的类囊体膜上通常都有超过50%的激发能以660 ~665 nm荧光被发散掉,而没有传递给位于类囊体膜上的反应中心[18],说明活体细胞中发射这部分剩余荧光的PC645应该是在功能上属于冗余或备用的捕光复合物部分。实验破碎后的蓝隐藻细胞液经蔗糖密度梯度离心后,可得到大量游离的PC645异二聚体(BandⅠ),显然,在实验所用蓝隐藻中,异二聚体形式应是PC645存在形式中最丰富的,而且天然地以游离状态存在于类囊体膜腔中。
DOUST等[26]在超高分辨率的晶体衍射和超快光谱分析基础上,采用量子化学计算方法计算得出的结论认为,隐藻藻红蛋白PE545异二聚体之间以及与膜上Chl a之间,在间距小于5 nm时即可完成激发能的传递,而无需直接的分子间接触。只是若完全以此方式进行能量传递,效率比活体细胞中低的多,说明隐藻中藻胆蛋白参与的激发能的传递方式应该不是单一的。本实验在高密度蔗糖梯度区发现有PC-Chl-蛋白复合物以及大分子PC645复合物的混合条带。经吸收和荧光光谱分析,其中结合态的PC645与叶绿素之间仍保持着高效能量传递关系,结果直接表明PC645存在有膜结合的形式,并且从功能上处于活跃的能量传递状态。
大分子游离隐藻蓝蛋白聚合颗粒的发现,说明隐藻藻胆蛋白在类囊体膜中的天然存在状态也并非单一的,一部分游离的PC645可在一定条件下自发聚合形成更高级的自组装形式。以580 nm激发光下660 nm荧光为监测指标,通过改变藻体在压力破碎和蔗糖密度梯度离心分离时磷酸盐的浓度和pH,了解聚合形态的PC645形成与分离时盐浓度及pH的关系。发现该条带中大分子藻蓝蛋白复合物在破藻缓冲液中磷酸盐浓度为50 mmol/L、pH 4.92,蔗糖密度梯度溶剂磷酸盐缓冲液浓度为300 mmol/L、pH 4.92时含量最高。李文军等[27]曾报道,隐藻PC645在pH 3~10 范围内基本保持稳定,尤其是pH 3.5~7.0的酸性范围内,结构和能量传递功能最为稳定。实验结果显示,一定浓度的磷酸盐和pH小于6.5的酸性条件有利于藻蓝蛋白复合物的形成和稳定,而在功能稳定状态下聚合态PC645含量更高的实验结果,说明聚合形式的PC645很可能是能量传递的活性形式之一。
上述实验结果进一步证实和完善了本课题组之前提出的隐藻藻胆蛋白在叶绿体中可能的存在动态结合模型[18],即藻胆蛋白在类囊体腔中的存在是非均一的,与膜的结合状态也可能是动态的,一部分为膜结合型,另一部分为游离状态。处于结合状态的藻胆蛋白直接参与光能向反应中心的传递,而游离状态的藻胆蛋白可以不同形态存在,一部分对于捕光功能来说可能暂时是冗余的,以某种方式中断了与光合系统之间的能量传递关系,而当需要的时候,游离的藻胆蛋白还可与类囊体膜内表面重新结合或聚集。近年来被引进的二维光子反射光谱技术研究结果也显示[22,28-29],隐藻藻胆蛋白的能量传递十分高效,可能是多路径的,并且存在大量色基共同参与的相干能量传递方式;MIRKOVIC 等[30]助光漂白荧光恢复(FRAP)和共聚焦显微方法也发现隐藻中大部分(73%)的天线蛋白在类囊体腔中能够以与藻胆体的扩散能力相接近的速度在膜腔中有限迁移,原因可能与PE545与膜相互作用或者蛋白聚合有关。实验结果将为深入了解隐藻藻胆蛋白的结构、组装和功能提供重要依据。
