中性粒细胞与淋巴细胞比值和预后营养指数评估中晚期胰腺癌预后的应用分析
2021-10-14陈海峰洪国标
陈海峰 洪国标
2019年国家癌症中心发布的中国最新癌症报告指出,胰腺癌新发病例占所有癌症患者的2.4%,占癌症死亡总人数的3.6%[1]。胰腺癌发病隐匿,就诊时多为晚期,已丧失手术机会,5年生存率低于5%,并且缺乏敏感的早期诊断方法。研究报道,中性粒细胞与淋巴细胞比值(NLR)可用于评估恶性肿瘤的预后及疗效[2-4]。而机体的营养状况与肿瘤的发生发展紧密相关[5],预后营养指数(PNI)是基于白蛋白和淋巴细胞计数的参数,与多种恶性肿瘤的预后相关[6-8]。目前,NLR、PNI用于中晚期胰腺癌的生存预测及评估尚缺乏明确共识。本研究主要探讨NLR、PNI水平对中晚期胰腺癌患者生存的影响,现报道如下。
1 资料与方法
1.1 临床资料 回顾性收集2013年1月至2017年1月于本院首次确诊的中晚期胰腺癌患者70例。(1)纳入标准:经病理或细胞学检查确诊为胰腺导管腺癌;按照美国癌症联合委员会(AJCC)胰腺癌分期标准(第7版),为Ⅲ期或Ⅳ期,无手术指征;可定期进行随访和复诊,患者依从性好。(2)排除标准:合并其他恶性肿瘤者;合并严重的心、肺、胃肠道、肾、血液、神经、免疫等系统疾病者;伴有严重精神性疾病者;智力障碍的患者。
1.2 研究方法 入院时收集患者的性别、年龄、酗酒、肿瘤部位、临床分期、分化程度、美国东部肿瘤协作组(ECOG)评分、体重、白蛋白、白细胞、淋巴细胞、治疗措施等临床资料,确诊前均行腹部超声、胸腹部CT、颅脑MRI等检查,此后每3个月复查一次。通过电子病历系统、电话等方法定期对所有患者进行随访,详细记录随访信息,随访至2019年8月。分析NLR、PNI水平与不同临床病理特征的关系,采用Kaplan-Meier法绘制患者生存曲线,进行单因素和Cox比例风险回归模型多因素分析患者NLR、PNI水平和总生存期(OS)的关系。
1.3 观察指标 (1)NRL、PNI与临床病理特征的关系;(2)NRL、PNI最佳临界值;(3)NRL、PNI与OS的关系。
1.4 统计学方法 采用SPSS 21.0统计软件。计数资料以n表示,采用χ2检验或方差分析;计量资料符合正态分布,以(±s)表示;绘制受试者工作特征(ROC)曲线,将约登指数(敏感度+特异度-1)最大值时所对应的数值作为截断值分组;采用Kaplan-Meier法绘制生存曲线;采用Log-rank检验比较组间生存差异,多因素生存分析采用Cox比例风险模型。以P<0.05为差异有统计学意义。
2 结果
2.1 NRL、PNI与临床病理特征的关系 70例中晚期胰腺癌患者的NLR值为(5.05±2.04),与分化程度、肿瘤分期、ECOG评分、治疗措施均有关(P<0.05),与性别、年龄、酗酒、肿瘤部位、体重减轻均无关(P>0.05)。PNI值为(39.56±4.19),与患者的年龄、体重减轻、ECOG评分、治疗措施均有关(P<0.05),与性别、分化程度、酗酒、肿瘤分期、肿瘤部位均无关(P>0.05)。见表1。

表1 NRL、PNI与患者临床病理特征的关系
2.2 NRL、PNI最佳临界值确定 NLR的ROC曲线下面积(AUC)为0.769,95%可信区间为0.678~0.860。见图1。PNI的ROC曲线下面积(AUC)为0.821,95%可信区间为0.742~0.901。见图2。取敏感性、特异性相加最大值为最佳临界值。NLR最佳临界值为4.205,敏感性为64.3%,特异性为90.0%。PNI最佳临界值为40.650,敏感性为90.3%,特异性为65.70%。

图1 NLR诊断胰腺癌的ROC曲线

图2 PNI诊断胰腺癌的ROC曲线
2.3 NRL、PNI与患者预后的关系 根据NLR最佳临界值4.205,将患者分为高NLR组(NLR≥4.205)和低NLR组(NLR<4.205)。根据PNI最佳临界值40.650,将患者分为高PNI组(PNI≥40.65)和低PNI组(PNI<40.65)。整体中位生存时间为9.5个月。高NLR组和低NLR组患者的中位生存时间分别为8个月和11.6个月,见图3。高PNI组和低PNI组患者的中位生存时间分别为10.9个月和7.0个月,见图4。差异均有统计学意义(P<0.05)。采用Log-rank检验单因素分析显示,分化程度、肿瘤分期、ECOG评分、NLR、PNI、治疗措施均与中晚期胰腺癌者的预后有关(P<0.05),见表2。多因素分析显示,肿瘤分期、NLR、PNI、治疗措施为影响中晚期胰腺癌患者预后的独立因素(P<0.05),见表3。
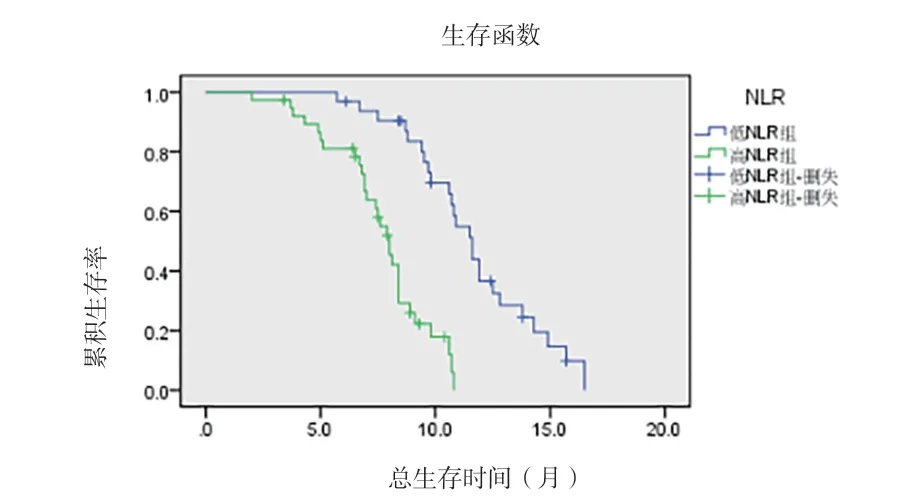
图3 高NLR组和低NLR组胰腺癌患者的生存曲线

图4 高PNI组和低PNI组胰腺癌患者的生存曲线

表2 70例胰腺癌患者预后影响因素的单因素分析

表3 70例胰腺癌患者预后影响因素的Cox多因素分析
3 讨论
肿瘤的发生发展与长期慢性炎症密切相关,C反应蛋白、白细胞计数等指标水平伴随着肿瘤进展而逐渐升高,提示预后不佳。NLR升高会抑制NK细胞活性,淋巴细胞减少,从而降低肿瘤对免疫系统的应答,增加肿瘤复发风险,同时中性粒细胞升高会导致肿瘤细胞生长微环境的炎性介质及细胞活素增多,还能分泌血管内皮生长因子,促进肿瘤血管生成[9]。HUANG等[2]研究表明,治疗前较高的NLR水平与较差的总体生存率和较短的无进展生存期相关,可作为卵巢癌患者预后不良的预测因素。CHEN等[4]的一项恶性胸膜间皮瘤荟萃分析显示,升高的NLR与较差的OS相关(HR=1.48,95%CI=1.16~1.89,P<0.001),NLR升高可能是恶性胸膜间皮瘤患者的潜在预后因素,并且可能与组织学相关联,作为对患者进行分层的有效临床指标。然而,NLR用于胰腺癌患者预后的预测作用证据相对较少。ZHOU等[10]对43项胰腺癌队列研究的37篇论文进行荟萃分析,发现低NLR患者的OS更长;亚组分析显示,低NLR与较长的DFS显著相关;此外,低NLR患者的肿瘤大小明显较小,分化程度更高。低NLR是胰腺癌患者OS和DFS的良好预测指标。本研究回顾性分析70例中晚期胰腺癌患者的临床资料,发现NLR可作为中晚期胰腺癌患者预后的独立预测因素,这与ZHOU等的研究结果基本一致。
肿瘤快速生长除了降低患者对免疫系统的应答外,机体的营养状态也是重要影响因素,营养不良不仅会降低患者的生活质量、提高死亡率,还会延长住院时间、增加术后并发症、缩短生存时间。近年来,PNI被广泛应用于不同恶性肿瘤患者的营养状况及预后评估。张佳奇等[11]回顾性分析172例接受同步放化疗的LSSCLC患者的临床资料,发现治疗前和同步放化疗期间患者的营养状态变化与预后明显相关,治疗前营养状态较好的患者预后较好。AKGÜL等[7]对637例根治性切除术后肝内胆管癌患者进行荟萃分析,发现PNI<40的患者更容易患有多灶性疾病,术前低PNI与更积极的ICC表型相关,PNI≥40的患者OS优于PNI<40的患者。HUA等[8]对380例接受乳房切除术的T1-2N1乳腺癌患者进行研究,发现PNI高的患者OS明显优于PNI低的患者,接受放射治疗的亚组分析显示PNI高的患者OS明显优于PNI低的患者,而在PNI较低的患者中接受放射治疗的患者OS较未接受放射治疗患者差。然而,PNI用于胰腺癌预测的研究较少,尚无统一共识。GENG等[12]对321例局部晚期或转移性胰导管腺癌进行回顾性分析,结果表明低PNI与晚期胰腺癌患者的OS短显著相关,多变量分析确定PNI是OS的独立预后因素,且PNI与NLR、PLR呈正相关,与LMR呈负相关,PNI低的患者表现出高水平的TNF-α,说明PNI与全身炎症反应相关,可用于中晚期胰腺癌的生存预测。本研究同样发现PNI可作为预后的独立预测因素。
综上,NLR、PNI可作为预测中晚期胰腺癌预后的指标,且获取简便、无侵入性、可操作性强,还可全程动态监测,有助于病情监测及预后研判。但NLR、PNI受干扰因素较多,还需更大样本的数据支持。
