托法替布联合治疗抗MDA5抗体阳性的无肌病皮肌炎并发快速进展型间质性肺病5例临床分析
2021-10-14吴燕芳林滇恬陈志涵
吴燕芳,高 飞,林滇恬,陈志涵,林 禾
(福建医科大学省立临床医学院,福建省立医院风湿免疫科,福州 350001)
抗黑色素瘤分化相关基因5(melanoma differentiation associated gene 5,MDA5)抗体是皮肌炎特异性抗体,在皮肌炎中阳性率为21%,而在无肌病性皮肌炎(amyopathic dermatomyositis,ADM,皮肌炎的一种亚型)中阳性率高达62%[1]。间质性肺病(interstitial lung disease,ILD)是皮肌炎死亡的独立危险因素,文献报道,抗MDA5抗体与急性/亚急性间质性肺炎(acute/subacute interstitial pneumonia,A/SIP)的发生密切相关[2]。
部分抗MDA5抗体阳性的ADM并发ILD患者,应用传统的激素联合免疫抑制剂疗效差,易发展为快速进展型ILD(rapidly progressive ILD,RP-ILD),或以RP-ILD首发起病,死亡率高。Chen等[3]报道Janus激酶抑制剂托法替布(tofacitinib,TOF)可显著改善抗MDA5抗体阳性的ADM并发ILD早期阶段患者的生存。本研究对5例抗MDA5抗体阳性的ADM并发RP-ILD患者的临床资料进行回顾,患者均在应用激素及免疫抑制剂治疗的同时,尽早联合了TOF进行治疗,现对其总结如下,以供临床参考。
1 资料与方法
1.1 研究对象
回顾分析2019年福建省立医院风湿免疫科收治的5例应用TOF联合激素及免疫抑制剂治疗的抗MDA5抗体阳性的ADM并发RP-ILD患者临床资料。所有患者均排除感染、肿瘤及其他风湿免疫病。
1.2 诊断标准
ADM的诊断符合2017年欧洲抗风湿病联盟(European League Against Rheumatism,EULAR)/美国风湿病学会(American College of Rheumatology,ACR)成人和青少年特发性炎性肌病(idiopathic inflammatory myopathies,IIM)分类标准[4]。ILD的诊断符合2013年美国胸科学会(American Thoracic Society,ATS)/欧洲呼吸病学会(European Respiratory Society,ERS)标准,即有咳嗽、咳痰、胸闷、胸痛及气促等呼吸道表现,且肺部CT检查显示毛玻璃样、网格样、蜂窝样、纤维条索状影等[5],若3个月内出现肺部症状加重(气促、胸闷等)、肺部影像学表现加重或者肺功能急剧恶化[用力肺活量(forced vital capacity,FVC)下降>10%或动脉氧分压下降>10 mmHg],则诊断为RP-ILD[5]。
1.3 肌炎抗体谱检测
取患者空腹血清标本2 mL,使用德国欧蒙公司自身免疫性肌炎抗体谱检测试剂盒进行检测。
1.4 宏基因组二代高通量测序
取患者支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)600 μL,进行宏基因组二代高通量测序(具体方法参见试剂盒)。
1.5 肺部HRCT评分
由2位放射科医师分别对患者肺部高分辨率CT(high resolution CT,HRCT)进行评分后取平均值。根据Goldin等[6]提出的“六区法”,利用主动脉弓水平及下肺静脉水平将单侧肺野分为上、中、下肺,即肺尖至主动脉弓水平为上肺,主动脉弓至下肺静脉水平为中肺,下肺静脉至肺底为下肺,双侧一共6个区域,分别就磨玻璃影、纤维化、蜂窝征、肺气肿表现,按照0~4分评分:0表示无病灶,1~4分别表示病灶范围占该区域1%~25%、26%~50%、51%~75%、76%~100%,取各项总分来进行对比评估,分数越高病变越重。
1.6 数据收集及整理
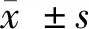
2 结果
2.1 临床表现
5例ADM并发RP-ILD患者中女性4例,男性1例,年龄36~56岁,平均年龄44岁。均以皮疹为首发表现,病程2~4个月,平均3个月,以眶周、面部、前胸部紫红皮疹及指间关节Gottorn征多见,其中例1及例5的掌指关节处及肘关节伸面皮肤可见溃疡性皮疹(图1)。表1详细列出了5例患者治疗前的基本情况。患者的肌痛及肌无力症状均较轻微,例2及例4几乎无肌肉受累的临床表现。发热3例,关节炎2例,呼吸道症状均出现在皮疹之后,且为急性起病(2~4周),最常见的症状是呼吸困难(5例)、低氧血症(5例)和咳嗽(4例)。
A,Gottron’s sign,skin ulcers of metacarpophalangeal joints;B,heliotrope rash and erythema on the face and neck.图1 病例1典型皮疹Figure 1 Representative rash in Case 1
2.2 辅助检查
患者治疗前淋巴细胞绝对计数下降,平均0.9×109/L;血常规(包括白细胞、血红蛋白、血小板、谷丙转氨酶、谷草转氨酶、血尿素氮、血肌酐)及血肌酸激酶正常,乳酸脱氢酶轻度增高(217~668 IU/L)。3例行肌电图检查者未见肌源性损害,4例抗Ro-52抗体阳性。所有患者均在TOF治疗前行床边支气管镜,取BALF行高通量测序检测,除例1发现肺孢子菌序列603外,其余病例细菌、真菌、病毒、结核分支杆菌及寄生虫检测均为阴性;4例行BALF细胞学检查,淋巴细胞10%~81%,中性粒细胞5%~22%,巨噬细胞12%~74%(表1)。
2.3 肺部影像学表现
患者肺部影像学主要表现为双肺磨玻璃样实变影、网格状阴影、蜂窝征及牵拉性支气管扩张。例5入院前2个月常规体检肺部CT完全正常,此次以重症肺炎起病,肺部CT提示大片炎症渗出、实变。患者ILD类型均为非特异性间质性肺炎,其中2例合并弥漫性肺泡损伤,1例合并机化性肺炎,1例合并寻常型间质性肺炎;治疗前HRCT评分10~25分,平均17.8分(表1)。
2.4 治疗
例1、例2和例3均在外院确诊后接受了激素及免疫抑制剂治疗,例4和例5为初诊于我院患者。5例就诊于我院后均使用甲基强的松龙80 mg/d及环磷酰胺800 mg/月,并同步加用TOF每日2次、每次5 mg治疗,例1同时使用吡非尼酮。例1~4在治疗初期使用经鼻高流量氧疗,例5行气管插管呼吸机辅助呼吸。随访期间环磷酰胺及TOF剂量不变,激素逐渐减量。治疗6个月后,例1、例2、例3甲基强的松龙减至12 mg/d,例4减至10 mg/d。
2.5 转归
例1~4加用TOF后,关节炎和皮疹均得到控制,呼吸困难症状缓解,炎症指标下降,尤其例1在加用TOF后1周,呼吸困难症状和肺部影像学表现均有明显改善(图2)。存活的4例患者随访6个月时,HRCT评分、氧合指数、6 min步行试验、肺功能指标(FVC%、TLC%、DLCO%)、红细胞沉降率、C反应蛋白和血清铁蛋白均较基线有所改善(表2)。例5患者因起病急,肺部病变进展快,入院第2天予气管插管,第3天予甲基强的松龙、环磷酰胺及TOF联合治疗,第7天出现纵隔气肿,最终因呼吸衰竭死亡。
本研究还对同期仅接受甲基强的松龙和环磷酰胺治疗的ADM并发RP-ILD的8例患者进行了回顾,发现6例在出现RP-ILD后8周内死亡,仅2例在治疗后6个月存活,其中1例曾予血浆置换治疗。
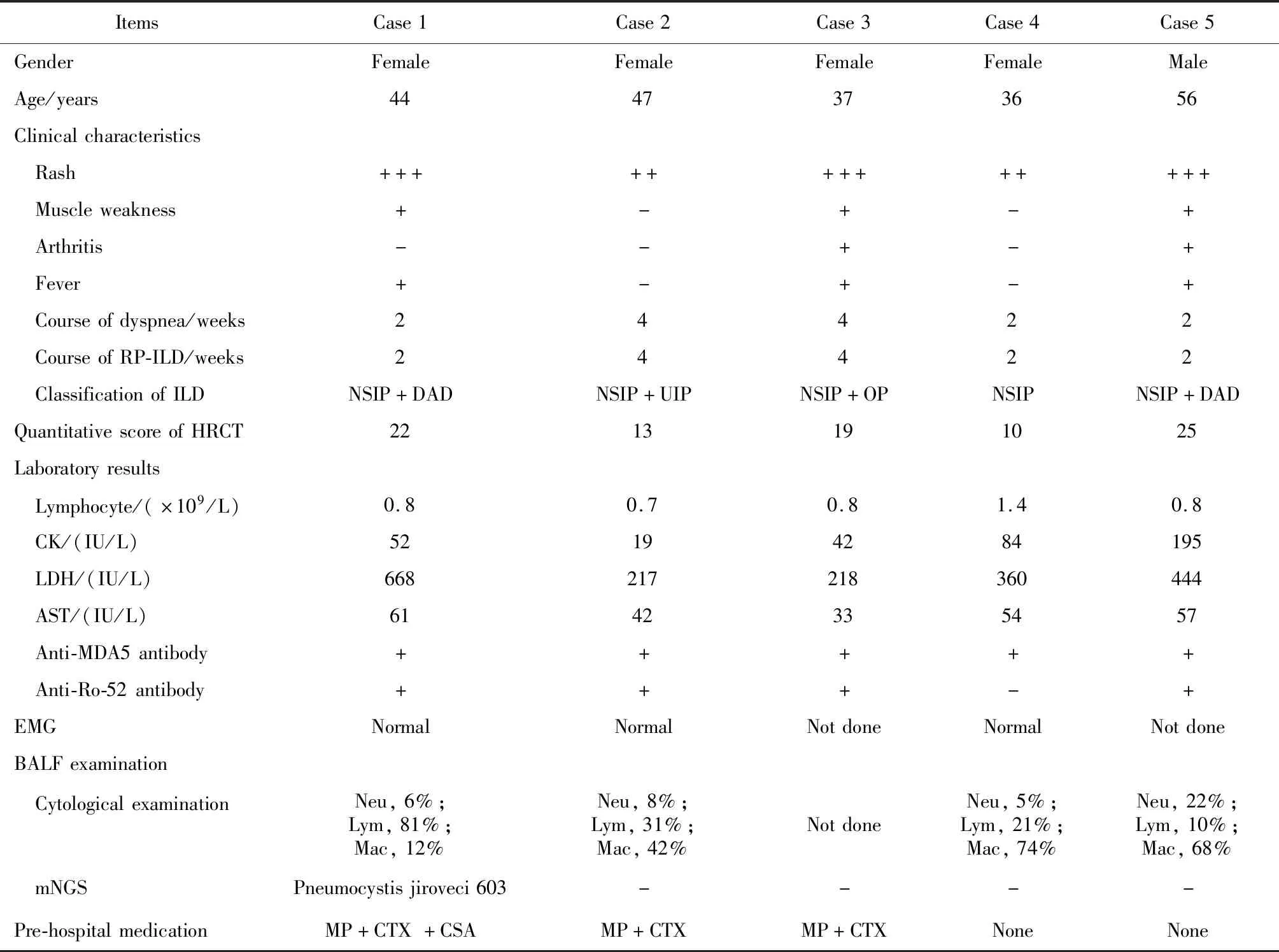
表1 TOF治疗前患者的观察指标Table 1 Clinical manifestations before treatment with TOF
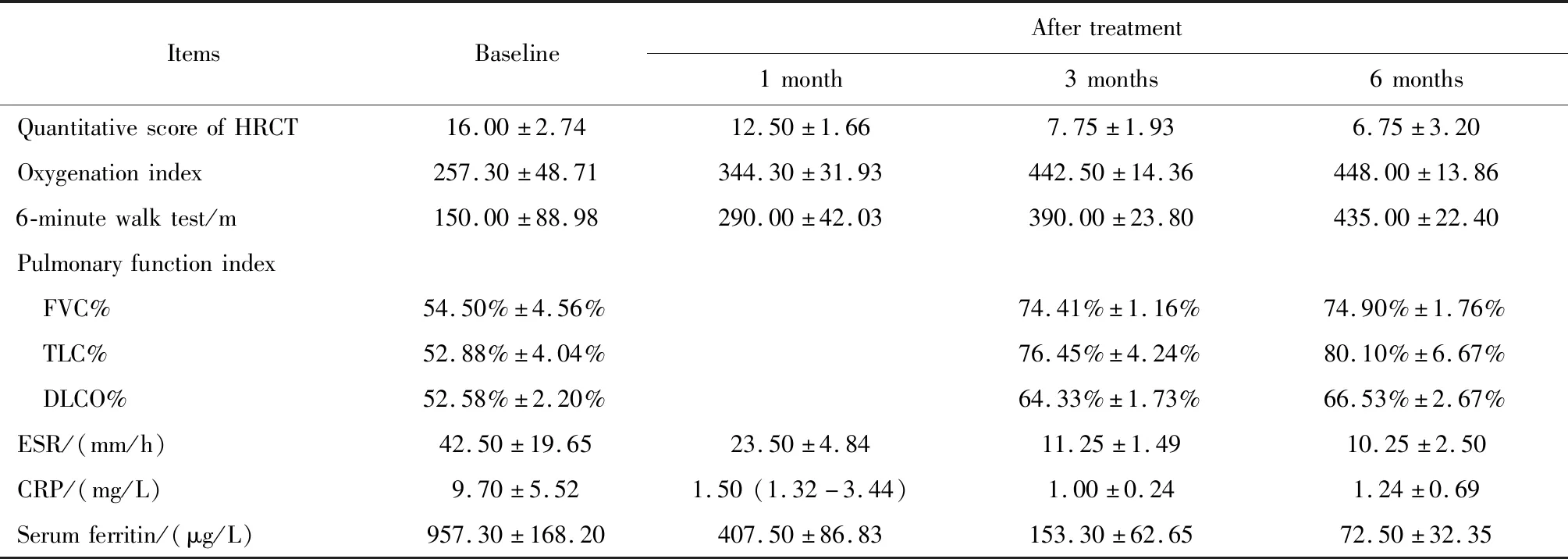
表2 存活患者治疗前后各观察指标结果(n=4)Table 2 Results of relevant indexes of survived patients before and after treatment (n=4)
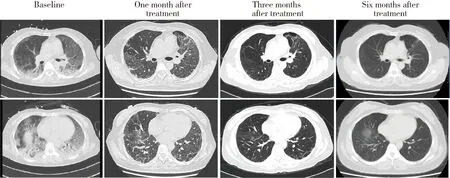
图2 病例1肺部HRCTFigure 2 Pulmonary HRCT in Case 1
2.6 安全性评价
4例存活患者在接受TOF治疗过程中均未出现胃肠道不适;例1接受TOF治疗6周时出现腰部带状疱疹,停药2周,经抗病毒治疗好转后继续服药,未见不良反应。服药期间定期监测白细胞、血红蛋白、血小板及肝/肾功能,均未见异常。4例患者TOF治疗前淋巴细胞绝对值均低于正常值(平均0.9×109/L),治疗后除例4无明显变化外,其余3例患者淋巴细胞绝对值均上升(平均1.5×109/L)。
3 讨论
IIM是一组以骨骼肌炎症浸润为主要特征的异质性自身免疫性疾病,约70%~80%的IIM患者血清中可检测到自身抗体,这些抗体在判断IIM的临床类型、对药物的治疗反应及预后等方面均具有重要意义[7]。
抗MDA5抗体是皮肌炎特异性抗体,其与A/SIP的发生密切相关,是皮肌炎合并A/SIP敏感及特异的指标(敏感性88%,特异性94%)[2],高滴度的抗MDA5抗体的皮肌炎并发ILD患者较低滴度者对激素及免疫抑制剂治疗反应差,此类型患者传统治疗后6个月死亡率高达50%[8-10]。抗MDA5抗体阳性的ADM并发RP-ILD患者体内多种炎症因子(如白细胞介素-1、白细胞介素-6、白细胞介素-18和肿瘤坏死因子α等)过量产生的“炎症细胞风暴”可能是关键的致病机制[11]。TOF是Janus激酶抑制剂,可阻断多种细胞因子,降低炎症反应对患者肺组织的损伤。2018年Kurasawa等[10]报道了5例常规治疗失败的ADM并发ILD患者,在联合TOF治疗后3例存活,2例死亡,提示常规治疗联合TOF可作为ADM并发ILD患者的治疗手段。
本组5例患者均为抗MDA5抗体阳性的ADM并发ILD患者,其中例1、例2和例3均于外院接受常规激素和免疫抑制剂治疗,随后发展为RP-ILD,例4初诊于我院时发现ILD病变明显,且存在低氧血症。启动TOF治疗(每天2次,每次5 mg)后患者的呼吸困难症状均逐渐好转,随访时患者的血清铁蛋白、肺部HRCT评分、氧合指数、6 min步行试验及肺功能均较基线有一定程度的改善。Kurasawa等[10]的研究同时发现,血清铁蛋白水平>1 000 μg/L是抗MDA5抗体阳性的ADM并发ILD患者预后不良的影响因素。本组存活的4例患者发病初始血清铁蛋白平均值为957 μg/L,TOF治疗后明显降低,治疗6个月后降至72.5 μg/L,提示TOF治疗ADM并发RP-ILD的疗效是肯定的。肺部HRCT评分和肺功能是评估ILD疗效的直接指标,本组存活的4例患者肺部HRCT评分及肺功能指标在治疗后均有明显改善,进一步提示TOF治疗ADM并发RP-ILD的有效性。例5患者,发病急,肺部病变进展快,尽管入院第3天即给予激素、环磷酰胺及TOF联合治疗,仍于第7天并发纵隔气肿,最终因呼吸衰竭而死亡,无法评估药物疗效。
为进一步观察TOF的疗效,我们选择同期入院仅接受甲基强的松龙和环磷酰胺治疗的8例患者,发现在治疗后6个月,接受TOF治疗的5例患者中4例存活,而未接受TOF治疗的8例患者中仅有2例存活,但因例数过少,无法进行统计学分析,有待于进一步扩大样本量进行比较。同时,接受TOF治疗的4例存活患者在随后激素逐渐减量的过程中,病情稳定,未见复发或加重,提示TOF可能有助于降低激素减量过程中的复发率。
本组联合TOF治疗的5例患者在发病初期即出现外周血淋巴细胞计数明显下降(平均0.9×109/L),加上并发了ILD,极易出现肺部感染。因此,入院后均行床边支气管镜检查,取BALF行病原体高通量测序,结果发现例1有肺孢子菌感染,抗感染治疗2周后发热得到控制,但气促无明显改善,复查肺部CT提示病变加重,再次复查BALF病原体为阴性后给予TOF治疗,其余4例在排除感染后立即启动TOF治疗。作为Janus激酶抑制剂,使用TOF治疗前应排除感染。BALF检查除可用于排除感染外,还有助于ILD病理类型及预后的判断。据文献报道,健康非吸烟者的BALF细胞学检查结果正常参考值为:巨噬细胞>85%,淋巴细胞10%~15%,中性粒细胞≤3%,嗜酸粒细胞≤1%,鳞状上皮细胞或纤毛柱状上皮细胞均≤5%[12]。ILD患者BALF细胞学检查结果提示,激素及免疫抑制剂对BALF以淋巴细胞为主者疗效好,而对中性粒细胞>5%者的疗效差[13-14]。本组存活的4例患者,BALF细胞学检查结果均以淋巴细胞为主,而死亡患者的BALF中性粒细胞比例高达22%,BALF细胞学检查结果对ILD预后的判断与上述文献报道一致。
TOF治疗过程中,除1例出现轻度带状疱疹外,其余未见严重不良反应。TOF可引起贫血及淋巴细胞减少,但本组4例患者监测血红蛋白并无明显变化,同时淋巴细胞计数较治疗前有所上升,可能因为淋巴细胞减少本身就是ILD预后不良的危险因素[15],而治疗后淋巴细胞上升可能是药物的作用效果。
鉴于抗MDA5抗体阳性的ADM并发RP-ILD的预后差,治疗棘手,本组病例分析提示,临床上对此类患者的治疗要更加积极,在排除感染风险,给予传统的激素及免疫抑制剂治疗的同时,应尽早加用TOF,以改善患者的症状和预后。近年来研究者才逐渐认识到肌炎特异性抗体与炎性肌病的临床表现密切相关,加之TOF治疗ADM并发RP-ILD尚处于尝试阶段,使得本研究只能对少数样本进行回顾性分析,且评估的时间也较短,将来还需积累病例和延长随访时间以便进一步分析。
(志谢:感谢福建省三明市第一医院吴培埕医师为本文CT图片的收集给予的帮助。)