基于网络药理学方法探讨“白术-茯苓”药对抗胃癌的作用机制
2021-10-14李国秋张嘉雪陈子铮陈林耿吴晓怡张韧
李国秋 张嘉雪 陈子铮 陈林耿 吴晓怡 张韧
【摘要】目的:通过网络药理学方法探讨“白术-茯苓”药对抗胃癌(GC)的作用机制。方法:通过ETCM数据库确定“白术-茯苓”药对的有效成分,在Swiss Target Prediction平台预测“白术-茯苓”药对有效成分对应的潜在靶点,并检索Genecard、OMIM、Pharmgkb、TTD,Drug Bank等疾病数据库,以获得“白术-茯苓”药对抗GC的作用靶点。通过Sting数据库和Cytoscape 3.2.1构建蛋白相互作用网络(PPI),通过Metascape平台对“白术-茯苓”药对抗GC作用靶点进行KEGG通路分析。结果:从“白术-茯苓”药对中获得38个有效成分,62个与“白术-茯苓”药对抗GC相关的作用靶点,经KEGG通路富集分析发现“白术-茯苓”药对抗GC作用机制主要涉及“癌症途径(pathway in cancer)”、“类固醇激素合成(Steroid hormone biosynthesis)”,“过氧化物酶体增殖物激活受体信号通路(PPAR signaling pathway)”等信号通路。结论:研究初步发现了“白术-茯苓”药对通过“多成分-多靶点-多通路”模式发挥着抗GC的临床作用,为“白术-茯苓”药对配伍的深入研究提供了新的思路。
【关键词】茯苓-白术;网络药理学;胃癌;作用机制
【中图分类号】R285.5 【文献标志码】 A【文章编号】1007-8517(2021)23-0029-06
Study on the Mechanism of Baizhu-Fuling Herbal Pair for Anti-Gastric Cancer Based on Network Pharmacology
LI Guoqiu1ZHANG Jiaxue1CHEN Zizheng1CHEN Lingeng1WU Xiaoyi1ZHANG Ren2*
1. First Clinical Medical College,Guangzhou University of Chinese Medicine,Guangzhou 510405,China;
2. School of Fundamental Medical Science,Guangzhou University of Chinese Medicine,Guangzhou 510006,China
Abstract:Objective To study the mechanism of Baizhu-Fuling Herbal Pair for anti-gastric cancer based on network pharmacology.Methods The Baizhu-Fuling Herbal Pair active component was obtained by The Encyclopedia of Traditional Chinese Medicine Database (ETCM),the potential target of the active ingredient was predicted by the Swiss Target Prediction platform,and the disease target database such as Genecard,Pharmgkb,OMIM,TTD,Drug Bank was searched to obtain the target of Baizhu-Fuling Herbal Pair against gastric cancer.The PPI network was built with the help of the String database and Cytoscape 3.2.1 software.The target enrichment analysis of KEGG pathways were analyzed by Metascape database.Results A total of 38 active components and 62 Baizhu-Fuling Herbal Pair for anti-gastric cancer-related targets were screened from Baizhu-Fuling Herbal Pair.After enrichment analysis by KEGG pathway,it was found to regulate pathway in cancer,Steroid hormone biosynthesis,PPAR signaling pathway and other signaling path- ways. Conclusions Baizhu-Fuling Herbal Pair exerts anti-gastric cancer effects through a“multi-component-multi-target-multi-pathway” model,and provides a new idea for the in-depth study of the compatibility of Baizhu-Fuling Herbal Pair.
Key words:Baizhu-Fuling Herbal Pair; Network Pharmacology; Gastric Cancer;Mechanism
胃癌(Gastric cancer, GC)是中國常见的恶性肿瘤之一,根据2018年2月国家癌症中心发布的最新一期全国癌症统计数据显示,GC的发病率和死亡率分列所有肿瘤类型的第2位与第3位[1]。近年来,GC的发病率呈下降趋势,新型生物制剂的研发和综合治疗策略的不断发展,降低了GC的致死率,但GC的预后仍然不甚乐观。中医在控制癌症病灶发展,延长患者生存期和改善生存质量等方面表现出独特的优势,尤其是中药可提高人体免疫,调节肿瘤微环境的各组分,在肿瘤防治方面具有重要作用[2]。
白术,味苦、甘、微辛,性温,其用在中,主呕逆泄利、去湿强脾、开胃进食、和中益气。《本草通玄》曰:“白术,补脾胃之药,得中宫冲和之气,更无出其右者。土旺则能健运,故不能食者,食停滞者,有痞积者,皆用之也。”现代药理研究[3]发现,白术挥发油具有抗肿瘤、促进胃肠运动、调节胃肠功能、促进营养质吸收的功能。茯苓,味甘,性平,主利水实脾,《神农本草经疏》记载:“中焦者,脾土之所治也。中焦不治故见膈中瘀水,腹胀大也,利水实脾,则其证自退矣。”现代药理研究[4-5]发现,茯苓中的多糖和三萜类成分可保护机体的免疫器官,增强机体免疫功能,诱导肿瘤细胞凋亡,抑制胃癌细胞生长,抑制癌细胞转移,清除氧自由基。据目前相关文献报道[6],“白术-茯苓”药对抗GC的临床疗效显著,但其具体作用机制尚未见系统阐明。
网络药理学是基于系统生物学理论,采用复杂的生物网络模型,从药物、化学成分、靶点、疾病间相互作用的整体性与系统性出发,预测药物治疗疾病的药理学机制的一种方法,其与中医治病的“整体观”理论及中药多成分、多靶点、多途径、多作用的特点具有一致性[7- 8]。故本研究将运用网络药理学方法探讨“白术-茯苓”药对抗GC的作用机制。
1 材料与方法
1.1 “茯苓-白术”药对药物成分获取 中医药百科全书(The Encyclopedia of Traditional Chinese Medicine,ETCM)是由中国中医科学院中药研究所、中药资源中心、北京大学中药学院等大型单位打造的中医药数据平台,该平台收录了403味中药,7274个中药成分等数据信息,为中医药现代化研究提供了强有力的数据基础和分析平台[9]。
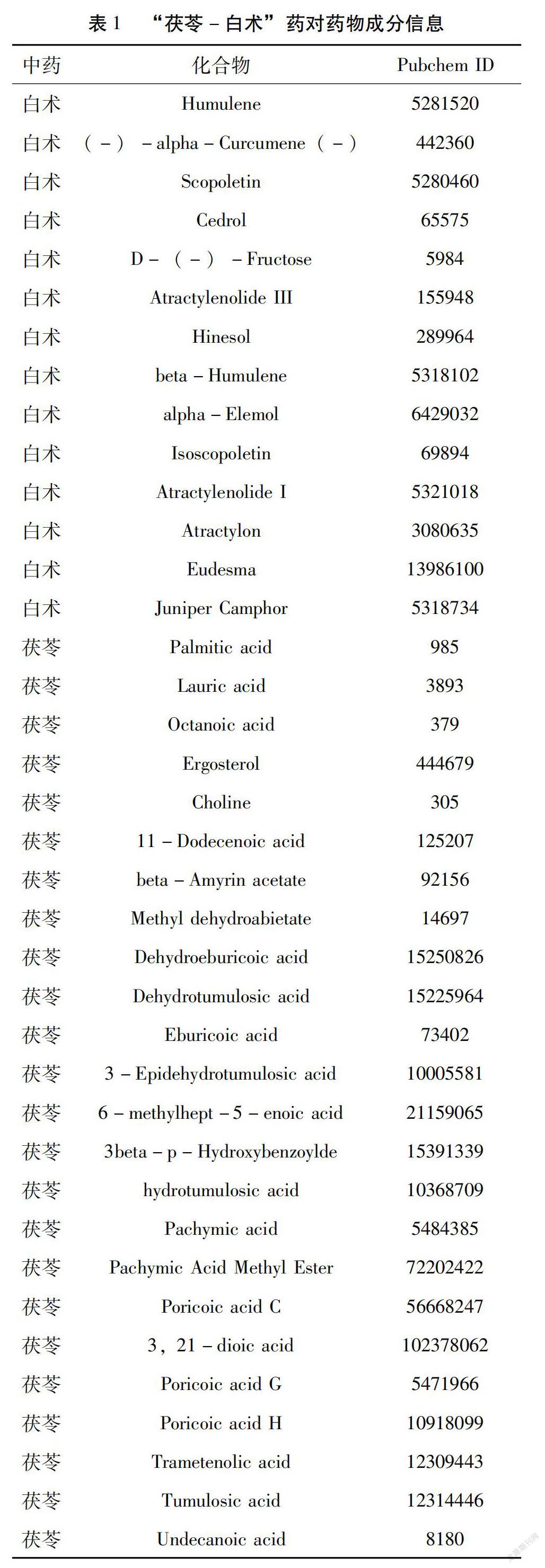
运用ETCM(ETCM, http://www.tcmip.cn/ETCM/index.php/Home/Index/)检索“白术”和“茯苓”两者的药物成分,同时记录各成分对应的“Pubchem ID”和“Canonical SMILES”。
1.2 “茯苓-白术”药对药物成分对应靶点获取 通过Swiss Target Prediction平台(http: //www.swisstargetprediction.ch /) 輸入1.1获得化合物成分的的“Canonical SMILES”格式,预测“茯苓-白术”药对药物成分对应的作用靶点。
1.3 “茯苓-白术”药对抗GC的相关靶点收集 在Genecard数据库(https://www.genecards.org/)、OMIM数据库(https://omim.org/)、Pharmgkb数据库(https://www.pharmgkb.org/)、TTD数据库(http://db.idrblab.net/ttd/)、Drug bank数据库(https://www.drugbank.ca/)输入“gastric carcinoma”检索GC相关的靶点,删除其中重复的基因。将获得的疾病靶点与1.2获得的成分作用靶点进行比对,最后获得“茯苓-白术”药对抗GC的潜在作用靶点。
1.4 “茯苓-白术”药对抗GC的潜在作用靶点相互作用网络(Protein Protein interaction,PPI)构建 在string数据库(https://string-db.org/),输入“茯苓-白术”药对抗GC的潜在作用靶点,设置物种为“Homo sapiens”,最低相互作用阈值为“medium confidence”,其余参数保持默认,获取靶蛋白相互作用数据,通过Cytoscape 3.2.1软件构建PPI网络,筛选degree值排名前10的靶点。
1.5 KEGG通路富集分析 利用Metascape数据库(http://metascape.org/gp/index.html#/main/step1) 对“茯苓-白术”药对抗GC相关靶点进行KEGG通路富集分析,结合P值,从小到大排序,筛选出前10条通路,导出csv文件,对数据进行可视化处理。
2 结果
2.1 “茯苓-白术”药对药物成分收集 通过ETCM数据库,一共获得38个化学成分,其中白术14个、茯苓24个,见表1。
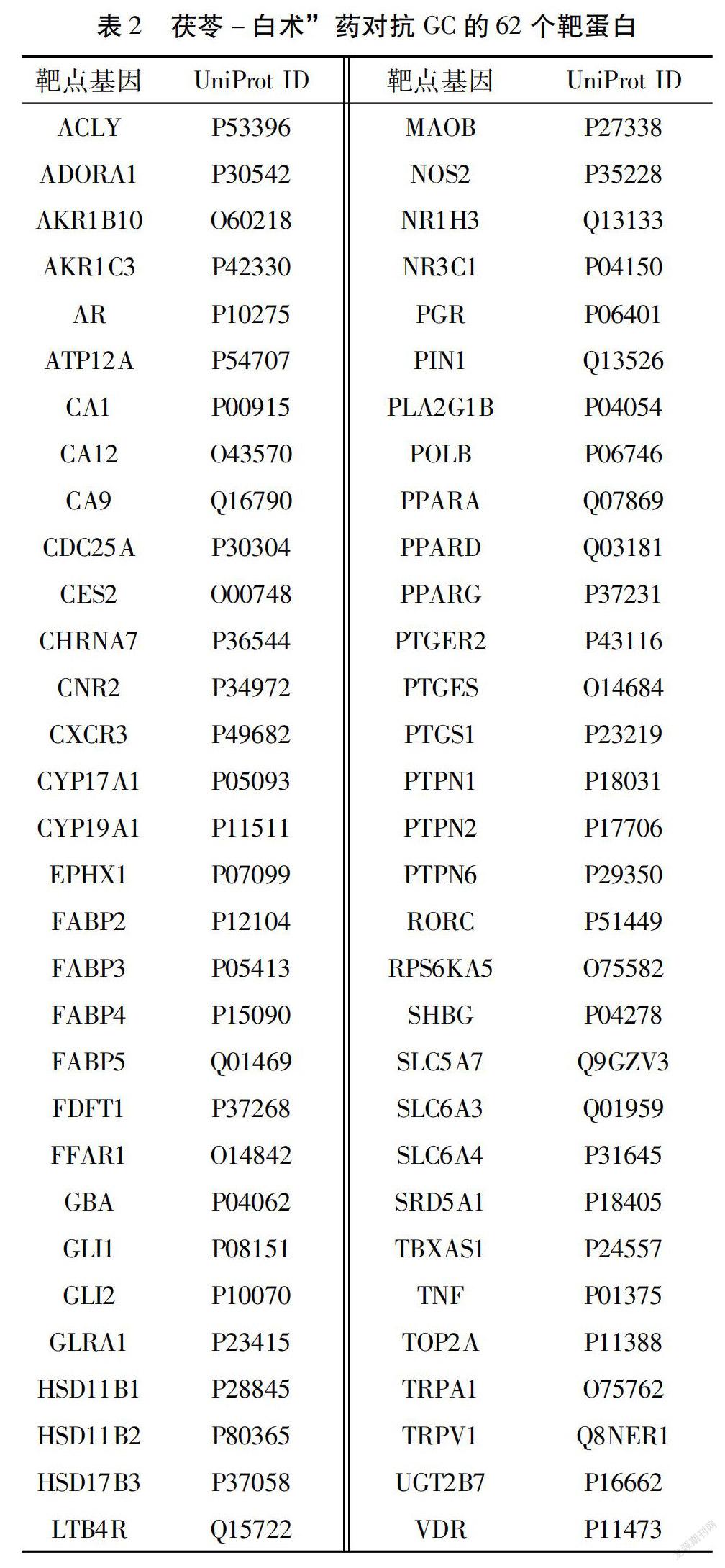
2.2 “茯苓-白术”药对抗GC相关靶点 通过Swiss Target Prediction平台,删除重复靶点后得到69个“茯苓-白术”药对药物成分的作用靶点,接着将这 69个靶点与Genecard、OMIM、Pharmgkb、TTD,和Drug Bank 5个疾病数据库收集到的GC相关基因靶点进行比对,最终得到62个“茯苓-白术”药对抗GC的相关靶蛋白,见表2。
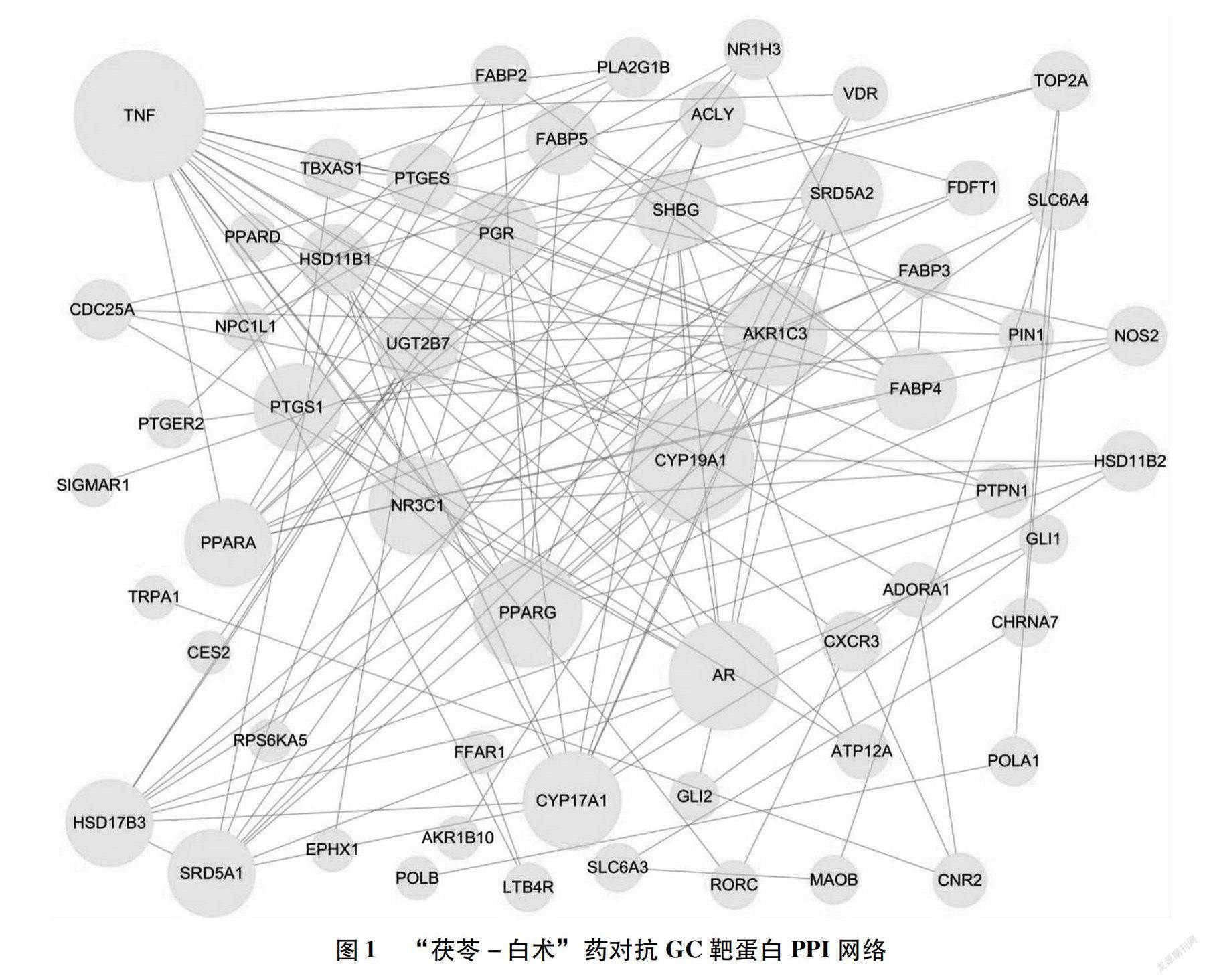
2.3 “茯苓-白术”药对抗GC的潜在作用靶点PPI分析 基于Sring数据库的62个靶蛋白的蛋白质相互作用关系数据,采用Cytoscape 3.2.1软件绘制靶蛋白PPI网络图,如图1所示。此网络共包括57个节点,143条边(若两个靶蛋白之间存在相互作用关系,则用边连接两个靶蛋白),靶蛋白degree值越大则节点越大。
同时利用Cytoscape 3.2.1软件的筛选工具,筛选出该网络中degree值排名前10 的靶蛋白,分别为TNF、CYP19A1、AR、PPARG、AKR1C3、NR3C1、CYP17A1、HSD17B3、PTGS1、SRD5A1。
2.4 KEGG通路富集分析 采用Metascape平台对“茯苓-白术”药对抗GC的62 个作用靶点进行KEGG通路富集分析,筛选前10条目(P值从小到大进行排序),并且通过Excel对结果进行可视化处理。结果如图2所示。主要通路有Steroid hormone biosynthesis、PPAR signaling pathway、Neuroactive ligand-receptor interaction、Arachidonic acid metabolism、Nitrogen metabolism、Chemical carcinogenesis、Pathways in cancer insulin resistance、Regulation of lipolysis in adipocytes、Leishmaniasis。
3 讨论
3.1 “白术-茯苓”药对抗GC相关的重要药物成分 本研究最终预测得到“白术-茯苓”药对抗GC的38个活性化合物、62个潜在作用靶点及10条通路,其化合物多样性、作用靶点多样性及通路多样性,从药理层面及分子层面论证了中药“同病异治,异病同治”原则。
现代药理研究[10]证实,白术化学成分主要为挥发油、白术多糖、氨基酸等成分,这些化学成分有抗炎、抗肿瘤、提高机体免疫力、抗衰老、调节胃肠等药理作用,茯苓中具有生物活性的化合物主要为三萜类和多糖类化合物,具有抗肿瘤、免疫调节、抗炎、抗氧化、抗衰老、增强记忆力、调节泌尿系统、降血糖等[11]。本研究中,白术-茯苓药对筛选出的化合物含多种抗癌成分,如白术内脂I、白术内脂III、茯苓酸等,白术内酯Ⅰ能够抑制MGC-803细胞的生长及繁殖,下调GC细胞表面标志物Hey1、CD44的表达,同时也包括抑制Notch信号通路,及降低Notch1、Hes1、Hey1和Jagged1蛋白的活性,从而有效地抑制GCMGC-803细胞的增殖[12]。茯苓酸能抑制GC细胞的生长和克隆形成能力,显著诱导细胞G2/M期停滞及细胞凋亡,同时调节一些凋亡相关蛋白如caspase-3,PARP, Bcl-2和Bax的蛋白表达,还能扰乱体外GC线粒体能力和抑制体内GC移植瘤生长。
3.2 “白术-茯苓”药对抗GC相关的重要作用靶点 在“白术-茯苓”药对抗GC的PPI网络中,TNF、CYP19A1、AR、PPARG、AKR1C3、NR3C1、CYP17A1、HSD17B3、PTGS1、SRD5A1在网络中处于degree值前10名,是“白术-茯苓”药对抗GC的重要潜在靶点。肿瘤坏死因子(TNF)分为两种,分别为TNF-α和TNF-β,国外研究报道,GC患者血清中TNF-α水平明显高于正常人群,手术切除GC组织后患者体内血清中TNF-α水平明显下降,但转移或复发者血清TNF-α水平再度显著升高,该现象提示TNF-α与GC的发生发展密切相关且起到促进作用[13]。毛跃锋等[14]的研究表明参芪扶正汤能明显降低Ⅲ~Ⅳ期GC患者血清中TNF-α、IL-6以及SIL-2R水平,与此同时亦能明显提高患者的免疫功能,提高其生活质量。有研究表明,雄激素受体(AR)在GC组织中高表达,且AR与年龄、性别、肿瘤大小、组织类型等均无明显相关性。调节细胞周期诸多因素的关键角色是cyclinD1,而性激素可通过与其受体结合,介导某些直接或间接机制促进cyclinD1过度表达,从而促进肿瘤细胞增殖,此外性激素经过胃肠道分解和肝内代谢可转变成低浓度的致癌物,与受体结合时可增强其与细胞核内DNA的亲和力,解除对DNA合成的抑制,恢复DNA聚合酶活性,促进细胞增殖,导致细胞恶性增殖的发生。
3.3 “白术-茯苓”药对抗GC相关的重要生物通路 根据KEGG分析结果可知,“白术-茯苓”药对抗GC的信号通路与“癌症途径(pathway in cancer)”最为相关,此外还涉及通路有“类固醇激素合成(Steroid hormone biosynthesis)”“过氧化物酶体增殖物激活受体信号通路(PPAR signaling pathway)”“神经活性配体-受体相互作用(Neuroactive ligand-receptor interaction)”“花生四烯酸代谢(Arachidonic acid metabolism)”“氮代谢(Nitrogen metabolism)”“化学致癌作用(Chemical carcinogenesis)”“胰岛素抵抗(Insulin resistance)”“脂肪细胞中脂肪分解的调节(Regulation of lipolysis in adipocytes)”。过氧化物酶体增殖物激活受体γ(PPARγ)是一类由配体激活的核转录因子,在激活状态下参与调节许多与消化道肿瘤形成有关的基因,具有抑制增殖、促进凋亡、抑制细胞周期的进程等抗肿瘤作用,被认为是开发预防治疗GC的重要靶点[15]。张顺荣等[16]研究发现,胃复方含药血浆可通过上調PPARγ基因表达的途径来抑制 SGC-7901 细胞的增殖,促进其凋亡。有研究[17]发现,胰岛素抵抗与GC的患病相关,而GC患者普遍存在糖耐量异常和胰岛素抵抗,这有可能是由于GC本身癌组织通过自分泌和旁分泌途径产生一些生长因子,从而产生和加重一胰岛素抵抗。另有研究[18]认为,高胰岛素血症可加强胰岛素样生长因子(IGF-1)的合成,而IGF-1能够促进细胞有丝分裂,抑制细胞凋亡,促进上皮细胞转化,此外还可促进血管内皮生长,因此增加了细胞恶性增殖的概率,减少肿瘤细胞的凋亡。
4 结论与展望
60%的GC患者手术或化疗后会在2~3年内复发转移,原因在于脱落和逃逸的肿瘤细胞会再次增殖并转移,而化疗药物药物对大多数腺癌缺乏敏感性,常因多药耐药导致治疗失败,或患者因无法耐受化疗药物的毒副反应而中断治疗[19-20]。研究[21]证实,中药治疗GC具有多成分、多靶点、毒副作用小、防止术后复发转移等优点。本研究运用网络药理学方法,筛选出“白术-茯苓”药对潜在活性化合物,获取其治疗GC的潜在作用靶点, 从“成分-靶点-通路”研究药物与疾病之间的相互作用规律,推测“白术-茯苓”药对的药效机理,初步阐释了其治疗GC的作用机制。但由于数据库信息的不全面、化合物的浓度及化合物间的相互作用不明确等因素,使得预测结果有一定的局限性和片面性,需要更多的临床试验与动物实验进一步去验证。
参考文献
[1]CHEN W Q,ZHENG R S,BAADE P D,et al. Cancer statistics in China, 2015[J]. CA: A Cancer Journal for Clinicians, 2016,66(2).
[2]方雪妮,周天,李泉旺,等.中药对肿瘤微环境各组分的调节作用[J].中华中医药杂志, 2018,33(2):631-634.
[3]王晶,张世洋,盛永成,等.白术治疗胃肠道疾病药理作用研究进展[J].中华中医药学刊, 2018,36(12):2854-2858.
[4]WANG N, LIU D, GUO J, et al. Molecular mechanism of Poria cocos combined with oxaliplatin on the inhibition of epithelial-mesenchymal transition in gastric cancer cells.[J]. Biomedicine & pharmacotherapy Biomedecine & pharmacotherapie, 2018:102.
[5]刘元,钱军,郭晨旭,等.茯苓对裸鼠SGC-7901胃癌细胞移植瘤的影响[J]. 中国普外基础与临床杂志, 2016,23(3):286-291.
[6]李星,樊巧玲.胃癌中医辨证与方药应用的文献研究[J].中医杂志, 2017,58(8):693-696.
[7]LI H, ZHAO L, ZHANG B, et al. A network pharmacology approach to determine active compounds and action mechanisms of ge-gen-qin-lian decoction for treatment of type 2 diabetes[J]. Evidence-based complementary and alternative medicine : eCAM, 2014:495840.
[8]SHENG S,WANG J,WANG L,et al. Network pharmacology analyses of the antithrombotic pharmacological mechanism of Fufang Xueshuantong Capsule with experimental support using disseminated intravascular coagulation rats.[J].Journal of ethnopharmacology, 2014,154(3):735-744.
[9]XU H Y, ZHANG Y Q, LIU Z M, et al. ETCM: an encyclopaedia of traditional Chinese medicine[J]. Nucleic Acids Res, 2019,47(D1):D976-D982.
[10]顾思浩,孔维崧,张彤,等.白术的化学成分与药理作用及复方临床应用进展[J].中华中医药学刊, 2020,38(1):69-73.
[11]张年,李兆星,李娟,等.茯苓的化学成分与生物活性研究进展[J].世界科学技术-中医药现代化, 2019,21(2):220-233.
[12]MA L, MAO R, SHEN K, et al. Atractylenolide I-mediated Notch pathway inhibition attenuates gastric cancer stem cell traits[J]. Biochem Biophys Res Commun, 2014,450(1):353-359.
[13]YU T, LU Q, OU X L, et al. Clinical study on gastric cancer susceptibility genes IL-10-1082 and TNF-α[J]. Genet Mol Res, 2014,13(4):10909-10912.
[14]毛跃峰,爨国庆,李彩霞.参芪扶正汤治疗Ⅲ~Ⅳ期胃癌临床研究[J].新中医, 2020,52(24):112-114.
[15]CAO L Q, SHAO Z L, LIANG H H, et al. Activation of peroxisome proliferator-activated receptor-γ (PPARγ) inhibits hepatoma cell growth via downregulation of SEPT2 expression[J].Cancer Lett, 2015,359(1):127-135.
[16]张顺荣,李东芳,何寄琴,等.胃复方含药血浆对人胃癌BGC-823细胞增殖影响的实验研究[J]. 世界中西医结合杂志, 2019,14(4):505-509.
[17]KWON H J, PARK M I, PARK S J, et al. Insulin Resistance Is Associated with Early Gastric Cancer: A Prospective Multicenter Case Control Study[J]. Gut Liver, 2019,13(2):154-160.
[18]BEGENIK H, ASLAN M, DULGER A C, et al. Serum leptin levels in gastric cancer patients and the relationship with insulin resistance[J]. Arch Med Sci, 2015,11(2):346-352.
[19]SEVGI,OZDEN,ZERRIN,et al.Survival in gastric cancer in relation to postoperative adjuvant therapy and determinants[J].World Journal of Gastroenterology,2015,21(4):1222-1233.
[20]YAMAGISHI, HIDETSUGU, TERABO, et al. Evaluation of a novel high-resolution magnifying videoendoscope that is capable of photodynamic diagnosis and therapy for gastric cancer[J]. Photodiagnosis and photodynamics therapy, 2015, 12(1):115-122.
[21]李亞,李蕊白,王俭,等.中药复方抗胃癌基础研究现状与展望[J].世界中医药,2020,15(20):3142-3146.
(收稿日期:2021-04-13 编辑:刘 斌)
