竹节香附素A通过JAK/STAT3通路抑制卵巢癌SKOV3细胞增殖和侵袭的实验研究
2021-10-13樊素珍赵书君秦巧红郜翔王宝金李红雨
樊素珍,赵书君,秦巧红,郜翔,王宝金,李红雨
(郑州大学第三附属医院 妇科,河南 郑州 450000)
卵巢癌是女性生殖器官常见的恶性肿瘤之一,发病率次于子宫颈癌、子宫内膜癌而列居第三位,但其死亡率却高居妇科恶性肿瘤首位[1-2]。卵巢癌发病隐匿且病情进展迅速,大多数患者确诊时已是晚期,此时临床治疗困难,预后差,患者长期生存率低,对妇女生命健康造成极大威胁[3]。竹节香附为多被银莲花的干燥根茎,具有明显的抗肿瘤、抗炎、解热、镇痛等作用,其中竹节香附素A(RA) 的抗肿瘤活性成分可抑制胃癌细胞株BGC-823 的增殖、迁移侵袭[4],并可诱导肝癌细胞凋亡、抑制肝癌细胞血管生成,增强其化疗敏感性[5],因而RA可能对卵巢癌SKOV3 细胞增殖及侵袭具有抑制作用。JAK/STAT3 通路在多种癌症中处于异常的高激活状态,且与临床的不良预后有关,因此抑制该通路激活,可直接抑制肿瘤细胞生长,增强抗肿瘤免疫功能,进而提高临床疗效[6]。另外,JAK/STAT3 通路还与化疗药物耐药性相关,抑制其激活,可降低乳腺癌细胞的耐药性[7]。在对胃癌的研究中发现,RA 抑制胃癌细胞BGC-823 中STAT3 信号的激活[4],但RA 对卵巢癌SKOV3 细胞中JAK/STAT3 通路的影响目前尚不清楚,本文通过体外培养卵巢癌SKOV3 细胞,研究RA 是否通过JAK/STAT3通路抑制卵巢癌SKOV3 细胞增殖和侵袭。
1 材料与方法
1.1 试剂与材料
卵巢癌细胞SKOV3,上海宾穗生物科技有限公司,货号:BS-C00767533;竹节香附素A(RA),中国药品生物制品检定所,批号:141113;顺铂( 纯度:98.5%),上海恒斐生物科技有限公司,批号:D8810;RPMI-1640 培养基、胎牛血清(FBS)、青链霉素混合液、PBS 缓冲液、胰蛋白酶-EDTA 消化液,美国Solarbio公司,货号分别为:31800、11011-8611、P1400、P1022、T1300;AnnexinV/PI 凋亡检测试剂盒,美国BD 公司,货号:556547;兔源GAPDH 一抗、兔源Bax一抗、鼠源Bcl-2 一抗、羊抗鼠二抗、羊抗兔二抗,美国Cell Singaling Technology 公司,货号分别为:PA5-85082、PA5-11378、13-8800、A-11029、A-11034; 兔源E-cadherin、Vimentin、JAK、p-JAK、STAT3、p-STAT3一抗,美国Abcam 公司,货号分别为:ab76319、ab193555、ab133666、ab138005、ab68153、ab76315;结晶紫染色液、蛋白裂解液、CK-8 试剂盒、BCA 试剂盒,上海碧云天公司,货号分别为:C0121、P0013K、C0037、P0011 等。
1.2 主要仪器
Elx800酶标仪购自美国Bio-Rad 公司;Olympus CKX41显微镜购自德国Leica 公司;IBright CL 1500凝胶成像系统购自美国Thermo Fisher Scientific公司;CytoFLEX流式细仪购自美国贝克曼库尔特公司;Centrifuge 5424R 低温高速离心机购自德国Eppendorf 股份公司;Mini-PROTEAN Tetra 蛋白电泳仪、Trans-Blot Turbo 转膜仪购自美国Bio-Rad 公司等。
1.3 方法
1.3.1 细胞培养
向RPMI-1640 基础培养基中加入10%胎牛血清、100 U/mL 青链霉素溶液,上下颠倒混匀得完全培养基,将购买的卵巢癌细胞SKOV3 解冻复苏,以完全培养基培养重悬后,接种在25 cm2培养瓶中,置于37℃、5% CO2、95%湿度的恒温培养箱中培养,当细胞在瓶底长至80%左右时,胰酶消化后,以1∶3 的比例传代培养。
1.3.2 CK-8 实验
将RA 以RPMI-1640 基础培养基溶解后配制为浓度90 µmol/L 的储备液备用。使用1.3.1 中的传代细胞接种于96 孔板中,密度约为0.6×105个/mL,培养24 h 后参照文献[8],以0、2、4、8、16 µmol/L 浓度的RA 处理,每个浓度设置5 个孔作为重复,继续培养12 h、24 h、48 h、72 h 后每孔加入CK-8 试剂,采用全自动酶标仪检测450 nm 波长下各孔吸光度值,计算每个浓度的RA对SKOV3 细胞的增殖抑制率,实验重复3 次。公式:细胞增殖抑制率(%)=(NC 组吸光度- 实验组吸光度)/NC组吸光度×100%。
1.3.3 细胞活力检测
取1.3.1 中的传代细胞接种在96 孔板中,密度约为0.6×105个/mL,培养24 h 后随机分为三组:不做任何处理(NC 组)、RA 组、顺铂组(PDD 组),分别以16 µmol/LRA、5 μmol/LPDD[9]处 理48 h,按 照1.3.2中的方法测定各组吸光度,计算各组细胞的细胞活力,公式:细胞活力(%)= 药物处理组吸光度/NC 组吸光度×100%,实验重复三次。
1.3.4 细胞凋亡检测
取1.3.1 中的传代细胞接种在12 孔板中,参照1.3.3中的方法分组处理48 h 后收集各组细胞,以PBS 重悬后计数,取约含有1×106个细胞的细胞悬液至做好组别标记的无菌EP 管中,转速1 000 r/min,离心半径13.5 cm,离心5 min,以PBS 溶液漂洗细胞沉淀2 次,加 入500 µL Binding Buffer、10 µL AnnexinV-FITC 及5 µL PI 后,轻轻吹打细胞使之充分混匀,室温,避光反应15 min,转速1 000r/min,离心半径13.5 cm,离心5 min,细胞沉淀以PBS 溶液漂洗2 次后以PBS 重悬,轻轻吹打成为均匀的单细胞悬液,采用流式细胞仪检测细胞凋亡情况,以Muticycle AV 软件分析所得数据,实验重复三次。
1.3.5 细胞迁移侵袭检测
取1.3.1 中传代细胞接种在12 孔板中,参照1.3.3中的方法分组处理12 h 后收集各组细胞,以细胞划痕实验检测各组细胞的迁移力,各组细胞以完全培养基分别重悬后计数,以5×105个/mL 的密度接种于6 孔板中,使用无菌直尺做标尺,以200 μL 枪头在6 孔板中心划一条直线,以PBS 漂洗干净划痕中的细胞,继续培养24 h,在显微镜随机选取5 个视野观察并拍照,计数迁移细胞数目,取平均值,实验重复三次。
取1.3.1 中的传代细胞接种在12 孔板中,参照1.3.3中的方法分组处理12 h 后收集各组细胞,以Transwell侵袭实验检测各组细胞的侵袭力,各组细胞经无血清的RPMI-1640 基础培养基分别重悬后计数,调整密度为5×105个/mL,Transwell 上室以基质胶包被后加入200 μL 上述细胞悬液,下室中加入完全培养基,置于37℃、5% CO2、95%湿度的恒温培养箱中培养24 h,取出小室,用棉签擦去基质胶和上室内的细胞,以PBS 漂洗后加入4% 多聚甲醛固定下室细胞,以结晶紫染液染色,在显微镜随机选取5 个视野观察并拍照,计数穿膜细胞数目,取平均值,实验重复三次。
1.3.6 免疫印迹实验
取1.3.1 中的传代细胞接种在12 孔板中,参照1.3.3 中的方法分组处理48 h 后收集各组细胞,加蛋白裂解液( 含有蛋白酶抑制剂) 在冰浴中裂解2 h,转速3 000 r/min,温度为4℃,离心20 min,取上清提取总蛋白,以BCA 试剂盒测定蛋白浓度,具体按照说明书操作,调整各组细胞样品液使蛋白浓度相同,各组细胞分别取20 μL 做SDS-凝胶电泳,转移蛋白至硝酸纤维膜上,用5% 脱脂牛奶室温封闭2 h,以相应一抗、二抗孵育,以增强型化学发光法显色,在凝胶成像系统中观察蛋白条带并拍照,采用Image Lab 软件分析数据得出蛋白相对表达量,实验重复三次。
1.4 统计学分析
所有数据以SPSS 24.0 软件进行统计学分析,计数数据以n(%) 表示;计量数据以±s表示,组间比较行单因素方差分析,两两比较行LSD-t检验,P<0.05 表示差异有统计学意义。
2 结 果
2.1 RA 对SKOV3 细胞增殖的影响
RA 对SKOV3 细胞增殖有抑制作用,并随着药物浓度升高、药物作用时间增长而增强,在药物浓度为16 µmol/L,作用48、72 h 后,抑制作用不再增强,趋于稳定。48 h 与72 h 相比,差异无统计学意义(P>0.05)。结果显示,16 µmol/L 的RA 处理SKOV3 细胞48 h 后,增殖抑制率达(56.87±6.38)%。见图1。因此,本实验选择16 µmol/L 的RA 处理SKOV3 细胞48 h 来进行增殖、凋亡实验;RA 对SKOV3 细胞增殖的抑制作用可能干扰对其迁移侵袭能力的检测,为保证实验结果尽量准确,选择RA 处理SKOV3 细胞12 h 进行迁移侵袭能力的检测。
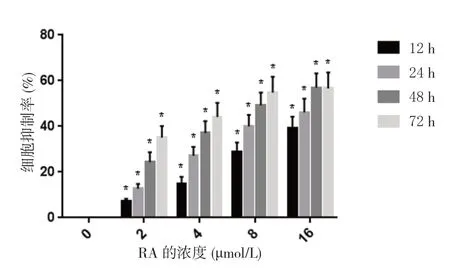
图1 RA 对SKOV3 细胞增殖抑制率的影响
2.2 RA 对SKOV3 细胞活力的影响
以16 µmol/L 的RA、5 μmol/L 的PDD 处 理SKOV3细胞48 h,RA 组与PDD 组细胞活力显著低于NC组(P<0.05),RA 组和PDD 组相比,差异无统计学意义(P>0.05)。见图2。
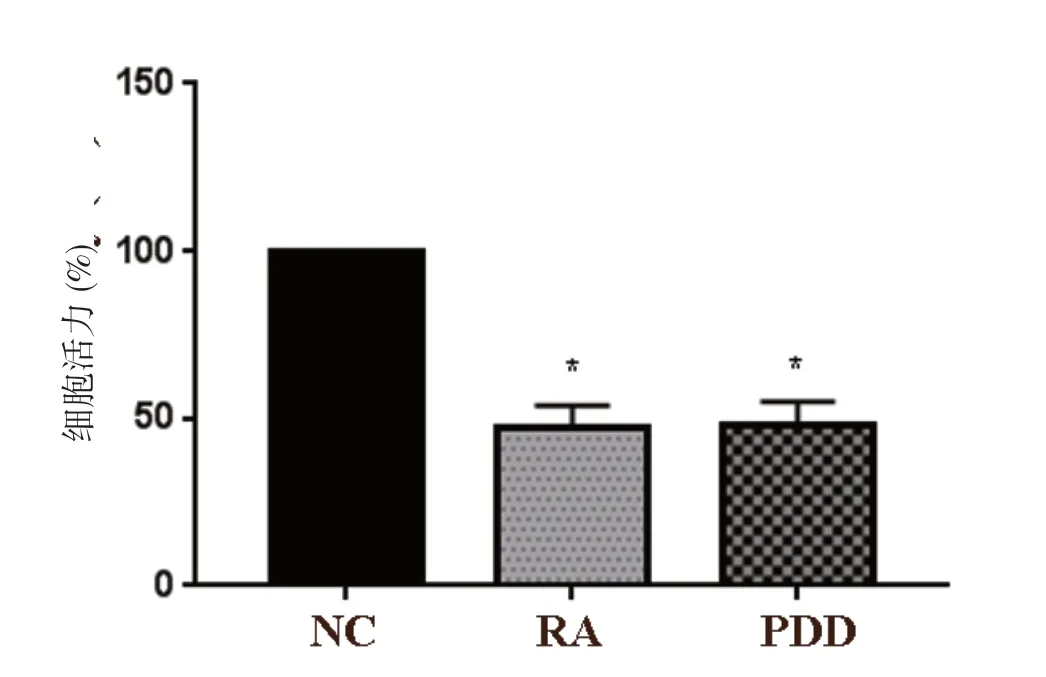
图2 RA 对SKOV3 细胞活力的影响
2.3 RA 对SKOV3 细胞凋亡的影响
RA 组及PDD 组SKOV3 细胞凋亡率显著高于NC组(P<0.05),RA 组和PDD 组相比,差异无统计学意义(P>0.05)。见图3、图4。
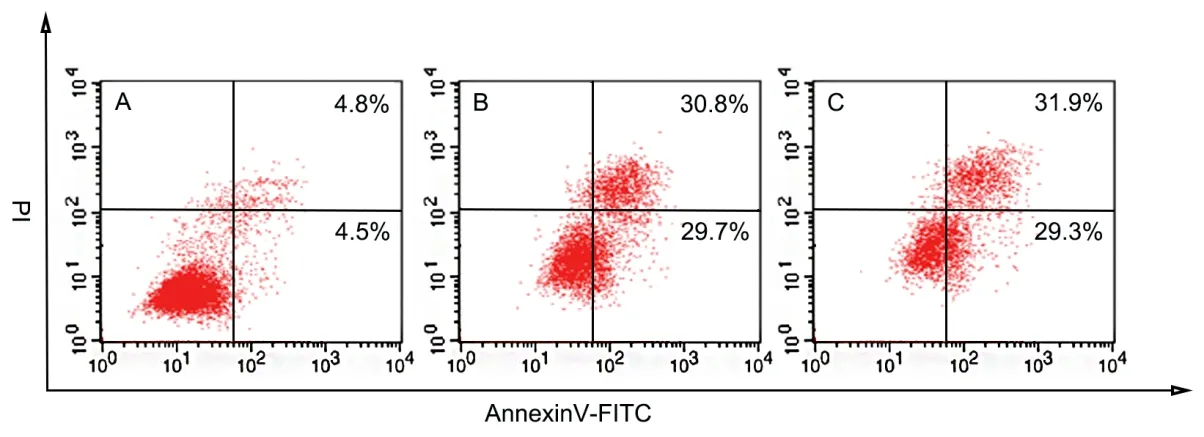
图3 RA 对SKOV3 细胞凋亡的影响
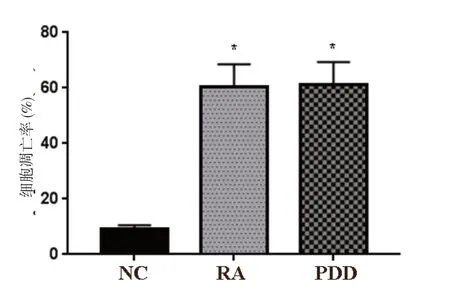
图4 RA 对SKOV3 细胞凋亡的影响
2.4 RA 对SKOV3 细胞迁移的影响
RA 组及PDD 组迁移的SKOV3 细胞数目显著低于NC 组(P<0.05),RA 组和PDD 组相比,差异无统计学意义(P>0.05)。见图5、图6。

图5 RA 对SKOV3 细胞迁移的影响
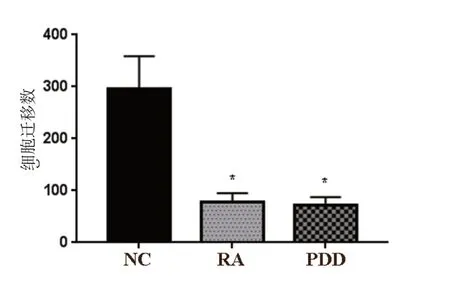
图6 RA 对SKOV3 细胞迁移的影响
2.5 RA 对SKOV3 细胞侵袭的影响
与NC 组相比,RA 组和PDD 组侵出transwell 小室的SKOV3 细胞数目明显降低(P<0.05),RA 组和PDD组相比,差异无统计学意义(P>0.05)。见图7、图8。
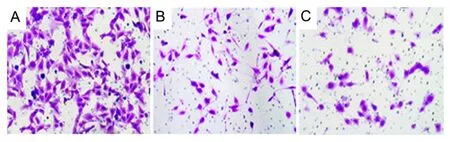
图7 RA 对SKOV3 细胞侵袭的影响
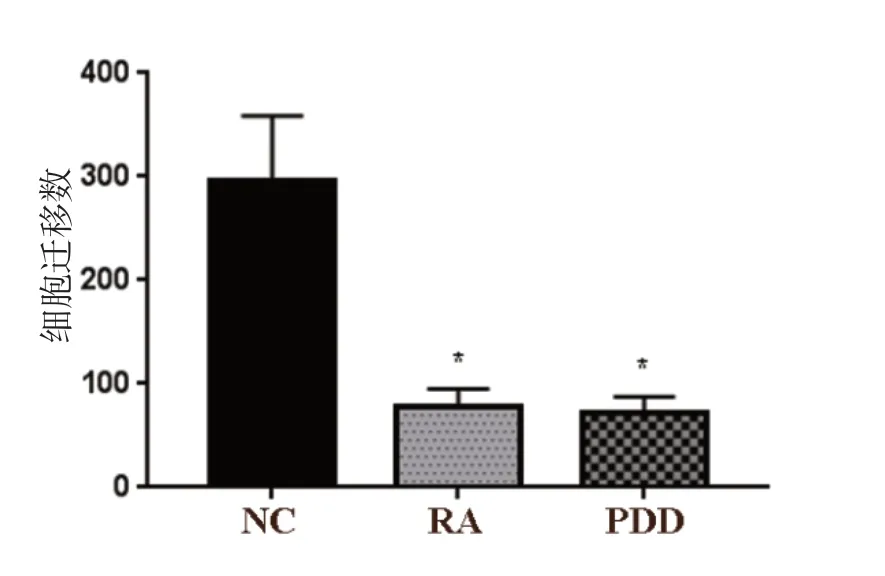
图8 RA 对SKOV3 细胞侵袭的影响
2.6 RA 对SKOV3 细胞凋亡及EMT 相关蛋白的影响
RA 组 和PDD 组SKOV3 细胞Vimentin、Bcl-2 表达显著低于NC 组(P<0.05),E-cadherin、Bax 表达显著高于NC 组(P<0.05),RA 组和PDD 组相比,差异无统计学意义(P>0.05)。见图9。
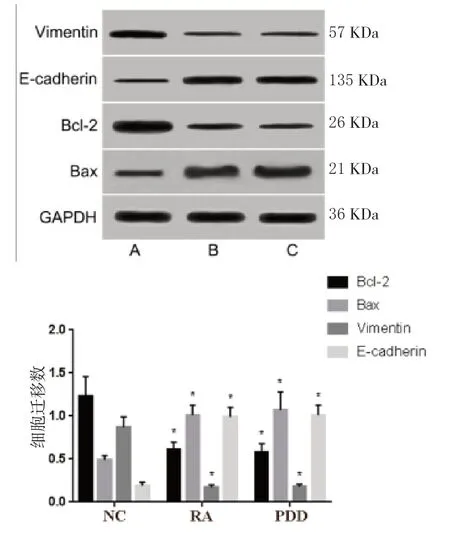
图9 RA 对SKOV3 细胞凋亡及EMT 相关蛋白表达的影响
2.7 RA 对SKOV3 细胞JAK/STAT3 通路相关蛋白的影响
RA组和PDD组SKOV3 细胞p-JAK/JAK、p-STAT3/STAT3 表达显著低于NC 组(P<0.05),RA 组和PDD 组相比,差异无统计学意义(P>0.05)。见图10。
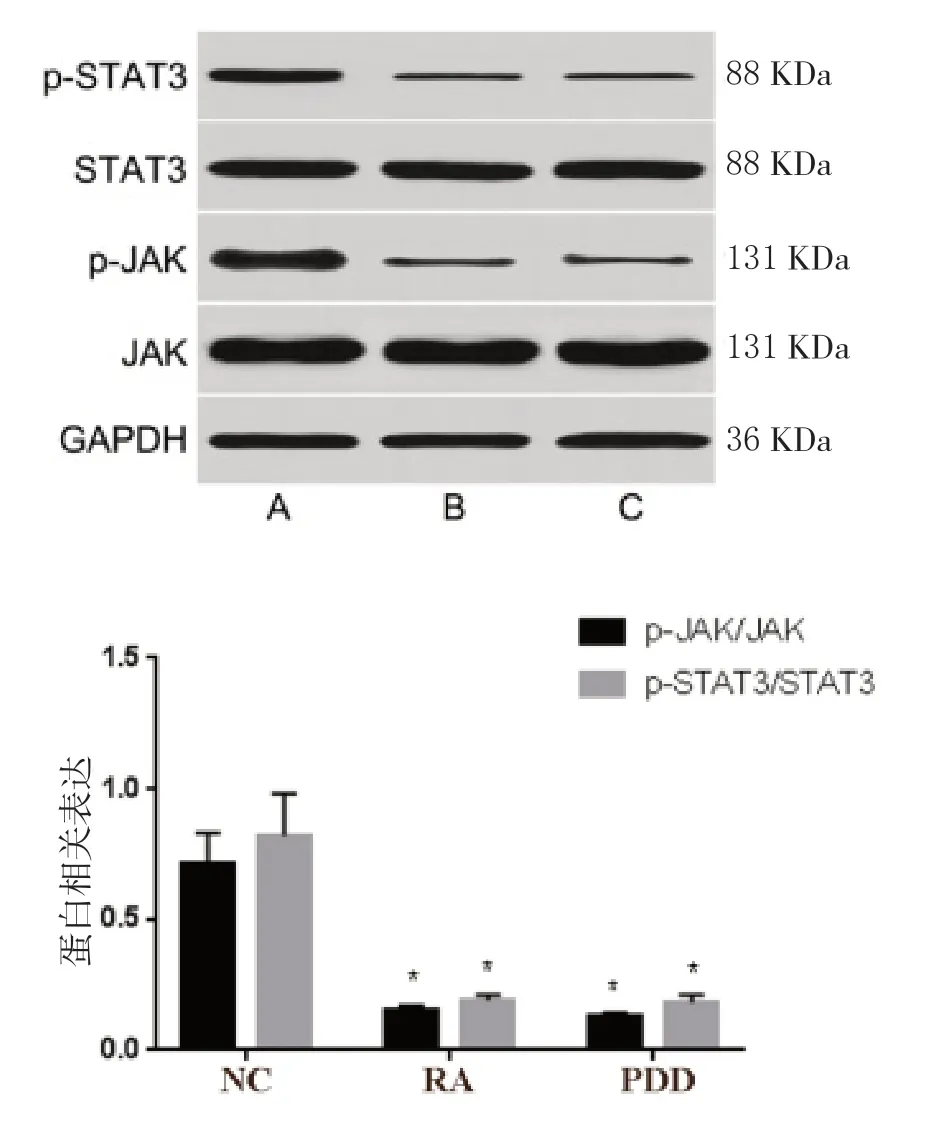
图10 RA 对SKOV3 细胞JAK/STAT3 通路相关蛋白表达的影响
3 讨 论
卵巢癌作为妇科常见的恶性肿瘤,其发病率和死亡率逐渐上升,且患者也越来越趋于年轻化[10],肿瘤细胞减灭手术后以紫杉醇联合铂类为主联合化疗是临床中治疗卵巢癌的标准治疗方案,但因大多数患者已到肿瘤中晚期,易产生化疗耐药性,并复发转移,治愈率及患者生存率均很低,因此寻找新的安全有效的药物具有重要的临床意义[11]。研究表明,中药可通过多靶点、多环节发挥抗肿瘤作用,且毒副作用低、不易产生耐药性,是近年来研究的热点[12],多被银莲花的干燥根茎竹节香附具有明显的抗肿瘤效应,RA 是其主要的有效活性成分,可通过下调长链非编码RNA HOTAIR 表达抑制胃癌细胞增殖[13],还可抑制人结肠癌细胞HCT-116 增殖、迁移及侵袭,促进其凋亡[14],但其对卵巢癌细胞SKOV3 增殖及侵袭转移能力的影响目前尚不清楚。本文通过以RA处理体外培养的卵巢癌SKOV3 细胞对此进行研究,PDD可与细胞DNA 链交叉连接,杀伤细胞,具有明显的抗肿瘤作用,是临床上常用的广谱抗癌药[15],因而本文使用PDD 作为阳性药物,抑凋亡蛋白Bcl-2 与促凋亡蛋白Bax 是细胞凋亡过程中起到重要调节作用的关键蛋白[16],结果显示,RA 组与PDD 组SKOV3 细胞活力、Bcl-2 表达显著低于NC 组,凋亡率、Bax 表达显著高于NC 组,RA 组和PDD 组相比,各指标无明显变化,表明RA 可抑制SKOV3 细胞增殖,促进其凋亡;上皮细胞向间质细胞的转化过程(EMT) 是肿瘤细胞向机体别处迁移侵袭的关键步骤,在此过程中,上皮细胞标志蛋白E-cadherin表达下调,间质细胞标志蛋白Vimentin 表达上调[17],SKOV3 细胞经RA 及PDD 处理后,其侵袭迁移能力、Vimentin 表达明显降低,E-cadherin 表达明显增加,RA组和PDD 组相比,各指标无明显变化,表明RA 可降低SKOV3 细胞迁移侵袭力。
JAK/STAT3 信号通路对肿瘤增殖、凋亡、肿瘤免疫具有重要的调节作用,卵巢癌组织中JAK/STAT3 信号处于激活状态,并促进癌细胞增殖、诱导癌组织中免疫抑制分子PD-L1 的表达,促使卵巢癌细胞免疫逃逸[18],而陈悦群[19]等发现,RA 可通过抑制JAK/STAT3 信号通路而抑制人子宫内膜癌HEC-1-B 细胞的侵袭转移,因而可推测抑制JAK/STAT3 信号激活可能是RA 抑制卵巢癌SKOV3 细胞增殖和侵袭的作用机制,本文研究结果显示,SKOV3 细胞经RA 及PDD 处理后,细胞p-JAK/JAK、p-STAT3/STAT3 明显降低,RA 组和PDD 组相比,无明显变化,表明RA 可抑制卵巢癌SKOV3 细胞JAK/STAT3信号磷酸化激活,揭示RA 抑制卵巢癌SKOV3 细胞增殖和侵袭的作用机制可能是下调JAK/STAT3 信号。
综上所述,RA 可抑制卵巢癌SKOV3 细胞增殖、体外侵袭转移,促进其凋亡,为临床治疗卵巢癌提供了新的参考,抑制JAK/STAT3 信号磷酸化激活可能是其作用机制,但本文并未使用JAK/STAT3 通路抑制剂及激活剂对其进行NC 验证,还存在不足,起确切的分子机制需要进一步的深入研究。
