甘蔗NBS-LRR类抗梢腐病基因的筛选及定量表达分析
2021-10-12王泽平宋修鹏颜梅新李毅杰李翔张小秋唐红琴龙盛风
王泽平 宋修鹏 颜梅新 李毅杰 李翔 张小秋 唐红琴 龙盛风

摘要 本文旨在探討核苷酸结合位点和富含亮氨酸重复(NBS-LRR)类基因参与甘蔗抗梢腐病菌侵染应答机制,为后续克隆关键抗病基因以及研究抗病机理提供理论依据。试验利用Illumina高通量转录组测序技术检测高抗梢腐病品种‘粤糖94-128和高感梢腐病品种‘桂糖37号接种前后NBS-LRR类抗梢腐病基因的表达情况,然后设计引物对显著差异表达基因进行不同接种时期下的荧光定量PCR验证。结果表明,16个NBS-LRR类基因在甘蔗叶片受到梢腐病菌侵染后持续上调表达,但表达趋势存在两种情况,13个基因在诱导后7 d显著或极显著上调表达,3个基因在诱导7 d后上调表达不显著,在诱导14 d后才显著上调表达。据此可将其分为瞬时基础防御基因(0~7 d)和滞后特异性防御基因(14~21 d),确定NBS-LRR类基因参与甘蔗防御梢腐病菌的侵染。
关键词 甘蔗; 梢腐病; 转录组; NBS-LRR
中图分类号: S 556.1, S 435.661
文献标识码: A
DOI: 10.16688/j.zwbh.
2020301
Screening and quantitative analysis of NBS-LRR gene against pokkah boeng disease in sugarcane
WANG Zeping1, SONG Xiupeng1, YAN Meixin1, LI Yijie1, LI Xiang1,ZHANG Xiaoqiu1, TANG Hongqin2*, LONG Shengfeng3*
(1. Sugarcane Research Institute, Guangxi Academy of Agricultural Sciences, Sugarcane Research Center,
Chinese Academy of Agricultural Science, Key Laboratory of Sugarcane Biotechnology and Genetic
Improvement (Guangxi), Ministry of Agriculture and Rural Affairs, Nanning 530007, China;
2. Institute of Agricultural Resources and Environment, Guangxi Academy of Agricultural Sciences,
Nanning 530007, China; 3. Guangxi Academy of Agricultural Sciences, Nanning 530007, China)
Abstract
The molecular mechanism of nucleotide binding sites and leucine-rich replication (NBS-LRR) genes resistant to pokkah boeng disease (PBD) in sugarcane was explored to provide a theoretical basis for cloning resistant genes. This study firstly used Illumina high-throughput transcriptome sequencing technology to detect NBS-LRR genes against PBD with typical resistant and susceptive sugarcane materials, and then designed primers to verify the expression characteristics of significant differentially expressed NBS-LRR genes under different inoculation periods using real-time quantitative PCR (qRT-PCR). The results showed that 16 NBS-LRR-like genes steadily increased expression when sugarcane leaves were infected with the PBD pathogen, including two trends in expression: 13 genes significantly or extremely significantly increased expression at 7 d post-inoculation, but three genes did not significantly increased expression at 7 d post-inoculation, but significantly increased expression at 14 d post-inoculation. Therefore, these genes could be divided into instantaneous basic defense genes (0 d to 7 d) and specific lagging defense genes (14 d to 21 d), suggesting that NBS-LRR genes are actively involved in resistance against the PBD pathogen.
Key words
sugarcane; pokkah boeng disease; transcriptome; NBS-LRR
甘蔗梢腐病(pokkah boeng disease)作为一种真菌性气传病害,其发生几乎遍及所有的甘蔗生产国家和地区,在我国主产蔗区广西已上升为仅次于黑穗病的主要病害[1]。生产上主要是通过喷施多菌灵进行防治,而挖掘抗病基因进而利用其进行杂交聚合育种是解决当前主栽甘蔗品种抗病性有限的重要途径。随着克隆技术的发展,目前对植物抗病基因的结构有了全面的认识,在许多植物中已克隆出抗病基因,且多种植物的核苷酸结合位点和富含亮氨酸重复(nucleotide binding sites and leucine-rich replication,NBS-LRR)类抗病基因的数目已确定[2]。在甘蔗抗病基因同源序列研究方面,Rossi等[3]采用与典型病原菌抗性基因同源比对的方法,从甘蔗EST数据库中获得88个抗病基因同源片段(resistance gene analogs, RGAs),并研究了它们在甘蔗基因组中的分布;McIntyre等[4]从54个RGAs中确定了3个与甘蔗抗锈病相关的RGAs;Wanderley-Nogueira等[5]通过基因芯片研究表明,甘蔗抗病基因在非诱导条件下能在根茎叶中表达;阙友雄等[6]从高抗甘蔗黑穗病品种‘NCo 376的基因组中克隆了一个NBS-LRR类基因的cDNA全长片段并推测其可能为抗病相关基因;贺尔奇等[7]根据已克隆的植物抗病基因保守结构域设计简并引物,采用RT-PCR方法对抗病果蔗品种‘黔糖5号的RNA进行扩增,共获得7条果蔗NBS-LRR类抗病同源基因,這些抗病基因同源序列与基因 RPM1 和RPS2的亲缘关系较近[8]。本课题组在前期进行甘蔗防御梢腐病菌侵染生理生化机制相关研究过程中,发现不同遗传背景的甘蔗品种抗性存在显著差异[9-11]。而对于大部分NBS类抗病基因来说,其只具有专化抗性,随着病原菌的变异,植物抗病性很容易丧失。此外,利用Illumina RNA-Seq高通量测序技术可以对生物个体在特定时刻、特定组织的基因表达情况进行整体水平研究,在发掘甘蔗目标基因方面已得到充分应用[12-13]。因此,本试验拟通过对高抗梢腐病品种‘粤糖94-128和高感梢腐病品种‘桂糖37号进行转录组测序,分析其接种梢腐病菌前后的差异基因表达谱,验证NBS-LRR 类抗病基因表达规律,为最终克隆获得甘蔗抗梢腐病基因奠定基础。
1 材料与方法
1.1 材料与试验设计
试验以多次筛选鉴定的高抗甘蔗梢腐病品种‘粤糖94-128(‘YT 94-128)和高感甘蔗梢腐病品种‘桂糖37号(‘GT 37)作为转录组测序材料,以农业农村部广西甘蔗生物技术与遗传改良重点实验室保存的轮枝镰刀菌Fusarium verticillioides孢子悬浮液为接种液(孢子浓度为1×106个/mL)。在甘蔗5~6叶期采用针刺法[10]进行接种,并遮阴保湿,保持大棚温度20~35℃,湿度80%~85%。于病情指数最严重阶段即接种后第14天采集甘蔗+1叶(接种病原菌和清水的2个甘蔗品种,各含3次生物学重复,共计12个样品,每个样品各1.000 0 g)经液氮速冻,保存于-80℃冰箱备用。
1.2 叶片总RNA提取、cDNA文库构建及Illumina测序
利用TRIzol法提取样品总RNA后,用带有Oligo(dT)的磁珠富集mRNA,向得到的mRNA中加入fragmentation buffer使其打断成为短片段,再以打断后的mRNA为模板,用6碱基随机引物合成cDNA第一链,并加入缓冲液、dNTPs、RNase H和DNA polymerase I合成cDNA第二链,经过QiaQuick PCR试剂盒纯化并加入EB缓冲液洗脱后经末端修复、加碱基A,加测序接头,再经琼脂糖凝胶电泳回收目的片段,并进行PCR扩增,从而完成整个文库制备工作,构建好的文库用Illumina HiSeqTM 2000进行测序。
1.3 引物设计
本研究从R 基因与转录组数据库中[亚洲栽培稻Oryza sativa、短花药野生稻O.brachyantha、籼稻O.sativa indica group、粳稻O.sativa japonica group、
美国蒺藜草Cenchrus americanus、狗牙根Cynodon dactylon、甘蔗品种‘N 11Saccharum hybrid cultivar ‘N 11、
甘蔗品种‘LCP 85-384 Saccharum hybrid cultivar ‘LCP 85-384、甘蔗品种‘NCo 376 Saccharum hybrid cultivar ‘NCo376、大麦Hordeum vulgare]比对上的Unigenes中选择16个显著差异表达的Unigenes进行荧光定量分析,研究其在梢腐病菌诱导后的表达趋势。引物设计选用软件Primer 5.0,引物序列见表1。本试验内参基因25S rRNA正向引物5′-GCAGCCAAGCGTTCATAGC-3′,反向引物5′-CCTATTGGTGGGTGAACAATCC-3′[14]。
1.4 基因表达量分析
Unigene表达量的计算使用RPKM法(reads per kb per million reads),其计算公式为:RPKM=(1 000 000×C)/(N×L/1 000)。设RPKM为Unigene A的表达量,则C为比对到Unigene A的reads数,N为比对到所有Unigene的总reads数,L为Unigene A的碱基数。RPKM法能消除基因长度和测序量差异对计算基因表达的影响,计算得到的基因表达量可直接用于比较不同样品间的基因表达差异。
1.5 抗性相关基因的表达模式分析
采用qPCR分析抗病品种‘YT 94-128在梢腐病菌诱导下与抗性相关的基因表达情况。分别选取梢腐病菌诱导及清水处理后7、14 d和21 d叶片的cDNA为模板。荧光定量试剂盒选用SYBR Premix EX TaqTM(TaKaRa公司),仪器选用Applied Biosystems 7500 Fast。每个样品重复3次。采用2—△△Ct法[15]计算目的基因在不同样品中的表达量。计算公式:RQ=2—△△Ct;△△Ct=△Ct2-△Ct1;△Ct1=目的基因Ct1-内参基因Ct1;△Ct2=目的基因Ct2-内参基因Ct2;结果绘制成柱状图。其中,Ct表示扩增产物达到一定阈值时需要的循环数。
2 结果与分析
2.1 RNA 检测
对‘YT 94-128和‘GT 37接种梢腐病菌后14 d的叶片进行RNA提取。样本初始浓度都大于200 μg/μL,RNA integrity number(RIN值)大于7,总量都超过7 μg,样本无DNA、杂质污染,无降解或者轻微降解,样品质量满足建库测序要求,且总量满足2次或者2次以上建库需要。
2.2 候选抗病基因的表达情况
从‘YT 94-128和‘GT 37中的转录本中共获得174个NBS-LRR基因,其中‘YT 94-128含162个,‘GT 37含171个,两者间不同的有18个,相同的有156个,然后进一步筛选出显著差异表达的16个NBS-LRR类Unigenes(RPKM值的倍数变化>1.0,见表1)。16个Unigenes在抗病品种‘YT 94-128中均为上调表达,其中Unigene0008680接種后较之接种清水差异表达倍数最大,但表达量并不高,而Unigene0064857接种病原菌后的差异表达倍数仅为1.19,但其表达量最高。这16个Unigenes在感病品种‘GT 37接种病原菌后或上调或下调表达,Unigene0074043在接种清水情况下不表达,但在接种病原菌后却能够注释到其基因信息。代谢通路分析显示大部分Unigenes存在于植物与病原体相互作用的通路中(ko04626),还有部分Unigenes存在苯丙烷类代谢途经中(ko00940)。总体来看,NBS-LRR类基因在受到病原菌诱导后会持续上调表达,表达方式可分为两种情况:3个基因(Unigene0054622、Unigene0008546、Unigene0064857)在病原菌诱导7 d后上调表达不显著,诱导14 d后才显著上调表达;其他13个基因快速被诱导表达,即在梢腐病菌诱导后7 d显著或极显著上调表达。这表明NBS-LRR类基因积极参与甘蔗防御梢腐病菌的侵染反应,据此将其分为瞬时基础防御基因(0~7 d)和滞后特异性防御基因(14~21 d)。
2.3 候选抗病基因表达的荧光定量PCR分析
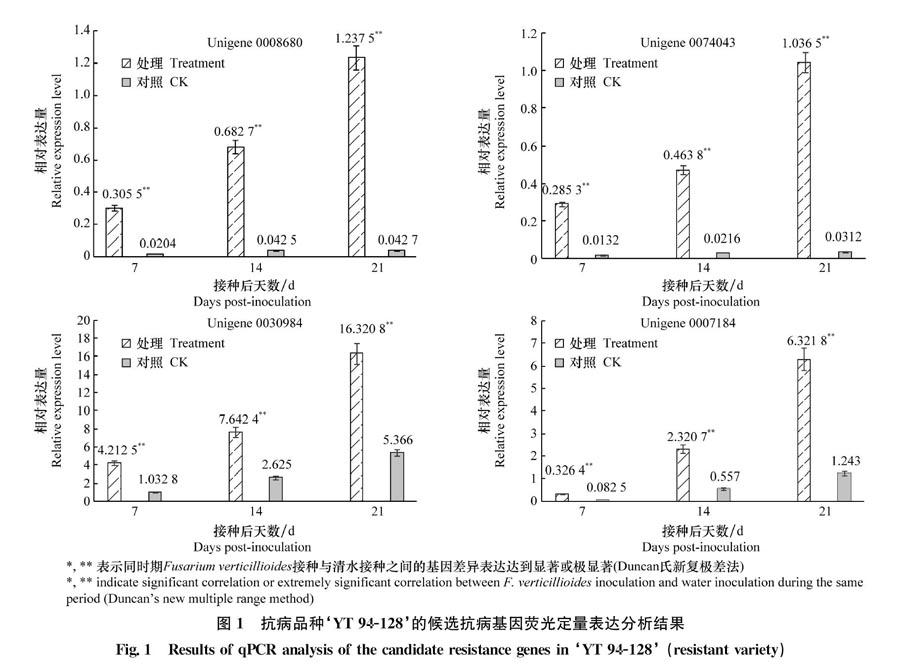
对抗病品种‘YT 94-128中主要涉及活性氧代谢、基质蛋白输入和受体再循环、腺苷酸载体以及过氧化物酶体组成部分的4个Unigenes进行荧光定量分析发现(图1),各基因在接菌处理的样品中表达量都显著或极显著高于清水处理的样品,验证了转录组测序的结果,并表现出随着病原菌侵染程度加剧,其含量逐渐积累,但表达模式具有一定差异。其中,Unigene0030984、Unigene0007184属于高或较高丰度表达基因,而Unigene0008680、Unigene0074043属于低丰度表达基因。
3 结论与讨论
利用转录组测序发掘甘蔗目标基因是一种常规方法,已有研究表明甘蔗转录组序列中存在大量未知信息的转录本[16-17]。通过抗病相关基因识别病原物入侵,从而诱导植物产生过敏反应(hypersensitive reaction, HR)或者随后引起系统抗性,是植物抗病性重要组成部分[18]。本试验基于甘蔗抗病种质资源创制需要,利用转录组测序从抗病品种‘YT 94-128和感病品种‘GT 37中获得了甘蔗响应梢腐病菌侵染的差异基因表达谱,筛选出16个NBS-LRR类抗病Unigenes,极大丰富了甘蔗抗病基因信息,也说明了不同植物NBS-LRR抗病基因的总数及其各亚家族中基因数目都各不相同[19]。
基因功能注释结果(转录组测序后的注释信息)表明这16个Unigenes含有NBS、LRR、ARC等抗病保守结构域,且Unigene0012327、Unigene0040908、Unigene0065328以及Unigene0054622与丝氨酸/苏氨酸蛋白激酶WNK1同源,Unigene0008680、Unigene0006333以及Unigene0007184与抗病蛋白(pathogenesis related, PR) RGA2同源,Unigene0014727和Unigene0039476与过敏反应诱导蛋白同源,Unigene0030984与抗病蛋白RPS2同源。这与前人获得的11条甘蔗抗黑穗病基因同源序列中的kinase-2(LLVL DDVW/D)最后一个氨基酸皆为色氨酸的结果形成验证[14],也表明梢腐病菌侵染甘蔗使其叶片发生系统性HR反应,从而引起局部细胞死亡。这部分的细胞死亡可以延缓或抑制病原菌的生长和扩散,也使得这部分细胞与周围的健康细胞相区别。来源于感染处的信号分子诱导甘蔗的其余部分产生局部获得抗性或系统获得抗性,以防止病原菌的扩散和二次侵染。可能是甘蔗抗性相关基因和梢腐病菌无毒基因识别后的信号传递激活了包括ROS的生成和各类防卫反应。虽然,这16个Unigenes均具有NBS-LRR结构特征,但尚不能根据其序列特征来作为判定甘蔗抗梢腐病性状的分子指标,只能视其与抗病基因连锁,或者为抗病基因的一部分[20]。若这些基因与甘蔗梢腐病抗性有关,则该结构域可能在甘蔗对梢腐病的抗性中参与病原识别,或与ATP(GTP)结合,提供能量,最终激活激酶或G蛋白,参与蛋白质磷酸化,放大抗病反应信号,使甘蔗对病原产生HR反应[21],这有待于进一步序列分析和功能验证。
综上所述,本文在获得差异基因表达谱的基础上,根据已知植物抗病基因保守区设计简并引物,成功验证了NBS-LRR表达规律,可为最终克隆获得甘蔗抗梢腐病基因奠定基础。
参考文献
[1] 王泽平, 陈奕, 孙海军, 等. 广西甘蔗主栽品种梢腐病田间抗性初步评价[J]. 热带作物学报, 2016, 37(5): 952-957.
[2] 兰冬雪,汤丽影,李佳,等. 禾本科植物NBS-LRR类抗病基因结构、功能和进化研究进展[J].中国农学通报,2019, 35(15):124-127.
[3] ROSSI M, ARAUJO P G, PAULET F, et al. Genomic distribution and characterization of EST-derived resistance gene analogs (RGAs) in sugarcane [J]. Molecular Genetics and Genomics, 2003, 269(3): 406-419.
[4] MCINTYRE C L, CASU R E, DRENTH J, et al. Resistance gene analogues in sugarcane and sorghum and their association with quantitative trait loci for rust resistance [J]. Genome, 2005, 48(3): 391-400.
[5] WANDERLEY-NOGUEIRA A C, SOARES-CAVALCANTI N M, MORAIS D A L, et al. Abundance and diversity of resistance genes in the sugarcane transcriptome revealed by in silico analysis [J]. Genetics and Molecular Research, 2007, 6(4): 866-889.
[6] 阙友雄, 许莉萍, 张木清, 等.甘蔗中一个NBS-LRR类基因的全长克隆与表达分析[J]. 作物学报, 2009, 35(6): 1161-1166.
[7] 贺尔奇, 李向勇, 彭仕荣, 等. 果蔗NBS类抗病基因同源序列的克隆与分析[J]. 分子植物育种, 2016, 14(2): 352-358.
[8] KRASILEVA K V, DAHLBECK D, STASKAWICZ B. Activation of an Arabidopsis resistance protein is specified by the in planta association of its leucine-rich repeat domain with the cognate oomycete effector [J]. The Plant Cell, 2010, 22(7): 2444-2458.
[9] 王泽平, 段维兴, 李毅杰, 等. 甘蔗梢腐病田间抗性评价体系的建立[J]. 华南农业大学学报, 2016, 37(3): 67-72.
[10]王泽平, 林善海, 梁强, 等. 甘蔗叶冠形态与抗梢腐病相关性探讨[J]. 中国农业大学学报, 2017, 22(7): 40-46.
[11]WANG Zeping, SUN Haijun, GUO Qiang, et al. Artificial inoculation method of pokkah boeng disease of sugarcane and screening of resistant germplasm resources in subtropical China [J]. Sugar Tech, 2017, 19(3): 283-292.
[12]凌秋平,吳嘉云,杨湛端,等.甘蔗SsCBL4基因的克隆及表达特性分析[J].农业生物技术学报, 2019,27(8):1351-1359.
[13]郑清雷,余陈静,姚坤存,等. 甘蔗Rieske Fe/S蛋白前体基因ScPetC的克隆及表达分析[J].作物学报,2020,46(6):844-857.
[14]阙友雄, 许莉萍, 林剑伟, 等.甘蔗NBS-LRR类抗病基因同源序列的分离与鉴定[J].作物学报, 2009, 35(4): 631-639.
[15]邵冰欣,王红梅,赵云雷,等.陆地棉耐盐性状与SSR分子标记的关联分析[J].棉花学报,2015,27(2):118-125.
[16]丘立杭, 罗含敏, 陈荣发, 等.基于RNA-Seq的甘蔗主茎和分蘖茎转录组建立及初步分析[J].基因组学与应用生物学, 2018, 37(3): 1271-1279.
[17]徐慧敏. 甘蔗现代栽培杂种及其两个祖先种全长转录组比较研究和菠萝基因组数据库[D]. 福州: 福建农林大学,2019.
[18]刘云飞, 万红建, 李志邈, 等. 植物 NBS-LRR 抗病基因的结构、功能、进化起源及其应用[J].分子植物育种, 2014, 12(2): 377-389.
[19]金玲, 金殿川, 王莉, 等. 禾本科植物 NBS-LRR 型抗病基因的进化分析[J]. 分子植物育种, 2015, 13(11): 2578-2583.
[20]房卫平, 谢德意, 李志芳, 等. NBS-LRR 类抗病蛋白介导的植物抗病应答分子机制[J].分子植物育种, 2015, 13(2): 469-474.
[21]阙友雄, 许莉萍, 林剑伟, 等. 斑茅NBS-LRR类抗病基因同源序列的克隆与分析[J].热带作物学报, 2009, 30(2): 192-197.
(责任编辑:田 喆)
