miR1320表达水平与水稻白叶枯病抗性的关联性分析
2021-10-12胡积祥朱秀梅余超杨凤环王继春张立新陈华民
胡积祥 朱秀梅 余超 杨凤环 王继春 张立新 陈华民


摘要 水稻白叶枯病是由稻黄单胞菌水稻致病变种Xanthomonas oryzae pv. oryzae(Xoo)引起的一种细菌性病害,严重影响水稻的产量和品质。miR1320是水稻与Xoo互作中重要的调控因子。本研究在接种Xoo后的0、12、24 h分别检测了10个粳稻和8个籼稻品种中miR1320的积累和4个防卫基因的转录水平,测量了各品种叶片上的病斑长度,分析了miR1320的积累和防卫基因的表达与水稻白叶枯病抗性之间的相关性。结果表明:接种Xoo后,miR1320的表达模式在不同品种中有所不同;籼稻和粳稻对白叶枯病的抗性分别与接种后24 h和12 h時miR1320的表达量呈紧密负相关;且相对于防卫基因,miR1320更能反映品种间的抗病性。因此,miR1320可应用于评估水稻品种对白叶枯病的抗性,辅助水稻抗病种质的鉴定。
关键词 miR1320; 水稻; 白叶枯病; 抗性; 表达
中图分类号: S 435.11
文献标识码: A
DOI: 10.16688/j.zwbh.2020354
Analysis of the correlation between the expression level of miR1320 and resistance to bacterial blight in rice
HU Jixiang1, ZHU Xiumei1, YU Chao1, YANG Fenghuan1,
WANG Jichun2, ZHANG Lixin3, CHEN Huamin1*
(1. State Key Laboratory for Biology of Plant Disease and Insect Pests, Institute of Plant Protection, Chinese
Academy of Agricultural Sciences, Beijing 100193, China; 2. Institute of Plant Protection, Jilin Academy
of Agricultural Sciences, Gongzhuling 136100, China; 3.College of Plant Protection,
Anhui Agricultural University, Hefei 230036, China)
Abstract
Rice bacterial blight (BB), caused by Xanthomonas oryzae pv. oryzae (Xoo), is a serious bacterial disease and significantly reduces the rice yield and quality in the field. miR1320 is an important regulatory factor in the interaction between rice (Oryzae sativa) and Xoo. In this study, the expression levels of miR1320 and four defense genes were detected in 10 japonica rice (Oryzae sativa subsp. geng) and eight indica rice (Oryzae sativa subsp. xian) varieties at 0、12、24 h time points after inoculation with Xoo. Then the leaf lesion length was measured on the 14th day after inoculation with Xoo. Finally, the correlations between lesion length and either miR1320 or defense genes were analyzed. The results suggested that the different rice varieties displayed different patterns in response to Xoo infection, and the resistance to BB in japonica rice and indica rice was closely and negatively correlated with the expression levels of miR1320 at 24 hpi (hours post inoculation) and 12 hpi, respectively. Moreover, compared with defense genes, miR1320 was a better indicator of the resistance to BB in different rice varieties. In conclusion, miR1320 can be applied to assess the resistance of rice varieties to BB and assist the identification of rice resistant germplasms.
Key words
miR1320; rice; bacterial blight; resistance; expression
水稻白叶枯病是由稻黄单胞菌水稻致病变种Xanthomonas oryzae pv. oryzae(Xoo)侵染引起的一种细菌病害,对水稻产量影响轻的减产20%~30%,重的可达50%~60%,甚至颗粒无收。病株的稻谷加工后碎米多,严重降低稻米的品质[1-2]。在生产上,尽管喷施杀菌剂能在一定程度上控制病害的发生,但杀菌剂的使用严重污染了当地的环境,大大增加了水稻的生产成本。因此,种植抗病品种是防治水稻白叶枯病最经济有效且绿色环保的策略[3],而作物抗病性鉴定是作物抗病育种的重要基础性环节,快速的鉴定手段可以提高育种效率、加快育种进度。
miRNA是生物体内源性存在的、长度为21~24个核苷酸的单链RNA小分子[4],广泛存在于动物、植物和病毒中,其5′端被磷酸化,3′端带有羟基,本身不能编码氨基酸,但可与Argonaute (AGO)蛋白一起形成RNA诱导沉默复合体(RNA-induced silencing complex, RISC),抑制靶基因mRNA的转录或翻译,从而实现对靶基因的调控[5]。
随着对miRNA的深入研究,人们发现植物miRNA在抗病方面起着重要的调控作用。植物一旦感知病原物的入侵,就会迅速改变miRNA的表达水平来启动某些抗病信号和途径,增强自身的抵抗力[6-7]。其中,一些miRNAs的变化具有明显的病原特异性。甜橙miR399和miR159在感染黄龙病10周后的各品种中表达量至少增加3倍,而在感染顽固病(病原为柑橘螺原体Spiroplasma citri)的植株中却几乎没有变化。因此利用miR399和miR159在表达上的变化特征可以区分甜橙中黄龙病和顽固病这两种症状易混淆的病害[8]。而另一些植物miRNAs表达水平的变化具有品种特异性,且在抗病品种中的差异表达更明显,暗示它们与品种抗病属性存在紧密关联。目前,这类miRNA在水稻[9]、玉米[10]和小麦[11]等多种作物中已有报道,但它们与品种抗病性之间的关系尚未深入研究。
miR1320是水稻特有的miRNAs之一[12]。在接种稻瘟病菌后,水稻中的miR1320持续上调表达,24 h后增幅达3倍以上[9,13],且在抗病品种‘C101LAC中的表达量是感病品种‘CO39中的2倍以上[9]。通过高通量测序和荧光定量PCR技术人们发现水稻被Xoo侵染后miR1320的表达量也至少上调2倍[14-15]。但这些都是基于1~2个水稻品种上的研究结果,而在品种群体水平上研究miR1320的表达模式将有助于全面认识其与品种抗病性之间的联系。为此,本研究测定了10个粳稻和8个籼稻品种在接种Xoo后的病斑长度和miR1320的积累以及4个防卫基因的表达水平,并分析了miR1320和4个防卫基因在Xoo胁迫条件下的表達特征与品种抗病性之间的相关性。
1 材料与方法
1.1 植物材料和菌株
供试水稻材料包括10个粳稻品种和8个籼稻品种。粳稻品种为‘日本晴和9个东北三省的粳型生产品种‘吉粳816‘吉粳88‘东稻9‘九稻60‘稻花香2号‘吉农大735‘通禾899‘辽粳5号和‘盐丰47,其中‘稻花香2号由东北农业大学张忠臣博士提供;籼稻品种为‘IR24及国际水稻研究所以‘IR24为遗传背景育成的分别含有水稻白叶枯病抗性基因Xa2、Xa3、Xa4、xa5、xa13、Xa14和Xa21的7个近等基因系‘IRBB2‘IRBB3‘IRBB4‘IRBB5‘IRBB13‘IRBB14和‘IRBB21。试验菌株为Xoo菌株PXO99A。
1.2 试剂和仪器
Invitrogen公司的TRIzol试剂(15596026);Promega公司的去基因组DNA试剂盒(M6101);北京全式金生物技术有限公司的miRNA cDNA合成试剂盒(AT351-01);康润生物公司的StarScript II cDNA第一链合成预混试剂(A224-02)和实时荧光定量PCR试剂盒(A314-05)。
试验中所用引物均委托北京六合华大基因科技有限公司合成,引物序列见表1。试验仪器包括实时定量PCR仪ABI 7500和超微量分光光度计Thermo Nanodrop 2000。
1.3 试验方法
1.3.1 水稻种植
水稻种子在37℃培养箱中浸种催芽,幼芽长至1 cm时移至育苗蛭石中生长;待其5 cm高时再移植于4.8 L圆形塑料桶中(5株/桶),置温室生长2个月(包括发芽天数),供试。
1.3.2 抗病性鉴定
利用剪叶接种法测定水稻抗病性:将保存于-80℃的Xoo菌株PXO99A在PSA(蔗糖10 g/L,蛋白胨10 g/L,谷氨酸1 g/L,琼脂粉15 g/L pH 7.0)平板上活化;挑取单菌落到液体M210(蔗糖5 g/L,酶水解干酪素8 g/L,MgSO4·7H2O 0.3 g/L,酵母粉4 g/L,K2HPO4·3H2O 3 g/L,pH 7.0)中,200 r/min振荡培养;24 h后按1∶100比例转接1次;待菌液OD600为0.8左右时,5 000 r/min 离心5 min收集菌体;用灭菌ddH2O洗涤1次并重悬菌液至OD600为0.8;灭菌剪刀浸沾菌液后,在离叶尖1~2 cm处剪叶;14 d后测量叶片病斑长度。
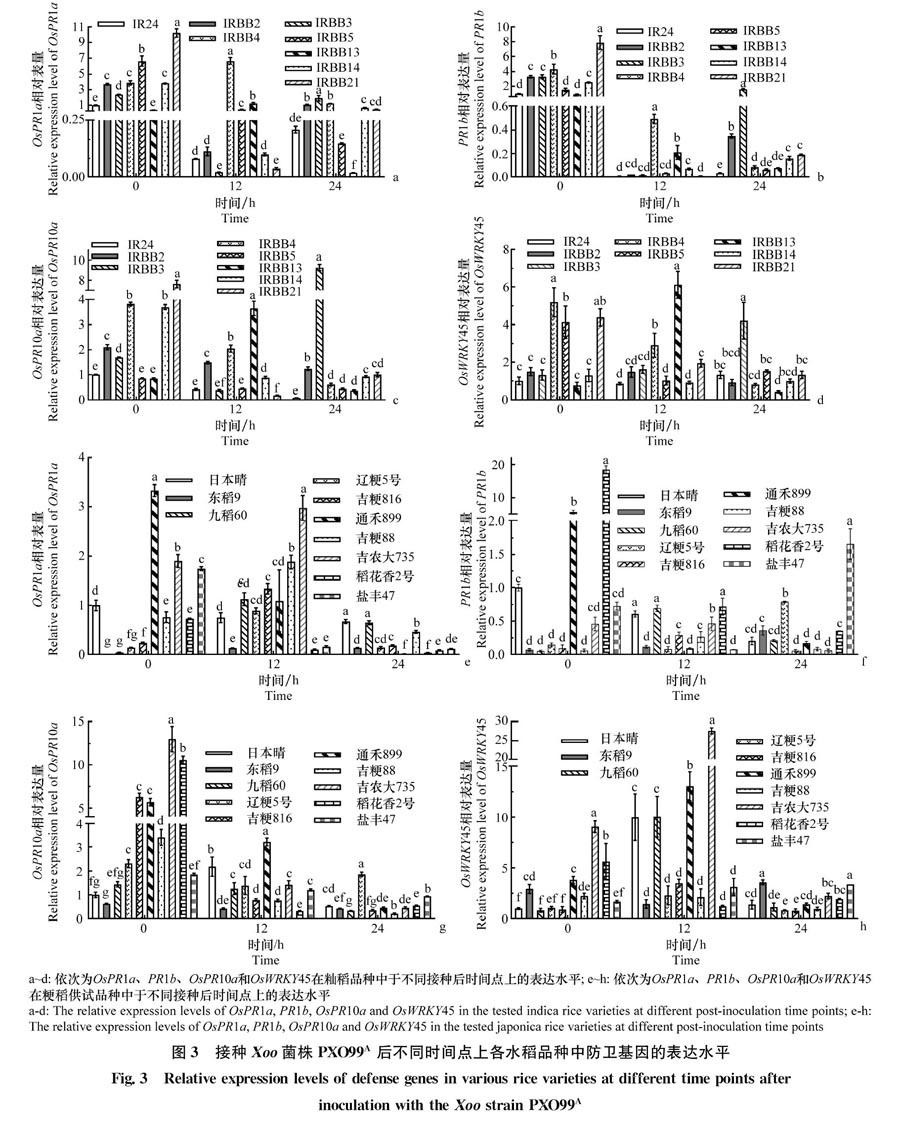
1.3.3 miR1320和防卫基因OsPR1a、PR1b、OsPR10a和OsWRKY45表达量测定
水稻总RNA提取:每个品种分别在接种Xoo后0、12 h和24 h时剪取至少3片不同植株上的接种叶尖,立即放入液氮中,然后在研磨仪上1 500 r/min到800 r/min降速剧烈振荡1 min,将叶片研磨成粉末;加入1 mL TRIzol,参照说明书提取叶片总RNA。
总RNA中残存基因组DNA的去除:反应体系为100 μL,其中RNA为10 μg,DNaseⅠ(1 U/μL) 10 μL, 于37℃孵育45 min;加入20 μL氯仿后用乙醇沉淀法纯化RNA。
cDNA制备和荧光定量PCR:参照说明书进行。在10 μL体系中,将1 μg总RNA反转录为cDNA,10倍稀释后取5 μL作为PCR的模板。PCR采用20 μL体系,反应程序均设为95℃ 10 min;95℃ 15 s,60℃ 35 s,40个循环。
1.4 数据分析
防卫基因和miR1320的表达量按照2-ΔΔCt法计算,它们的内参基因分别为Actin1和OsU6。
ΔCt=目的基因的Ct-内参基因的Ct;
ΔΔCt=接种后x h测得的ΔCt-接种后0 h测得的ΔCt 。
采用Excel 2016和SPSS 20软件对测得的病斑长度和荧光定量数据进行整理和统计分析,用Waller-Duncan (k比率t测验)法比较差异显著性(P<0.05)。最后,利用GraphPadPrism 7软件绘图。
2 结果与分析
2.1 水稻白叶枯病抗性的测定
水稻白叶枯病抗性的测定结果表明,供试水稻品种对Xoo的抗性存在显著差异。在籼稻中,IRBB系列叶片上的病斑长度均显著短于对照品种‘IR24,其中‘IRBB21叶片上的病斑长度最短(图1a和1c);而在粳稻中,9个东北地区生产品种叶片上的病斑长度均长于‘日本晴,其中病斑最长的品种为‘盐丰47,其次为‘东稻9和‘稻花香2号(图1b和1d)。
2.2 miR1320表达量的测定
接种Xoo后水稻中miR1320的表达量随接种时间的动态变化因品种而异,在‘IRBB13‘日本晴‘九稻60‘吉粳816‘通禾889和‘吉粳88中先升后降,在‘IR24‘IRBB4和‘吉农大735中逐渐降低,在‘IRBB2‘IRBB5‘IRBB14‘IRBB21和‘稻花香2号中先降后平稳,在‘盐丰47中先降后升,而在‘东稻9和‘辽粳5号中基本不变。
品种间miR1320的表达水平有显著差异。籼稻在接种Xoo后,miR1320整体上下调表达,在‘IR24中的接种后0、12、24 h均较低表达,尤其是在接种后24 h时表达水平最低,显著低于其他IRBB系列水稻(图2a)。而粳稻在接种Xoo后,miR1320在一些品种中略呈上调表达,而在另一些品种中呈下调表达趋势;在接种后12 h,miR1320的表达水平在‘日本晴中最高,在‘盐丰47中最低。
2.3 防卫基因OsPR1a、PR1b、OsPR10a和OsWRKY45轉录水平的测定
各水稻品种中的4个防卫基因在接种后0、12、24 h的表达水平如图3所示。在籼稻中,接种后0 h时4个防卫基因在多数IRBB系列品种中的表达水平显著高于对照品种‘IR24,只在个别品种中存在
例外;接种后12 h时PR1b的表达水平在‘IR24中最低;接种后24 h时4个防卫基因的表达水平均在‘IRBB3中最高,且PR1b和OsPR10a的表达水平在‘IR24中最低。在粳稻中,接种后12 h时,OsPR10a的表达水平在‘通禾889中最高,其次是‘日本晴,而在‘稻花香2号中表达量最低;接种后24 h时,OsPR1a在‘日本晴中的表达量最高,而在‘通禾889中最低。
2.4 miR1320和4个防卫基因的表达量与抗病性之间的相关性分析
作散点图分析防卫基因表达量(x)与叶片病斑长度(y)之间的关系,结果表明,4个防卫基因中仅OsPR1a、PR1b和OsPR10a的表达量在特定条件下与叶片病斑长度存在较好的负相关性。在籼稻中,接种后12 h时PR1b的表达量和叶片病斑长度呈一定程度的负相关(图4d),皮尔森相关系数r为-043;接种后24 h时,除‘IRBB3外,各品种中PR1b和OsPR10a对应的散点紧密地聚集在各自拟合直线附近(图4a)且r分别为-0.446和-0.683。而在粳稻(图4b)中,接种后24 h时仅OsPR1a对应的散点有类似的情形,r为-0.498。
同样的方法分析miR1320的表达量与叶片病斑长度之间的关系,结果表明,在特定条件下无论是在除‘IRBB3外的籼稻(图4c)还是粳稻(图4d)中,它们构成的散点均紧密地聚集在拟合直线附近,且它们具有较好的负相关性。粳稻接种后12 h时,miR1320的表达量与叶片病斑长度之间存在显著负相关性,其中r为-0.728,P值为0.017;8个品种(‘日本晴‘东稻9‘九稻60‘吉粳816‘吉粳88‘稻花香2号‘辽粳5号和‘盐丰47)的线性公式为y=-0.107 4x+2.761 4,其中R2=0.875 9。而籼稻(不含‘IRRB3)接种后24 h时,它们也具有良好的负相关性,r为-0.512。
3 讨论
植物一旦感知病原菌的入侵,就会迅速改变一些miRNAs的表达来启动某些抗病信号和途径,增强自身的抵抗力。有学者以1~2个水稻品种为研究对象,接种稻瘟菌[9,13]或Xoo[14-15],发现miR1320持续上调表达;而本研究分析了10个粳稻品种和8个籼稻品种中的miR1320在接种Xoo后的表达水平,结果表明miR1320的表达模式因品种而异,即在品种群体水平上具有多样性,如在‘IRBB13‘日本晴和‘九稻60中miR1320的表达水平先升后降,而在‘盐丰47中先降后升。因此,本研究在接种Xoo后对多品种中miR1320的表达模式进行了分析,深化和丰富了对miR1320响应病菌侵染的认识,有助于揭示miR1320的抗病机制。
研究表明,在病菌胁迫下,包括miR1320在内的许多miRNAs在抗病品种中的表达变化比感病品种中的更明显[9]。本研究的结果则进一步表明,粳稻对白叶枯病的抗性与其接种后12 h时miR1320的积累显著正相关;而籼稻(不包括IRRB3)对白叶枯病的抗性与其接种后24 h时miR1320的积累之间也有良好的相关性,皮尔逊相关系数r为0.512。尽管籼稻IRBB系列品种分别携带不同的白叶枯病抗性基因,而这些抗性基因又来自不同的遗传背景(如Xa21源自西非长药野生稻),但在接种Xoo后24 h时所有供试的IRBB系列品种中的miR1320的表达水平均比背景品种‘IR24中的高,这与它们的抗病性一致。因此,miR1320可辅助水稻对白叶枯病抗性的评价。
植物防卫基因一旦感知病原菌浸染就会立即启动表达以阻止病菌的进一步侵害,相比感病品种,其在抗病品种中的表达速度更快和强度更高[21]。因此,防卫基因在时空上的表达特征一定程度上反映了植物抗病性的强弱。Vergne等分析了23个水稻品种中21个防卫基因的表达模式,结果表明在稻瘟病菌侵染前的防卫基因的表达水平与水稻中的“部分抗病性(partial resistance)”极度相关[22];而Liu等进一步指出在特定的环境背景下一些特定的防卫基因可以预测品种的抗病性[23]。在本试验中,4个防卫基因的表达水平与各籼稻品种中的抗病性也存在一定的相关性;但这种相关性比品种抗病性和miR1320之间的相关性弱,尤其是在粳稻中。因此,相对于防卫基因而言,miR1320可能更适合辅助评估水稻品种的抗病性。
抗性鉴定在抗病育种中是一项基础性工作,鉴定结果易受环境等因素的影响,鉴定过程费时费力[24]。挖掘和利用更多类似于miR1320的miRNAs来辅助比较育种材料的抗病性可在一定程度上克服以上局限性。
參考文献
[1] 张爱芳, 王春林, 陈雨, 等. 安徽省水稻品种对水稻白叶枯病的抗性及白叶枯病小种鉴定[J]. 植物保护, 2012, 38(3): 139-142.
[2] 袁筱萍, 魏兴华, 徐群, 等. 中国主栽品种对7个白叶枯病菌菌株的抗性分析[J]. 植物保护, 2016, 42(4): 169-173.
[3] 张佳环, 马周杰, 刘巍, 等. 东北水稻白叶枯病菌生理小种及水稻品种对9号小种的抗性[J]. 植物保护, 2016, 42(3): 204-207.
[4] AMBROS V. The functions of animal microRNAs [J]. Nature, 2004, 431(7006): 350-355.
[5] BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function [J]. Cell, 2004, 116(2): 281-297.
[6] LI Feng, PIGNATTA D, BENDIX C, et al. MicroRNA regulation of plant innate immune receptors [J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(5): 1790-1795.
[7] REINHART B J, WEINSTEIN E G, RHOADES M W, et al. MicroRNAs in plants [J]. Genes Development, 2002, 16(13): 1616-1626.
[8] ZHAO Hongwei, SUN Ruobai, ALBRECHT U, et al. Small RNA profiling reveals phosphorus deficiency as a contributing factor in symptom expression for citrus huanglongbing disease [J]. Molecular Plant, 2013, 6(2): 301-310.
[9] LI Zeyuan, XIA Jing, CHEN Zheng, et al. Large-scale rewiring of innate immunity circuitry and microRNA regulation during initial rice blast infection[J/OL]. Scientific Reports, 2016, 6: 25493. DOI: 10.1038/srep25493.
[10]罗茂, 彭华, 宋锐, 等. 玉米纹枯病胁迫相关miRNA功能研究[J]. 作物学报, 2013, 39(5): 837-844.
[11]KUMAR D, DUTTA S, SINGH D, et al. Uncovering leaf rust responsive miRNAs in wheat (Triticum aestivum L.) using high-throughput sequencing and prediction of their targets through degradome analysis [J]. Planta, 2017, 245(1): 161-182.
[12]MORIN R D, AKSAY G, DOLGOSHEINA E, et al. Comparative analysis of the small RNA transcriptomes of Pinus contorta and Oryza sativa [J]. Genome Research, 2008, 18(4): 571-584.
[13]WANG Zhaoyun, XIA Yeqiang, LIN Siyuan, et al. Osa-miR164a targets OsNAC60 and negatively regulates rice immunity against the blast fungus Magnaporthe oryzae [J]. Plant Journal, 2018, 95(4): 584-597.
[14]YU Chao, CHEN Yutong, CAO Yaqian, et al. Overexpression of miR169o, an overlapping MicroRNA in response to both nitrogen limitation and bacterial infection, promotes nitrogen use efficiency and susceptibility to bacterial blight in rice [J]. Plant and Cell Physiology, 2018, 59(6): 1234-1247.
[15]JIA Yanfeng, LI Chunrong, LI Quanlin, et al. Characteristic dissection of Xanthomonas oryzae pv. oryzae responsive MicroRNAs in rice[J/OL]. International Journal of Molecular Sciences, 2020, 21(3): 785. DOI: 10.3390/ijms21030785.
[16]ZHANG Hui, ZHANG Jinshan, YAN Jun, et al. Short tandem target mimic rice lines uncover functions of miRNAs in regulating important agronomic traits [J]. Proceedings of the National Academy of Sciences, 2017, 114(20): 5277-5282.
[17]KE Yinggen, LIU Hongbo, LI Xianghua, et al. Rice OsPAD4 functions differently from Arabidopsis AtPAD4 in host-pathogen interactions [J]. The Plant Journal, 2014, 78(4): 619-631.
[18]DE VLEESSCHAUWER D, DJAVAHERI M, BAKKER P A, et al. Pseudomonas fluorescens WCS374r-induced systemic resistance in rice against Magnaporthe oryzae is based on pseudobactin-mediated priming for a salicylic acid-repressible multifaceted defense response [J]. Plant Physiology, 2008, 148(4): 1996-2012.
[19]DE VLEESSCHAUWER D, VAN BUYTEN E, SATOH K, et al. Brassinosteroids antagonize gibberellin- and salicylate-mediated root immunity in rice [J]. Plant Physiology, 2012, 158(4): 1833-1846.
[20]KARAN R, SINGLA-PAREEK S L, PAREEK A. Histidine kinase and response regulator genes as they relate to salinity tolerance in rice [J]. Functional & Integrative Genomics, 2009, 9(3): 411-417.
[21]吳中伟, 朱友林, 尚俊军, 等. 植物防卫基因研究进展[J]. 江西植保, 2001(1): 30-33.
[22]VERGNE E, GRAND X, BALLINI E, et al. Preformed expression of defense is a hallmark of partial resistance to rice blast fungal pathogen Magnaporthe oryzae[J/OL]. BMC Plant Biology, 2010, 10(1): 206. DOI: 10.1186/1471-2229-10-206.
[23]LIU Bin, ZHANG Shaohong, ZHU Xiaoyuan, et al. Candidate defense genes as predictors of quantitative blast resistance in rice [J]. Molecular Plant-Microbe Interactions, 2004, 17(10): 1146-1152.
[24]杜新法, 陶荣祥, 孙漱沅. 品种抗病性鉴定和评价方法探讨[J]. 中国稻米, 1995(3): 31-33.
(责任编辑:杨明丽)
