葡萄霜霉病菌遗传多样性和致病力分化研究
2021-10-12于舒怡刘长远赵奎华
贾 姝,于舒怡,刘长远,赵奎华,王 平,赵 达
(1.辽宁省蚕业科学研究所,辽宁凤城 118100;2.辽宁省农业科学院a.植物保护研究所,b.高粱研究所,沈阳110161;3.沈阳大学,沈阳 110044)
葡萄霜霉病是由单轴霉属葡萄生单轴霉[Plasmopara viticola(Berk et Curtis)Bert.et Toni]引起的一种世界性病害,我国各葡萄产区均有分布,该病是葡萄生产中的第一大病害[1]。经研究发现,同一葡萄品种在不同地区发病程度有明显差异,同一地区不同葡萄品种的发病程度也明显不同。ROUXEL等[2]认为葡萄霜霉病菌存在明显致病性分化现象,我国学者也对葡萄霜霉病菌致病力分化开展了一系列研究,先后报道了广西、河北、新疆、吉林、湖南、宁夏等地的葡萄霜霉病菌存在致病力分化现象[3-7]。我国葡萄种植地理分布广泛,各主要葡萄产地均有不同程度霜霉病发生,病原菌致病性可能存在较明显分化,因此明确全国葡萄霜霉病菌致病性的分化可为合理高效防治葡萄霜霉病提供理论依据。
随着分子生物学的发展与研究技术的不断完善提高,一系列分子标记技术被广泛应用于病原菌群体遗传多样性研究中,但每项技术的可靠性、特异性、多态性都有所不同。目前用于病原菌多态性分析的技术主要包括RAPD、RFLP、ISSR、SSR和SRAP(Sequence-Related Arnplified Polymorphism,相关序列扩增多态性)等,RAPD[8]和SSR[3,9-13]分子标记技术已经应用于葡萄霜霉病菌的遗传差异研究。SRAP技术是2001年由LI等[14]在芸苔属植物上开发出的新型分子标记技术,与其他分子标记技术相比,SRAP的优点在于方便快捷,需要样品量极少且不需要预先知道DNA序列便可快速获得大量信息,最重要的是重复性与多态性好,因此非常适合于指纹图谱的绘制、遗传连锁图谱的构建及遗传多样性方面的研究。目前,SRAP标记已经广泛用于植物病原菌的遗传多样性和亲缘关系分析[16-20]。
本研究采用叶盘接种法和SRAP标记技术对全国19个省(市)的葡萄霜霉病病原菌的致病力分化和遗传多样性进行分析,通过比较各地区葡萄霜霉病菌的遗传多样性,明确该病菌的遗传特征,有利于理解病害的发生、流行和预测,为综合防治葡萄霜霉病提供理论依据。
1 材料与方法
1.1 材料
供试葡萄(Vitis viniferaL.)品种为无核白鸡心、巨峰和香悦,其中香悦为抗病(R)品种,巨峰为感病(S)品种,无核白鸡心为高感(HS)品种。
供试菌株为采自19个省(市)的葡萄霜霉病菌69株,其中辽宁共取样21株,其中沈阳(SY-1~6)和朝阳(CY-1~6)各6株,辽阳(LY-1,2)、大连(DL-1,2)、葫芦岛(HLD-1,2)和阜新(FX-1,2)各2株,锦州(JZ-1)1株,云南(YN-1~5)、山东(SD-1~5)和福建(FJ-1~5)各5株,陕西(SX-1~4)、甘肃(GS-1~4)、新疆(XJ-1~4)和河北(HB-1~4)各4株,黑龙江(HLJ-1~3)3株,宁夏(NX-1,2)、四川(SC-1,2)、山西(SXX-1,2)、湖南(HN-1,2)各2株,河南(HN-1)、江苏(JS-1)、安徽(AH-1)、江西(JX-1)、浙江(ZJ-1)和北京(BJ-1)各1株。
供试10条正向引物及10条反向引物(表1)均由上海生工生物工程技术服务有限公司合成。
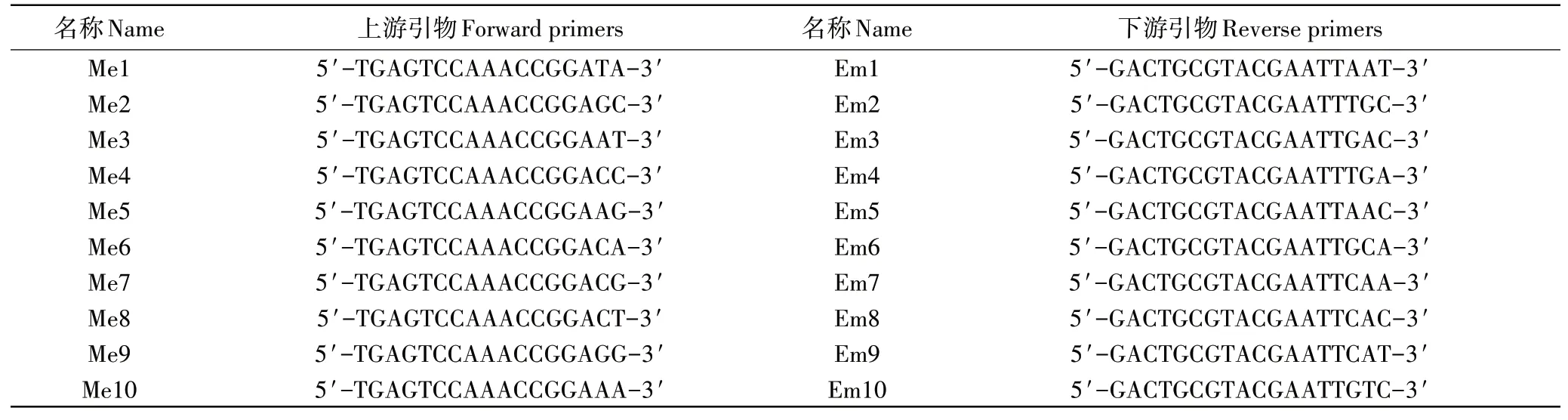
表1 供试SRAP引物Table 1 SRAP primers used in this study
1.2 方法
1.2.1 葡萄霜霉病菌致病力分化测定孢子囊悬浮液配制:使用无菌毛刷蘸取无菌水刷去病叶背面的杂物和病菌,22℃保湿培养24h。待叶片长出大量新鲜菌体后,将孢子囊刷至无菌水中,配成每毫升含有1×105个孢子囊的孢子囊悬液备用。
接种方法和分级标准:叶盘喷雾法接种[22-23]。采集无核白鸡心、巨峰和香悦3个不同抗性水平葡萄品种枝条顶端倒数第2~4叶位置的健康叶片,用无菌水冲洗净表面的灰尘,晾干备用,用打孔器制备直径2cm的叶盘,叶背朝上置于底部垫有润湿滤纸的直径9cm塑料培养皿中,将配制好的孢子囊悬液均匀地喷施到叶盘上,封口后置于22℃的恒温室中保湿培养。10d后调查发病情况。每10个叶盘为1个处理组,3次重复,无菌水对照。分级标准:0级,无病斑;1级,病斑面积占叶盘面积的5%以下;3级,病斑面积占叶盘面积的6%~25%;5级,病斑面积占叶盘面积的26%~50%;7级,病斑面积占叶盘面积的51%~75%;9级,病斑面积占叶盘面积的76%以上。
病情指数=[∑(各级叶盘数×各级代表值)/(调查总叶盘数×最高一级代表值)]×100。使用SPSS 19.0对病情指数进行组间联接法聚类分析。
1.2.2 葡萄霜霉病菌SRAP标记分析供试菌株的收集:将配制的孢子囊悬浮液接种到健康葡萄叶片上,置于22℃全光照培养箱中培养9d。待叶片发病后,用无菌镊子夹取菌体于1.5mL离心管中,-40℃保存备用。
菌株DNA提取:采用CTAB法[24],向离心管中加入少量液氮,用无菌塑料锄将菌体研磨至粉末状,加入700 μLCTAB提取液(含2%巯基乙醇),65℃水浴裂解2h。取出冷却至室温后,加入700μL氯仿/异戊醇(24∶1),混匀,4℃12000r·min-1离心10min。取上清液450~500μL,加入2倍体积预冷的无水乙醇,轻轻上下颠倒混匀,-40℃静置15min。4℃12000r·min-1离心10min,弃上清液。加入1mL预冷的75%乙醇,吹洗2次,风干,加入20μL ddH2O,待DNA充分溶解后,-20℃保存备用。
引物筛选:引物Me1~10分别与Em1~10进行组合,最终得到100对引物。使用地理区域差异较大的SY-4、HB-3、XJ-4、YN-4、FJ-4等5株霜霉病菌对引物进行筛选,确定条带清晰、特异性丰富、稳定性好的引物组合后,对所有供试菌株进行PCR扩增。PCR扩增步骤:2×Taq PCR Green Mix 5μL,正、反向引物各0.5μL,模板DNA0.5μL,用ddH2O定容至10μL。反应程序:95℃预变性5min,95℃变性1min,37℃复性45s,72℃延伸1min,5个循环;95℃变性1min,57℃复性1min,72℃延伸1min,30个循环;最后72℃延伸15min,4℃保存。PCR产物置于-20℃保存备用。
电泳分析检测:将扩增产物进行6%非变性聚丙烯酰胺凝胶电泳、染色、洗板。然后进行显色、拍照,统计条带。
1.2.3 葡萄霜霉病菌遗传结构分析每个样品电泳条带出现DNA扩增带的位置有带记为“1”(强带和可分辨率、稳定性、重复性好的弱带均赋值为1),无带记为“0”,收集所有样品PCR结果,统计数据建立二元数据矩阵,利用NTSYS-2.1计算材料间遗传相似性系数,使用UPGMA(Unweighted pair group method arithmetic averages)法聚类分析。
2 结果与分析
2.1 不同地区葡萄霜霉病菌致病力的分化
以69株病原菌对无核白鸡心、巨峰、香悦的病情指数为3组数据用SPSS进行聚类分析,结果表明,以相似性测度5.0为界限,供试菌株致病力可分为4类群(图1):Ⅰ类群(弱致病力)是以SY-5(接种后无核白鸡心的病情指数为17.78,接种后巨峰的病情指数为9.44,接种后香悦的病情指数为0.56)为代表的38份弱致病力菌株;Ⅱ类群(中等致病力)是以HLJ-3(接种后无核白鸡心的病情指数为43.33,接种后巨峰的病情指数为26.67,接种后香悦的病情指数为7.78)为代表的25份中等致病力菌株;Ⅲ类群(强致病力)是以GS-1(接种后无核白鸡心的病情指数为74.72,接种后巨峰的病情指数为41.11,接种后香悦的病情指数为26.89)为代表的5株强致病力菌株;Ⅳ类群(最强致病力)是DL-1(接种后白鸡心的病情指数为88.89,接种后巨峰的病情指数为63.89,接种后香悦的病情指数为34.44)菌株。

图1 不同地区葡萄霜霉病菌致病力的聚类分析Figure 1 Cluster analysis of pathogenicity of Plasmopara Viticola in different regions
将69株霜霉病菌按照地理区域进行致病力类群分布可知(图2),6个区域的病原菌群体均存在一定程度的致病力分化,东北地区的病原菌群体致病力可划分为4个类群,分化程度高;而华北、华中和西南地区致病力分化程度相对较低;东北、西南和西北地区的弱致病力菌株占优势,占比在58%以上,而华北、华东和华中地区中等致病力菌株占优势,华北和华中地区未发现强致病力菌株。
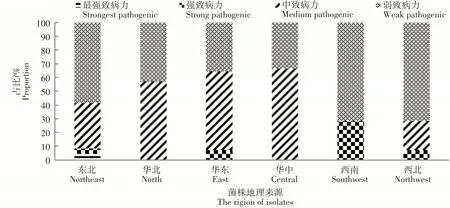
图2 葡萄主要产区霜霉病菌致病力差异Figure 2 Difference in pathogenicity of Plasmopara Viticola in main grape producing areas
2.2 不同地区葡萄霜霉病菌的遗传多样性
2.2.1 不同引物对霜霉病菌SRAP的扩增结果从100对SRAP引物中筛选出条带清晰、多样性丰富的10对引物(Me3/Em6、Me6/Em2、Me6/Em3、Me6/Em4、Me6/Em9、Me7/Em7、Me7/Em10、Me8/Em2、Me8/Em3和Me8/Em5),分别对69株供试菌株进行PCR扩增。结果表明,10对引物共扩增出269条重复性DNA条带,其中多态性条带267条,多态性比率为99.19%,多态性丰富。每对引物扩增条带数为22~35条,平均每对引物可扩增条带27条,说明SRAP标记可产生较丰富的条带,且多态性条带检出率较高。
2.2.2 不同地区葡萄霜霉病菌的遗传多样性分析对69株葡萄霜霉病菌进行聚类分析结果显示(图3),不同个体间存在一定的遗传差异,供试菌株的相似性系数为0.60~0.84。在相似性系数0.622时,69个菌株被划分为5个类群。A类群为优势类群,共包括46个供试菌株,其中,辽宁省菌群为组内优势群体,共出现12株;其次为福建,5株;新疆、甘肃、云南等地菌株4株,陕西及山东3株;黑龙江2株,四川2株,山西1株,安徽1株,北京1株,河北1株,湖南省1株,江西省1株、宁夏1株;类群B在相似性系数0.67处分为3个亚群,第1个亚群包括来自辽宁省辽阳市的LY-2菌株和来自云南省的YN-2菌株;亚群2包括NX-1、JS-1、ZJ-1、SD-4、SD-5、SX-1、HN-1、SXX-2、HNN-2和HB-1菌株,亲缘关系较近,聚为一类;第3个亚群包括来自河北省的HB-2和HB-3菌株。类群C包括来自辽宁省的FX-2、SY-4、CY-1、CY-2和CY-3菌株,遗传差异较小。类群D包括来自辽宁省的DL-2、SY-5和JZ-1菌株亲缘关系较近,聚为一类。来自黑龙江省的HLJ-2菌株单独聚为E类群,与其余供试菌株亲缘关系较远。
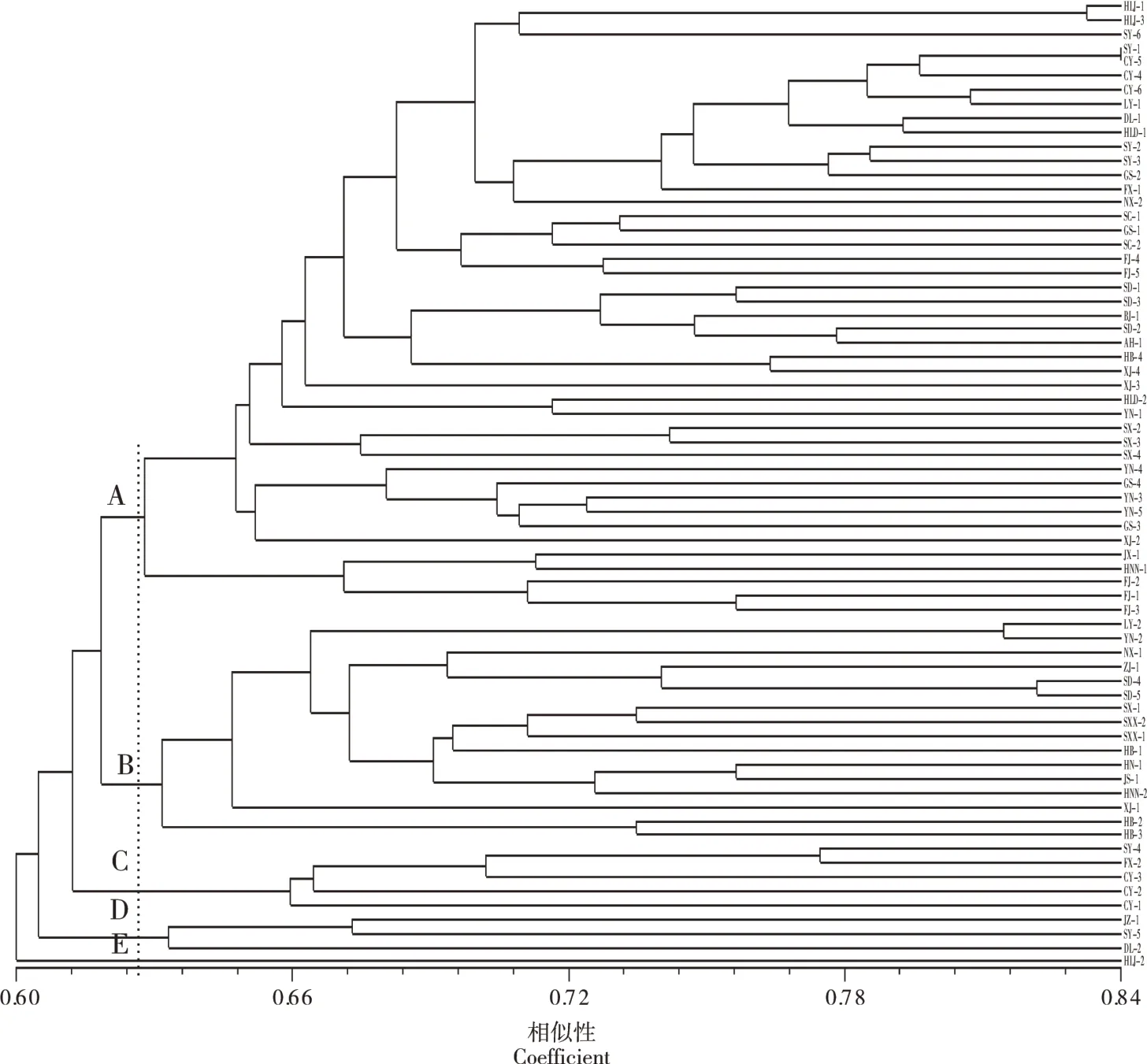
图3 69株葡萄霜霉病菌株的SRAP聚类图Figure 3 Dendrogram of 69 P.viticola isolates with SRAP
2.3 菌株致病力与SRAP类群相关性分析
由图4可知,A类群中共46株菌株,其中最强致病力菌株1株,强致病力菌株5株,中等致病力菌株20株,弱致病力菌株20株;B类群共有14株菌株,其中4株中等致病力菌株,10株弱致病力菌株;C类群中1株中等致病力菌株,4株弱致病力菌株;D类群和E类群菌株分别为3株和1株,全部为弱致病力菌株。从SRAP类群看,A类群中的菌株致病力分化程度较高,弱致病力菌株和中等致病力菌株数目相同;B类群和C类群中菌株致病力分化程度较低,弱致病力菌株占优势;D类群和E类群菌株全部为弱致病力菌株。从SRAP聚类图和致病力分化聚类图可以看出,在SRAP标记的聚类群组中,东北地区菌株的遗传多样性较丰富,其致病力分化程度也较高;而其他地区的遗传多样性分化不明显,其致病力分化程度也相对较低。
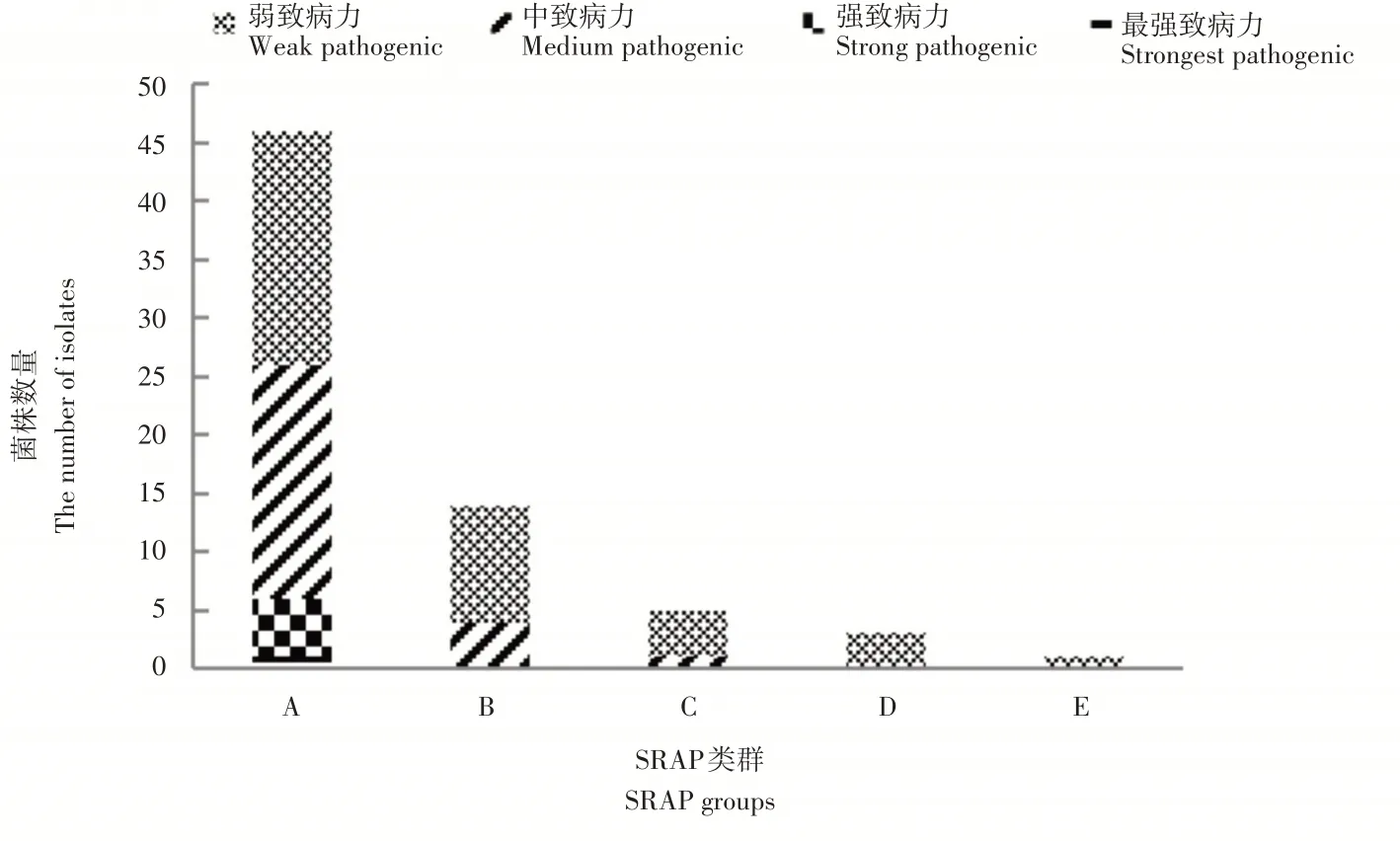
图4 菌株致病力与SRAP类群相关性分析Figure 4 The relevant analysis of the tested isolates disease index and SRAP
3 讨论与结论
在生产上,由于缺乏免疫和高抗的葡萄品种,在不合理的栽培模式和气候条件较适宜的情况下,会发生葡萄霜霉病的爆发和流行,因此应加强对葡萄霜霉病菌群体结构及其致病力的相关研究,对弄清该病菌的遗传进化规律和有效防控葡萄霜霉病具有深远的意义。目前葡萄霜霉病菌的致病力测定还没有一套标准、有效、统一的寄主,因此在不同的研究中所采用的致病力测定寄主有所不同。本研究对采自全国19个省(市)的葡萄霜霉病菌对无核白鸡心、巨峰和香悦3个不同抗性水平葡萄品种的致病力进行测定,病情指数聚类分析结构表明,供试的69株霜霉病菌存在一定程度的致病力分化。这与前人的研究结果一致[3,6,13],广西、河北、新疆和宁夏贺兰山东麓等不同地区的葡萄霜霉病菌存在致病力分化现象,同一地区不同寄主来源霜霉病菌群体间及不同菌株间致病力也存在显著差异。黄晓庆[5]也验证了来自河北、辽宁、吉林、河北、湖南省的14株霜霉病病菌存在致病力分化现象。
利用分子标记鉴定不同地区、不同葡萄霜霉病菌株的研究报道越来越多,有些研究认为葡萄霜霉病菌遗传多样性与地域和寄主来源无关[5,25],也有些研究认为葡萄霜霉病菌多样性与地理分布或栽植品种具有一定的相关性[3-4,7,26]。SRAP标记技术具有快速高效、稳定性好、操作简单等优点,可用于地区间病原真菌多样性分析及寄主、生态区等遗传背景差异造成的遗传多样性分析[27]。本研究利用SRAP技术分析采自全国19个省(市)的69株葡萄霜霉病菌的遗传多样性,发现来自辽宁省和黑龙江省的菌株分别分布于不同的类群,具有较丰富的遗传多样性,这可能是与辽宁省采样地点较分散、地域气候差异较大以及菌株本身的遗传特质等因素有关。而来自云南省、河北省、陕西省、福建省和山东省的菌株以很高的相似性水平聚在同一组中,表明该地区葡萄霜霉病菌菌株亲缘关系较近,遗传分化程度较低。遗传分化和地域来源之间并未发现具有明显相关性,这与前人的研究结果一致[4-5]。
研究首次报道了全国19个省(市)的葡萄霜霉病菌的致病性和遗传变异情况,发现其致病性与遗传变异之间不存在简单的对应关系。所测定的69株供试菌株中55%属于弱致病力菌株,36%属于中等致病力菌株,有关葡萄霜霉病菌致病力分化的致病机制尚需进一步研究。
