口蹄疫BHK21转瓶细胞培养血清加量的研究
2021-10-12脱浩亮
王 珍,脱浩亮
(中牧实业股份有限公司兰州生物药厂,兰州 730046)
近年来,随着口蹄疫疫苗生产工艺的技术升级,已从转瓶生产工艺全面转型升级为悬浮培养工艺,但在种毒制备过程中还离不开转瓶培养工艺,而转瓶细胞的培养离不开血清,所以血清在口蹄疫疫苗生产的环节中扮演着至关重要的角色。但是血清的市场价格近几年一直居高不下,而且还呈现出逐年上升的趋势,为降低生产成本,号召国家节能减排的国策。本研究通过改变转瓶细胞培养中血清的加量探讨口蹄疫转瓶培养的最佳血清加量。
1 材 料
1.1 种毒、转瓶细胞及培养基
BHK21转瓶细胞、口蹄疫O型及A型种毒,均由中牧股份兰州生物药厂提供;细胞培养基、1900病毒维持液,由宜兴赛尔生物科技有限公司提供。以上材料均为保质期内正常材料。
1.2 试验动物
2~3日龄、正常生活的昆明系健康乳鼠,体重6~8g,由兰州生物药厂四车间饲养人员提供。
1.3 仪器与设备
15L玻璃细胞瓶、转瓶机、超速离心机(型号为Beckman_L-100XP),均由兰州生物药厂配备。
2 方 法
将生长良好的转瓶细胞充分消化后,平均分成8份,分别加入血清含量为1%、2%、3%、4%、5%、6%、7%、8%的细胞培养液,按1∶5比例进行分种,置37℃的转瓶机中培养48h,观察细胞生长情况并做详细数据记录。
将培养48h的转瓶细胞消化后,再加入相应血清含量的细胞培养液,按1∶5比例进行分种,置37℃的转瓶机培养48h,观察细胞生长情况并做详细数据记录,使其连续传代5代。
将第5代培养48h不同血清含量的转瓶细胞弃去细胞废液,分别将含有5%口蹄疫O型及A型种毒的1900维持液加入细胞瓶,每瓶500mL,观察细胞病变情况并记录详细数据,待细胞病变达90%后收获[1]。
按照“口蹄疫疫苗生产检验规程”,用2~3日龄乳鼠检测收获病毒的半数致死量(LD50)。利用乳鼠进行疫苗效力检验,计算病毒的LD50。操作方法包括:在三级生物安全防护实验室将口蹄疫病毒不同梯度稀释后接种乳鼠,规定时间内统计小鼠死亡数,根据特有的公式计算病毒的LD50。
按照“口蹄疫疫苗生产检验规程”,用蔗糖密度梯度离心法检测口蹄疫病毒完整颗粒(146s)含量。口蹄疫病毒完整颗粒(146s)作为疫苗免疫时发挥作用的主要免疫原,在生产、储存、运输等任何环节中的不同程度的降解都会引起动物机体免疫后效力下降。按照蔗糖密度梯度超速离心法对口蹄疫病毒146s进行分离纯化,同时利用紫外分光光度计在259nm处检测吸收峰,并利用自动化电脑软件系统对吸收峰面积进行计算,从而得出口蹄疫病毒粒子146s的含量。目前该方法仍然是各大口蹄疫灭活疫苗生产企业对各生产环节中146s含量检测的主要技术。该方法也可用于成品苗中口蹄疫病毒146s抗原含量的测定[2]。
3 结果与分析
3.1 口蹄疫O型病毒转瓶细胞血清加量的影响
当血清加量在3%~5%时,LD50及146s较为理想,细胞形态良好,病变时间适中,结果见表1。
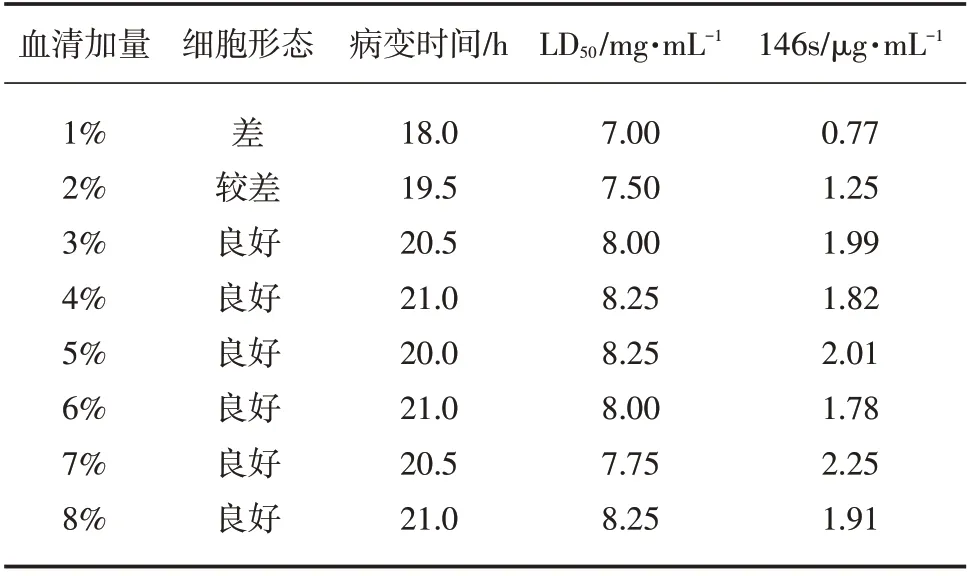
表1 口蹄疫O型病毒转瓶时细胞血清加量的影响
3.2 口蹄疫A型病毒转瓶细胞血清加量的影响
当血清加量在3%~5%时,LD50及146s较为理想,细胞形态较好,病变时间适中,结果见表2。

表2 口蹄疫A型病毒转瓶时细胞血清加量的影响
4 讨论与小结
在口蹄疫疫苗种毒生产过程中,转瓶细胞血清加量在3%以上时,细胞生长48h均能形成致密的单层,细胞形态良好,接毒后细胞病变时间较为稳定,病毒LD50及146s无明显差别。而转瓶细胞血清加量在2%以下时,细胞生长48h未能形成致密的单层,细胞形态较差,接毒后细胞病变时间缩短,病毒LD50及146s含量较低。因此在口蹄疫疫苗转瓶种毒生产过程中,应结合转瓶种毒LD50及146s结果、生产成本等因素综合考虑,以确定BHK21转瓶细胞培养血清的加量[3]。
综上所述,口蹄疫BHK21转瓶细胞培养的血清加量控制在3%~5%时较为理想,能达到试验要求又能满足节能减排。
另外值得关注的是,转瓶细胞血清的加量还取决于细胞培养基的营养,如果细胞培养基的营养更为充足,则血清的加量还有可能降低,有待于进一步探索。
