纯钛表面复合胶原蛋白凝胶涂层改性及其生物学性能初探
2021-10-12张文思朱文卿
张文思,朱文卿,邱 憬*
1南京医科大学附属口腔医院种植科,2江苏省口腔疾病研究重点实验室,3江苏省口腔转化医学工程研究中心,江苏 南京210029
纯钛具有良好的生物相容性,因此钛种植体广泛应用于牙列缺损和牙列缺失的种植体修复材料。目前临床多采用大颗粒喷砂-酸蚀、微弧氧化等技术构建表面微米级粗糙形貌以增加种植体与骨的接触面积和机械嵌合力,促进成骨细胞的黏附、增殖和分化[1-3]。一直以来,如何使钛种植体与周围骨组织产生快速稳固的结合是研究的热点。虽然对钛表面改性的研究从未停止,但钛表面有机生物涂层能否更好地促进钛种植体骨结合仍有待进一步探索。
胶原蛋白是主要的细胞外基质(extracellular matrix,ECM)蛋白之一。它具有纤维结构,这对于组织支架执行功能至关重要[4]。ECM中胶原蛋白的存在决定了机体组织的结构完整性、生化特性和生理功能。它通过特定受体和结合位点调节细胞功能,包括细胞黏附、迁移、增殖、分化和基因表达[5]。胶原蛋白还可通过向细胞提供生长因子来增强细胞功能[6]。到目前为止,已鉴定和表征了29种胶原蛋白[7]。其中,Ⅰ型胶原作为人体内含量最丰富的基质蛋白广泛存在于皮肤、肌腱、骨骼、韧带和角膜等结缔组织中[8]。Ⅰ型胶原蛋白具有低抗原性、可生物降解性、良好的生物相容性以及细胞增殖作用[9]。从天然原料提取和纯化的Ⅰ型胶原蛋白缺乏足够的机械强度,可通过交联改性法、重度脱水法、侧链修饰法以及生理活性物固定化来提升胶原的拉伸强度和抗降解能力,改善其力学性能和抗水性,以形成单一或复合形式的多孔支架或薄膜[10-11],从而为细胞附着和增殖提供有利形貌。因此,Ⅰ型胶原蛋白具有应用于材料表面有机涂层的潜力。
基于Ⅰ型胶原蛋白在维持组织结构和功能方面的重要性及其在生物医学、组织工程、药物发现和药物递送中的应用[12-13],可利用胶原蛋白生物膜进行钛表面有机生物涂层改性。改性方法包括物理交联法和化学交联法,化学交联法是使用戊二醛等有毒物质对胶原蛋白进行改性,物理交联法则不会引入毒性物质。通过物理交联法将Ⅰ型胶原蛋白附着于钛表面,可模仿天然微环境或作为运载工具对成骨起促进作用。然而,这种通过胶原纤维改性制备的钛表面生物涂层能否促进成骨分化、加速成骨进程,仍有待探究。因此,本实验拟通过物理改性法在纯钛表面制备Ⅰ型胶原蛋白生物涂层,并初步研究其对成骨细胞行为的影响。
1 材料和方法
1.1 材料
商用级纯钛(Tal,99.5%,宝鸡盛辉钛业),SiC砂纸(天津南景磨料磨具有限公司)、0.9%生理盐水、Ⅰ型牛骨胶原蛋白(上海国药公司),小鼠成骨细胞系MC3T3-E1(上海中国科学院细胞库),α-MEM 培养基、胎牛血清、0.25%胰蛋白酶/EDTA(Ethylene Diamine Tetraacetic Acid,Gibco BRL 公司,美国),青霉素/链霉素双抗溶液(Gibco 公司,美国),胰蛋白酶(Sigma公司,美国),4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)、CCK-8 试剂盒(上海碧云天生物技术有限公司)、罗丹明标记的鬼比环肽(Cytoskeleton 公司,美国),BCA 蛋白定量试剂盒(南京凯基生物),碱性磷酸酶(ALP/AKP)测试盒(南京建成生物科技有限公司),Runx相关转录因子2(Runt-related transcription factor-2,CST 公司,美国)、OSX(Osterix,CST 公司,美国)、骨钙素(osteocalcin,OCN,Abcam 公司,美国)、GAPDH 抗体(Sigma 公司,美国),辣根过氧化物酶标记的山羊抗鼠、山羊抗兔、兔抗山羊二抗(Santa Cruz 公司,美国),ECL Western blot 试剂盒(Millipore 公司,美国)。扫描电子显微镜(1530VP,LEO 公司,德国),X 射线光电子能谱仪(Thermo Escalab 250Xi,Thermo 公司,美国),红外光谱测试仪(Nicolet ISSO,Thermo公司,美国),标准型光学接触角仪(SL200B,科诺公司,美国),细胞恒温培养箱(Thermo 公司,美国),激光共聚焦显微镜(LSM710,Zeiss 公司,德国),微孔板分光光度计(MD 公司,美国),化学发光凝胶成像系统(LAS4000mini,GE公司,美国)。
1.2 方法
1.2.1 试件及Ⅰ型胶原蛋白凝胶制备
光滑钛(cp-Ti)试件:碳化硅砂纸(320目、600目、800 目、1 200 目、1 500 目)逐级打磨抛光,依次置于双蒸水、无水乙醇、双蒸水中超声清洗10 min,60 ℃干燥,高压灭菌。
钛表面Ⅰ型胶原蛋白涂层改性试件(cp-Ticol):根据说明书采用冰醋酸调节Ⅰ型胶原蛋白pH为中性,用去离子水与Ⅰ型胶原蛋白混合,经过37 ℃温度变化,胶原蛋白自组装为胶原纤维形成凝胶,配制1 mg/mL的Ⅰ型胶原蛋白凝胶后,置于光滑钛试件表面制成涂层,经过5 h 紫外线照射使胶原纤维凝胶再次发生交联[14],胶原蛋白涂层重度脱水后具有良好的抗胶原酶解能力,降低了胶原的水溶性,有利于提升其生物相容性。
1.2.2 钛表面理化性能表征
两组试件制备完成后,采用扫描电子显微镜(scanning electron microscopy,SEM)观察试件的表面微形貌;采用X 射线光电子能谱仪(X-ray photoelectron spectroscopy,XPS)分析试件的表面元素组成;采用红外光谱测试仪(fourier transform infrared spectrometer,FT-IR),在波长400~4 000 cm-1范围内检测试件表面的基团;采用SL200B 型自动接触角仪,将2 μL水滴于试件表面,测量水接触角,评估试件的表面亲水性。
1.2.3 成骨细胞体外培养
复苏冻存的小鼠MC3T3-E1 成骨细胞,采用含10%胎牛血清、1%青-链霉素的α-MEM 培养基,在37 ℃、95%相对湿度、5%CO2细胞恒温培养箱内静置培养。定期传代,采用3 次传代后24 h 的细胞进行实验。当细胞密度达80%~90%后用0.25%胰蛋白酶/EDTA消化,离心后重悬,计数并分离细胞。
1.2.4 成骨细胞黏附观察
将MC3T3-E1 细胞(5×103个/孔)接种于两组试件表面。分别培养2 h 和4 h 后,室温下4%多聚甲醛固定30 min,罗丹明标记的鬼比环肽室温下避光染色30 min,PBS清洗后,DAPI室温避光染色2 min。激光共聚焦显微镜(confocal laser scanning microscope,CLSM)下随机选取视野,观察两组试件表面的细胞黏附形态。
1.2.5 成骨细胞增殖活性检测
采用CCK-8 法检测两组试件表面成骨细胞的增殖活性。分别将两组试件置于96 孔板中,将MC3T3-E1细胞(5×103个/孔)接种于试件表面,每组设4 个复孔,培养1、3、6 d 后,每孔加入200 μL 含10%CCK-8试剂的新鲜培养基,继续孵育2 h后,采用微孔板分光光度计测定各孔450 nm 处的吸光度值。吸光度值越高表示细胞增殖活性越高。
1.2.6 碱性磷酸酶(alkaline phosphatase,ALP)活性检测
微板法检测:两组试件预置于6 孔板中,将MC3T3-E1细胞(8×104个/孔)接种于试件表面,进行成骨诱导,培养7、14 d后,弃培养基,PBS清洗,每孔加入200 μL RIPA 裂解液,冰上裂解30 min,收集裂解细胞,4 ℃12 000 r/min 离心10 min,收集上清液。使用BCA 试剂盒和ALP 试剂盒测定蛋白浓度和ALP值,评估各组试件表面ALP活性。
染色法检测:两组试件预置于6 孔板中,将MC3T3-E1细胞(8×104个/孔)接种于试件表面,培养7、14 d后,PBS清洗,用4%福尔马林固定30 min,使用5-溴-4-氯-3-吲哚基磷酸(5-Bromo-4-Chloro-3-Indolyl Phosphate,BCIP)/硝基蓝四唑(Nitrobluetetrazolium chloride,NBT)碱性磷酸酶染色30 min。再次在PBS中洗涤样品,比较各组ALP染色强度。
1.2.7 Western blot检测成骨相关蛋白表达
两组试件预置于6 孔板中,将MC3T3-E1 细胞(8×104个/孔)接种于试件表面,培养7、14 d后,提取细胞总蛋白,加热变性后-20°C保存。BCA蛋白检测试剂盒测定蛋白浓度。Western blot 检测细胞中Runx2、OSX、OCN 的蛋白表达水平,以GAPDH 为内参。
1.3 统计学方法
采用SPSS 22.0 软件对细胞增殖活性和ALP 活性数据进行统计分析,两组数据经方差齐性检验后采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 钛表面形貌观察
cp-Ti、cp-Ti-col 试件表面形貌和扫描电镜观察图像见图1。经过物理改性后的Ⅰ型胶原蛋白在钛表面发生交联,形成稳定均匀的胶原蛋白凝胶涂层。扫描电镜低倍和高倍视野显示,cp-Ti试件表面有清晰的机械划痕,而cp-Ti-col 试件表面由于胶原蛋白涂层的存在使得机械划痕变浅。

图1 cp-Ti、cp-Ti-col试件表面形貌和扫描电镜图像Figure 1 Surface morphology and SEM images of cp-Ti and cp-Ti-col specimens
2.2 钛表面元素组成和特征基团
两组试件表面的XPS元素分析和FT-IR检测结果见图2。与cp-Ti 试件比较,cp-Ti-col 试件表面存在明显的氮(N)元素特征峰,且由于胶原蛋白涂层的存在,未检测出钛(Ti)元素(图2A)。在胶原蛋白改性过程中,只有蛋白质或多肽含有N元素。cp-Ti-col试件表面在3 400 cm-1附近呈现蛋白质的特征吸收峰。在1 651 cm-1附近的吸收峰为胶原蛋白酰胺Ⅰ带。1 546 cm-1附近的吸收峰为胶原蛋白酰胺Ⅱ带,反映了C-N伸缩和N-H弯曲。由于胶原蛋白的甘氨酸和特征氨基酸含量高且形成独特序列(Gly-Pro-Hyp)n,使得胶原蛋白在1 200 cm-1~1 400 cm-1处具有其他蛋白质所没有的红外光谱特征。1 200 cm-1~1 360 cm-1谱带是由C-N 伸缩和N-H 弯曲引发的酰胺Ⅲ带,出现归属于Gly 骨架和Pro 侧链的CH2摇摆振动峰,其中,在1 238 cm-1附近的吸收峰为胶原蛋白N-H弯曲引发的酰胺Ⅲ带特征峰(图2B)。因此,PS分析和FT-IR检测结果相一致,证实cp-Ti-col试件表面存在胶原蛋白凝胶涂层。
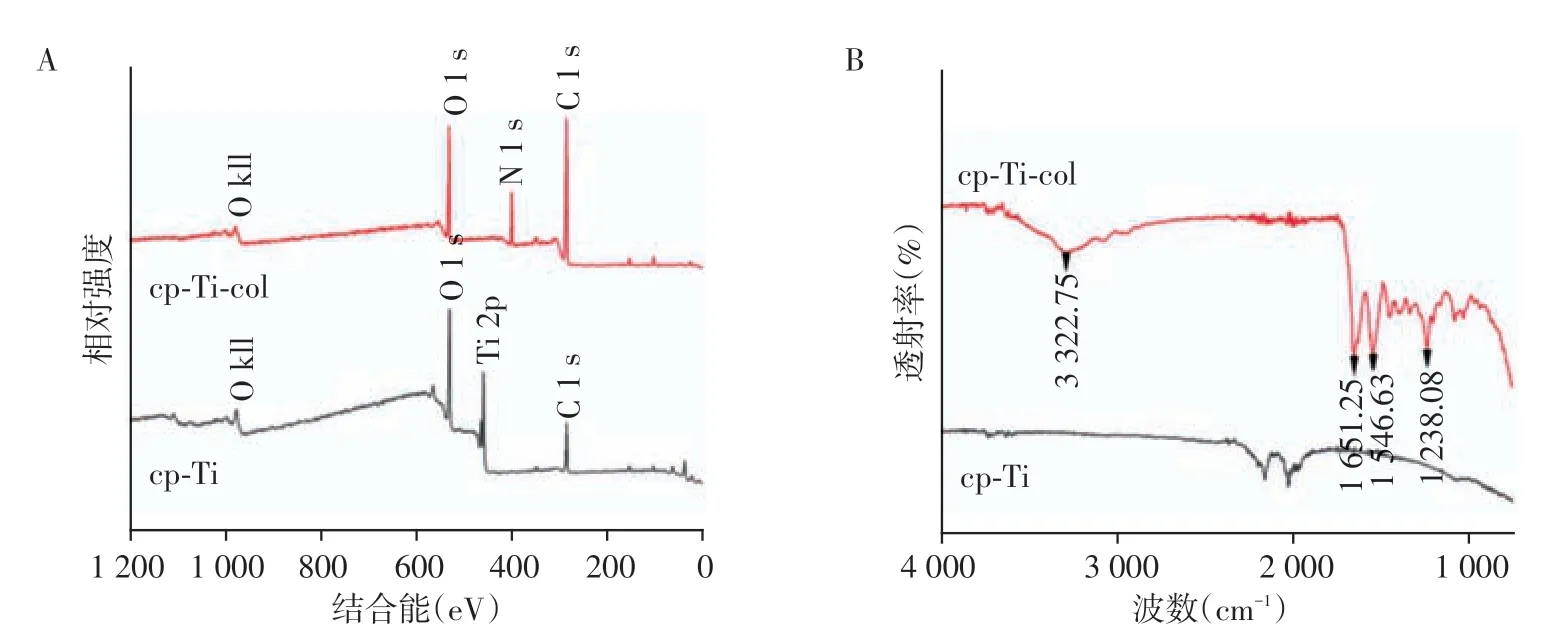
图2 cp-Ti、cp-Ti-col试件的XPS分析(A)和FT-IR检测(B)Figure 2 XPS(A)and FT-IR(B)analysis of cp-Ti and cp-Ti-col specimens
2.3 钛表面接触角
两组试件表面接触角测量结果如图3 所示,相对于cp-Ti试件,cp-Ti-col试件表面的接触角明显减小。接触角大小与亲水性呈反比,因而cp-Ti-col 试件表面具有更好的亲水性。

图3 cp-Ti、cp-Ti-col试件表面接触角Figure 3 Surface contact angles of cp-Ti and cp-Ti-col specimens
2.4 钛表面成骨细胞的黏附铺展
两组试件表面接种MC3T3-E1细胞2 h、4 h后的黏附形态见图4。低倍镜观察显示:两组试件表面的成骨细胞数量均随时间延长而增加,且cp-Ti-col试件表面的成骨细胞数量较cp-Ti 试件更多。高倍镜观察显示:两组试件表面成骨细胞铺展面积均随时间延长而增大,相对于cp-Ti 试件,cp-Ti-col 试件表面的成骨细胞骨架清晰,胞浆内可见丝状骨架,细胞铺展更加充分。
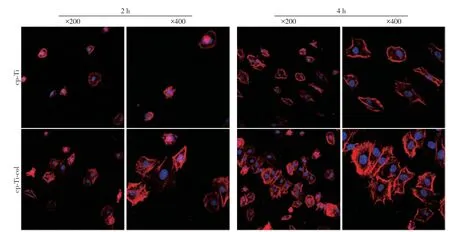
图4 两组试件表面MC3T3-E1细胞接种2 h、4 h后的黏附形态Figure 4 Adhesion morphology of MC3T3-E1 cells cultured on two substrates after 2 and 4 hours
2.5 钛表面成骨细胞的增殖活性
两组试件表面MC3T3-E1细胞增殖活性的CCK-8检测结果见图5。两组试件表面成骨细胞增殖水平随培养时间延长逐渐升高。培养第1、3、6 d,相对于cp-Ti试件,相同时间点cp-Ti-col试件表面成骨细胞的增殖活性均显著增加,差异有统计学意义(P<0.05)。
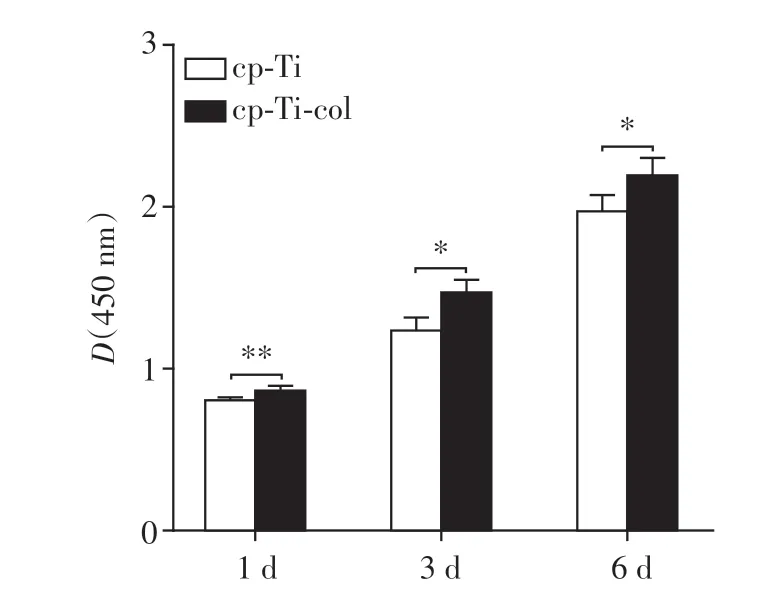
图5 两组试件表面培养MC3T3-E1细胞1、3、6 d的CCK-8检测结果Figure 5 The results of CCK-8 assay for MC3T3-E1 cells cultured on two substrates after 1,3 and 6 days
2.6 钛表面成骨细胞的ALP活性
微板法检测两组试件表面MC3T3-E1 细胞的ALP活性结果见图6A。随着时间增加,两组试件表面成骨细胞的ALP 活性均有所增加。在两组试件表面培养成骨细胞7 d、14 d 后,cp-Ti-col 组的ALP活性均显著高于cp-Ti 组,差异有统计学意义(P<0.05)。染色法检测两组试件表面MC3T3-E1细胞的ALP活性结果见图6B。随着时间增加,两组试件表面成骨细胞的ALP 活性染色均有所增强。在两组试件表面培养成骨细胞7 d、14 d 后,cp-Ti-col 组的ALP活性染色均明显强于cp-Ti组。

图6 两组试件表面培养MC3T3-E1 细胞7 d、14 d 的ALP活性检测结果Figure 6 The results of ALP activity assay for MC3T3-E1 cells cultured on two substrates after 7 and 14 days
2.7 钛表面成骨细胞的成骨相关蛋白表达
两组试件表面培养MC3T3-E1 成骨细胞7 d、14 d 后的成骨相关蛋白表达见图7A。相对于cp-Ti试件,cp-Ti-col 试件表面成骨细胞的Runx2、OSX、OCN蛋白表达水平均显著提高(图7B、C)。

图7 两组试件表面培养MC3T3-E1细胞7 d、14 d的成骨相关蛋白(Runx2、OSX、OCN)表达Figure 7 Osteogenic-related protein expressions of Runx2,OSX and OCN in MC3T3-E1 cells cultured on two substrates after 7 and 14 days
3 讨论
胶原蛋白具有良好的生物相容性和可降解性,可作为天然支架材料而备受关注。Fang 等[15]研究发现,将人牙髓干细胞接种于Ⅰ型胶原蛋白中,培养一段时间后出现持续性骨再生。Prescott 等[16]将人牙髓干细胞、胶原支架和牙本质基质蛋白移植于小鼠皮下,可生成牙髓样组织。此外,Kim等[17]的研究表明,在胶原、明胶和壳聚糖3种天然支架材料中分别培养人牙髓干细胞,一定时间后胶原能更好地促进牙髓干细胞增殖。由此可见,胶原作为一种天然支架材料在组织工程领域中具有广阔的应用前景。
良好的生物相容性是种植体材料的首要因素。在本研究中,XPS 和FT-IR 检测发现钛表面存在胶原蛋白的特征性氮元素和基团,而接触角测量结果显示,胶原蛋白涂层改性钛表面的水接触角减小,表现出更好的亲水性。材料表面的细胞黏附是细胞增殖的前提,而细胞的早期黏附与材料表面的形貌和基质有关。与此同时,成骨细胞的增殖能力决定了细胞成骨分化的速度和时间。较之光滑钛表面,钛表面复合胶原蛋白凝胶涂层能促进成骨细胞的黏附和增殖。究其原因,可能是胶原在紫外线和重度脱水条件下发生交联[14],进而为成骨细胞提供有力的结合位点,促进其早期黏附,而成骨细胞黏附后伪足的充分伸展更有利于细胞增殖。该结果与相关文献报道一致[5,10]。
钛表面复合胶原蛋白凝胶涂层除了为成骨细胞提供有力的结合位点外,能够加速成骨进程也至关重要。随后,我们针对两种钛表面的成骨细胞分化进行了研究。成骨细胞在增殖后开始分化,产生细胞外基质,基质矿化成熟后形成骨组织。在此过程中,ALP活性与成骨细胞的分化程度密切相关[18]。在本研究中,胶原蛋白涂层改性钛表面的成骨细胞具有更强的ALP活性,因而随着细胞黏附定植时间的延长,表现出更显著的成骨分化。
Runx2 是骨形成过程中的一种关键转录因子,在成骨细胞的早期分化中起促进作用[19]。OSX 特异性表达于发育的骨组织中,能诱导前成骨细胞分化为成熟的成骨细胞[20]。OCN是骨基质矿化过程中由成骨细胞形成的非胶原蛋白,是成骨活动和骨转换的重要标志。Runx2、OSX和OCN的蛋白表达水平能够反映成骨细胞的分化情况。在本研究中,相对于光滑钛表面,胶原蛋白涂层改性钛表面培养成骨细胞7 d和14 d后均显示成骨相关蛋白(Runx2、OSX和OCN)表达水平显著提高,表现出更强的成骨分化能力。该结果与ALP活性检测结果相一致。
胶原蛋白肽键之间存在离子键、范德华力以及非极性基团产生的疏水键作用力,在其自组装形成凝胶到紫外线照射干燥的过程中,通过物理吸附稳定存在于钛表面,进而在钛表面形成胶原蛋白涂层。Hong等[21]研究发现,在钙磷涂层表面物理吸附胶原蛋白条件下,MG-63 细胞的黏附能力无明显提高,但细胞增殖和成骨分化能力显著增强。同时,对比分析了物理吸附法和仿生共沉积法固定胶原蛋白对MG-63 细胞黏附、增殖和成骨分化的影响,发现物理吸附法的效果更优。本研究将Ⅰ型胶原蛋白经恒温及紫外线照射产生交联后物理吸附于钛表面形成稳定涂层,并初步探究其表面的成骨细胞行为,发现胶原蛋白凝胶涂层显著增强了钛表面的生物活性,为成骨细胞提供有力的结合位点,有利于成骨细胞的黏附、增殖和成骨分化。该研究结果可为钛表面有机生物涂层改性的进一步拓展提供参考依据。
