特殊饲料饮食诱导非酒精性脂肪性肝炎小鼠模型的构建与研究
2021-10-12朱建国
李 晴 朱建国
(1上海交通大学农业与生物学院/上海市兽医生物技术重点实验室,上海 200240;2上海睿智化学研究有限公司,上海 200120)
非酒精性脂肪肝病(Non-alcoholic Fatty Liver Disease, NAFLD)是全球最为常见的肝脏疾病之一[1]。随着人们生活水平的提高以及生活习惯、饮食结构的改变,肥胖和糖尿病的发病率增加,NAFLD的发病率也呈上升趋势,其中,有10%~20%的NAFLD可发展为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)。
NASH以肝脏脂肪浸润、炎性反应、肝细胞损害、坏死和纤维化为特征,有发展为肝纤维化、肝硬化、肝衰竭和肝细胞癌的风险[2]。然而,目前关于NASH的发病机制仍不清楚,仍需对NASH的病理生理学和分子生物学发病机制等进行深入研究,以利于临床诊断和治疗[3]。为此,医学界建立了多个疾病动物模型,以探明NASH的发病机制。从现有的研究成果来看,疾病动物模型主要分为药物中毒性脂肪肝动物模型、特殊品系脂肪肝动物模型、营养失调性脂肪肝动物模型、复合因素诱导的脂肪肝动物模型[4]。其中,营养失调性脂肪肝动物模型,是给予高脂肪、高糖饲料喂养建立的脂肪肝模型,即在食物中添加过量脂类、胆固醇和糖类,从而使动物无法完全吸收利用,使脂类堆积于肝而引起脂肪肝,进一步出现肝炎和肝脏纤维化,该模型与人类的NASH相似,且病变有渐进性过程,便于药物干预,但该模型的缺点也较为明显,如病变轻、造模时间较长(约需喂养半年以上)[5]。因此,寻求出更理想的模型对于该疾病的药物筛选意义重大。在此背景下,笔者构建了特殊饲料饮食诱导非酒精性脂肪性肝炎小鼠模型,并对该模型进行了验证。现将相关研究结果报道如下。
1 材料与方法
1.1 实验动物
选用SPF级C57BL/6J雄性小鼠,4~5周龄,180只,购于北京维通利华实验动物技术有限公司,饲养于铺有玉米芯垫料的聚碳酸酯笼盒内,动物房温度控制在21~25 ℃,湿度控制在40%~70%,12 h光照、循环(7:00~19:00)。小鼠所用饲料为美国公司Research Diets生产的专业啮齿类实验动物饲料,普通饲料型号为Rodent Diet#5001,特殊饲料型号为D09100301,饲料成分见表1和表2。实验前,小鼠在SPF级动物房内适应1周,待兽医评估动物状态,确定能够作为实验动物后再进行实验。

表1 特殊饲料组成成分

表2 特殊饲料营养成分 (单位:%)
1.2 仪器与试剂
主要试剂为:谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)、总胆固醇(TC)、胰岛素试剂盒,金属蛋白酶抑制剂-1(TIMP-1)、血清细胞角蛋白-18(CK-18)、透明质酸(HA)、III型前胶原N端肽(PIIINP),均购自Merck Millipore。
主要仪器为:酶标仪(Bio-Tek U.S.A)、COBAS600型全自动生化分析仪(德国罗氏诊断公司)、超薄切片机(德国Leica CM3050S)、BMJIII型包埋机(常州市中威电子仪器厂)、Tissue-Tek VIP自动脱水机(SAKURA INC)、光学显微镜照相系统(日本OLYMPUS)。
1.3 实验设计
根据小鼠体重,挑选160只体型健壮的小鼠进行实验,并将其随机分为2组,分别为普通饲料组和特殊饲料组,并分别在第2、4、5、7.5个月每组各安乐死20只小鼠,进行生物学指标检测。
1.4 检测项目
非酒精性脂肪性肝炎小鼠模型的生物学指标具体为:小鼠的体重,附睾脂肪和肝脏的重量;餐后血糖水平和胰岛素水平;胆固醇和甘油三酯的水平;炎症和肝功能的生物标记物(细胞角质素CK18、丙谷转氨酶、天门冬氨酸转移酶);肝脏纤维化的生物标记物(透明质酸、金属蛋白酶抑制剂-1、III型前胶原氨基端肽)。
非酒精性脂肪性肝炎小鼠模型采用NAS进行评分,实验数据以平均值±标准误差(Mean±SEM)表示,采用单因素分析和独立样本t检验进行误差显著性分析,使用Graph Pad Prism 5.0进行图形分析。
2 结果与分析
2.1 小鼠体重、附睾脂肪和肝脏重量的变化
由图1、图2、图3可知,从喂养的第2个月开始,特殊饲料组小鼠体重、附睾脂肪和肝脏重量显著性高于普通饲料组。

图1 实验期间小鼠体重的变化情况

图2 实验期间小鼠附睾脂肪重量的变化情况

图3 实验期间小鼠肝脏重量的变化情况
2.2 餐后血糖和胰岛素水平的变化
由图4、图5可知,实验期间普通饲料组和特殊饲料组的小鼠餐后血糖无明显区别,但从第2个月开始,特殊饲料组的小鼠餐后胰岛素水平显著高于普通饲料组。

图4 实验期间小鼠餐后血糖水平的变化情况

图5 实验期间小鼠胰岛素水平的变化情况
2.3 血浆中胆固醇和甘油三酯的变化
由图6、图7可知,实验期间普通饲料组和特殊饲料组的小鼠血浆中甘油三酯水平无明显区别,但从第2个月开始,特殊饲料组的小鼠血浆中胆固醇水平显著高于普通饲料组。

图6 实验期间小鼠血浆中胆固醇水平的变化情况

图7 实验期间小鼠血浆中甘油三酯水平的变化情况
2.4 炎症和肝功能生物标记物的变化
由图8、图9、图10可知,从第2个月开始,特殊饲料组的小鼠的细胞角蛋白含量显著高于普通饲料组,且伴有时间依赖性。从第5个月开始,特殊饲料组的小鼠的丙谷转氨酶含量和天门冬氨酸氨基转移酶含量显著高于普通饲料组,且也伴有时间依赖性。

图8 实验期间小鼠的细胞角蛋白含量变化情况

图9 实验期间小鼠的丙谷转氨酶含量变化情况
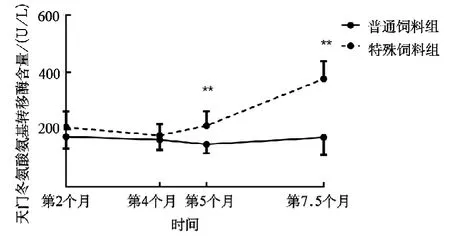
图10 实验期间小鼠的天门冬氨酸氨基转移酶含量变化情况
2.5 肝脏纤维化生物标记物的变化
由图11、图12、图13可知,在整个实验期间,特殊饲料组和普通饲料组的小鼠的透明质酸含量无明显区别。从第7.5个月开始,特殊饲料组的小鼠的金属蛋白酶抑制含量和III型前胶原氨基端肽含量显著高于普通饲料组。

图11 实验期间小鼠的透明质酸含量变化情况

图12 实验期间小鼠的金属蛋白酶抑制剂含量变化情况

图13 实验期间小鼠的Ⅲ型前胶原氨基端肽含量变化情况
2.6 非酒精性脂肪性肝炎小鼠模型的NAS(NAFLD,Activity Score)评分
对小鼠模型进行NAFLD活动度评估,即NAS评分。对肝脏病理改变的3项[小叶内炎症(0~3)、脂肪变性(0~3)和肝细胞气球样变(0~3)]进行半定量评估计分(0~12),具体结果见图14、图15、图16。根据NAS总分值进行诊断(标准为:NAS<3,排除NASH;NAS≥4,可诊断为NASH)。由图17可知,喂食5个月后,特殊饲料组的小鼠模型NAS评分>4,可诊断为NASH。
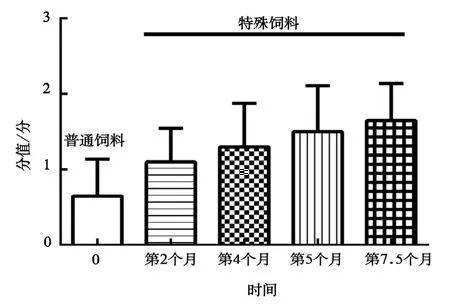
图14 实验期间小鼠的小叶内炎症评估情况
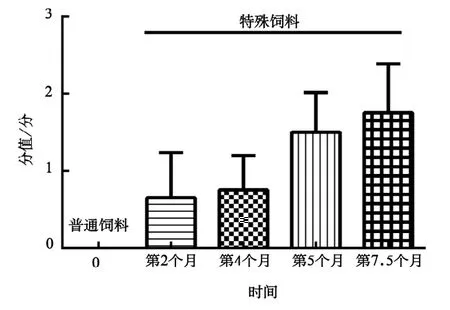
图15 实验期间小鼠的脂肪变性评估情况

图16 实验期间小鼠的肝细胞气球样变评估情况
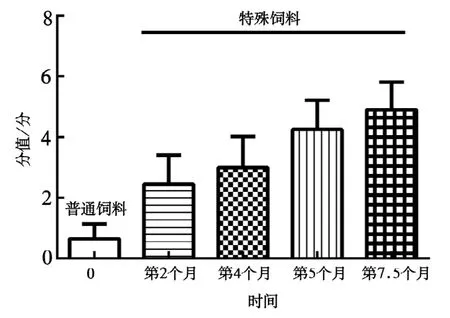
图17 小鼠模型的NAS评分
3 结果与讨论
近年来,非酒精性脂肪性肝炎的发病率呈逐年上升的趋势,已严重威胁到人体健康,且目前仍无有效的治疗手段。因此,建立理想的非酒精性脂肪性肝炎动物模型对于深入研究该疾病的发生、治疗和预防均具有重要意义。
目前,人们对非酒精性脂肪性肝炎的发病机制并不十分清楚(推测遗传敏感性和多元代谢絮乱的相互作用可能是致病的重要因素,如氧应激和脂质过氧化损伤、胰岛素抵抗、线粒体功能障碍、细胞因子、细胞凋亡、细胞色素P450、脂联素、遗传因素和免疫反应等)[6],且目前还没有一个能完整反映人类非酒精性脂肪性肝炎的组织病理学和病理生理学特征的动物模型(现有的动物模型很少或仅能部分重现人类非酒精性脂肪性肝炎的病理特征,很多重要的病变如胰岛素抵抗和纤维化均没有再现)[7]。因此,亟需一个理想的动物模型来尽可能地模拟临床病人的发病过程和致病机制。
本实验所构建的利用特殊饲料诱导非酒精性脂肪性肝炎雄性C57小鼠模型,在病因学、组织病理学和全身疾病等方面,均与人类非酒精性脂肪性肝炎极为相似。经分析,构建的小鼠模型具有稳定性好、可重复性高、方法简便、病死率低、病变有渐进性过程、造模停止后逆转缓慢、便于药物干扰等特点,是研究非酒精性脂肪性肝炎发病机制和寻求临床治疗策略的一个很好的工具和平台,适合多种药物干预方式及相关疾病的机制研究,是理想的治疗非酒精性脂肪性肝炎药物的筛选模型。因此,本实验构建小鼠模型可用于非酒精性脂肪性肝炎药物药效实验的筛选。
