免疫治疗相关肝毒性的诊断与管理
2021-10-12华雨薇
华雨薇,赵 林
中国医学科学院 北京协和医学院 北京协和医院肿瘤内科,北京 100730
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的发现和应用开启了肿瘤治疗的新时代。2011年,细胞毒性T淋巴细胞相关抗原- 4(cytotoxic T lymphocyte associated antigen- 4,CTLA- 4)抑制剂易普利单抗首次获美国食品药品监督管理局批准后,程序性死亡[蛋白]- 1(programmed death- 1,PD- 1)抑制剂(帕博利珠单抗、纳武利尤单抗)和其配体(programmed death ligand- 1,PD-L1)抑制剂(阿特珠单抗、阿维鲁单抗、德瓦鲁单抗)及多种国产PD- 1抗肿瘤药物相继获批,覆盖黑色素瘤、非小细胞肺癌、胃癌、头颈部鳞癌、尿路上皮癌等10余个瘤种的近50个适应证[1]。
机体正常免疫过程中,T细胞的活化需双信号刺激。第一信号由T细胞受体与主要组织相容性复合体及其呈递的抗原肽结合引发,第二信号由共刺激分子如CD28与其配体结合引发。免疫检查点分子CTLA- 4作为初始T细胞表面的共刺激分子,可与CD28竞争性结合其配体,从而使CD28的结合受阻,影响初始T细胞的活化;而另一常见的免疫检查点分子PD- 1主要作用于效应T细胞的活化阶段,与其配体PD-L1结合,下调T细胞活性。此类免疫检查点分子在免疫微环境中的过表达参与了肿瘤细胞的免疫逃逸,而ICIs作用于CTLA- 4及PD- 1/PD-L1通路,可激活机体的免疫系统,达到清除肿瘤细胞的目的。
虽然免疫治疗具有广阔的发展前景,但其引起的免疫失调可导致机体出现类似于自身免疫性疾病的副作用,称免疫相关不良事件(immune-related adverse events,irAEs)。irAEs一般临床分为4级,1~2级症状较轻,而3~4级可能需要住院治疗。irAEs的发生机制尚不清楚,可能与活化的T细胞攻击正常组织、自身抗体水平升高、炎症细胞因子增加和CTLA- 4异位表达引起抗体依赖性细胞介导的细胞毒作用有关[2]。这种自身免疫失调可累及全身各个系统,包括皮肤、胃肠和内分泌等系统。irAEs通常可被有效控制,但亦有导致患者死亡的案例报道。一项大型回顾性分析发现,接受免疫治疗的肿瘤患者中2%(613/31 059)出现了致命性irAEs,其中0.4%(124/31 059)为重症肝毒性患者[3]。因此,本文聚焦免疫治疗相关肝毒性,总结其流行病学数据,并对其诊断和管理提出建议。
1 免疫治疗相关肝毒性的发生率
免疫治疗相关肝毒性的发生率约为2%~10%[4],相较于其他irAEs(如皮肤、内分泌系统)的发生率低[5- 6]。免疫治疗相关肝毒性的发生率与免疫治疗方案存在较大的相关性,CTLA- 4免疫治疗相关肝毒性的发生率普遍高于PD- 1/PD-L1,如易普利单抗免疫治疗相关肝毒性的发生率为14.6%(病情严重者为5.7%),纳武利尤单抗的发生率为6.2%(病情严重者为1.1%)[7]。联合用药免疫治疗相关肝毒性的发生率高于单药治疗,常规剂量单药治疗肝毒性的发生率为5%~10%(其中3 级irAEs为1%~2%),而联合用药的发生率为25%~30%(其中3 级irAEs为15%)[8]。免疫治疗相关肝毒性的发生亦与药物剂量相关,接受易普利单抗3 mg/kg+纳武利尤单抗1 mg/kg 联合用药的患者免疫治疗相关肝毒性的发生率约为20%,而接受易普利单抗1 mg/kg+纳武利尤单抗3 mg/kg治疗的患者肝毒性的发生率为12%[9]。
真实世界研究发现,实际免疫治疗相关肝毒性的发生率远高于临床试验。一项纳入1480例患者的回顾性研究发现,接受免疫治疗(单药或联合用药)的患者中50%以上出现肝功能异常,其中14.9%为3~4级免疫治疗相关肝毒性[10],分析原因可能为临床试验的入组标准导致了选择偏倚。
需特别注意的是,ICIs与一些肿瘤靶向药物联合应用可产生严重的肝毒性。如Spigel等[11]报道13例晚期非小细胞肺癌患者接受纳武利尤单抗联合酪氨酸激酶抑制剂(克唑替尼)治疗,其中38%的患者因肝功能严重受损而停药,15%的患者死亡;Yang等[12]亦报道7例EGFR突变型非小细胞肺癌患者使用帕博利珠单抗联合酪氨酸激酶抑制剂(吉非替尼)治疗,其中5例(71.4%)发生3~4级肝毒性。其具体机制尚不明确,可能为ICIs提高了肝脏对其他毒性损伤的敏感性[13],因此临床工作中应特别注意联合用药的副作用。
此外,免疫治疗相关肝毒性的发生与肝脏的基础状态密切相关,肝脏肿瘤、自身免疫性肝病、慢性病毒性肝炎均可增加免疫治疗相关肝毒性的发生率。研究发现,肝细胞癌患者免疫治疗相关肝毒性的发生率高于肝外其他恶性肿瘤患者。肝细胞癌患者使用帕博利珠单抗的免疫治疗相关肝毒性发生率为9%(其中3 级irAEs为4%)[14],而肝外恶性肿瘤患者使用帕博利珠单抗的肝毒性发生率为4%~7%(其中3 级irAEs为1%)[15]。可能因肝细胞癌患者多数合并肝硬化,在基线水平存在更少的正常肝细胞,从而导致肝功能失常阈值降低[16]。针对肝转移癌的研究,目前尚缺乏相关数据,但一项纳入491例接受帕博利珠单抗治疗的多瘤种患者的回顾性研究发现,71例出现肝功能损伤的患者中52.9%存在肝转移癌,而未出现肝功能损伤的患者中仅21.4%存在肝转移癌[17],提示肝转移癌患者更易出现免疫治疗相关肝毒性。目前尚无针对自身免疫性肝病的单独研究,但一项多中心研究显示,112例存在自身免疫性疾病的患者接受免疫抑制剂治疗后,71%的患者出现了原发病活动或新发irAEs[18],因此推测自身免疫性肝病可能增加免疫治疗相关肝毒性的发生率。
目前尚无慢性病毒性肝炎增加免疫治疗相关肝毒性发生率的研究报道,但从发生机制而言,慢性病毒性肝炎可能诱导调节性T细胞水平升高,从而使肝细胞处于免疫抑制的微环境中,而使用ICIs逆转了T细胞的耗竭状态,再次激活免疫反应,可能加重肝细胞损伤[19]。因此,推测慢性病毒性肝炎可能增加免疫治疗相关肝毒性的发生率。
2 免疫治疗相关肝毒性的识别与管理
2.1 识别
免疫治疗相关肝毒性通常无特殊临床表现[4],少数患者表现为发热[20],但多数患者以实验室检查发现肝脏转氨酶升高为特征,通常为天冬氨酸转氨酶(aspartate transaminase,AST)和丙氨酸转氨酶(alanine aminotransferase,ALT)升高,可伴有胆红素、碱性磷酸酶(alkaline phosphatase,ALP)及γ-谷氨酰转肽酶(γ-glutamyl transpeptadase,γ-GT)升高。影像学表现通常无特异性[21]。
免疫治疗相关肝毒性一般发生于免疫治疗后的数周至数月,6~14周较为常见[15]。日本一项大数据研究发现,采用ICIs治疗的患者发生免疫治疗相关肝毒性的中位时间分别为:纳武利尤单抗74(20~184.3)d,帕博利珠单抗33(19~55.5)d,易普利单抗34(21~50)d[22]。采用联合疗法免疫治疗相关肝毒性的出现时间更早,时间跨度更长[23]。欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)报道使用纳武利尤单抗联合易普利单抗治疗的患者发生肝毒性的中位时间为51.8(14.7~336)d[23]。
2.2 诊断与鉴别诊断
免疫治疗相关肝毒性的诊断为排除性诊断,询问患者病史时应全面了解患者的用药史、饮酒史、病毒性肝炎史及其他肝病史等。实验室检查应全面筛查患者的肝功能指标、感染性指标;筛查铜蓝蛋白以排除肝豆状核变性;筛查免疫指标如抗核抗体、抗平滑肌抗体、抗中性粒细胞胞浆抗体以排除自身免疫性肝病;筛查α1胰蛋白酶抑制剂以排除遗传因素;筛查肿瘤标志物以排除原发性肝细胞癌或新发肝转移癌;筛查肝脏血管超声以排除血栓事件等。
若患者存在免疫治疗史且可排除其他病因,则考虑免疫治疗相关肝毒性的可能性大。但需警惕免疫治疗相关肝毒性与其他病因并存的可能,应结合患者病情进行综合判断。
2.3 分级
根据美国常见不良反应术语评定标准(common terminology criteria for adverse events,CTCAE),可对免疫治疗相关肝毒性的严重程度进行分级(表1)。目前多数临床研究遵照CTCAE标准,但美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)指南推荐的分级方式更为简单,仅根据AST和ALT的升高程度将免疫治疗相关肝毒性分为1~4级,而胆红素升高>1.5倍正常值上限(Gilbert’s综合征除外)的处理方式类似于4级肝炎[24]。临床上评价肝功能有较多指标,现行分级方式或许不足以区分患者肝毒性的严重程度进而影响临床决策,引入更多指标(如ALP、γ-GT、白蛋白、凝血指标)及临床症状等进行分级,或许可更好地指导免疫治疗相关肝毒性的管理。
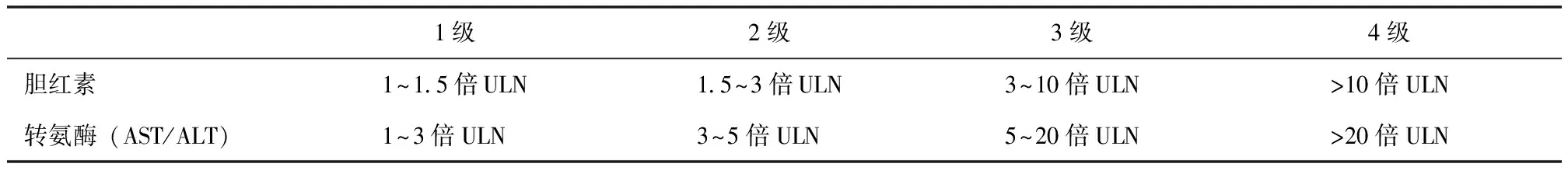
表1 免疫治疗相关肝毒性的严重程度分级[24]
2.4 管理
免疫治疗相关肝毒性的管理包括停止免疫治疗和药物干预两个部分,具体措施需根据肝毒性的严重程度分级而定。发生1级肝毒性时可继续免疫治疗;发生2级肝毒性时需暂停免疫治疗并开始激素治疗,待肝功能恢复至1级且激素减量至10 mg泼尼松当量时可重新启用免疫治疗;而发生3~4级肝毒性时需永久停用免疫治疗并启用较强的激素治疗,是否可重启免疫治疗尚存争议。不同指南对于免疫治疗相关肝毒性管理的推荐意见亦各不相同,详见表2。

表2 免疫治疗相关肝毒性的管理建议[4,20,22,24- 25]
针对乙型肝炎病毒(hepatitis B virus,HBV)或丙型肝炎病毒(hepatitis C virus,HCV)感染者,目前认为在严格管理肝炎的前提下,可安全使用免疫抑制剂。2019年,中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)指南提出,合并HBV感染的患者,应在HBV-DNA低于2000 kU/L时接受免疫治疗,即使HBV-DNA载量不高,HBsAg(+)和/或HBcAb(+)的患者亦应在免疫治疗开始前进行抗病毒治疗,并定期检测HBV-DNA及HBV抗原、抗体水平[25]。HCV感染者无需免疫治疗前接受抗病毒治疗,但应定期监测HCV-RNA水平。
2.5 目前待解决的问题
2.5.1 肝脏穿刺活检的时机
针对免疫治疗相关肝毒性患者,肝脏穿刺活检的时机尚不明确。CSCO[25]和癌症免疫治疗学会(Society for Immunotherapy of Cancer,SITC)[20]建议肝毒性2级及以上即可考虑肝脏穿刺活检,NCCN[24]建议4级可行肝脏穿刺活检,ESMO[22]建议3级及以上激素和吗替麦考酚酯(mycophenolate mofetil,MMF)治疗效果不佳时考虑肝脏穿刺活检,而美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)[4]未给出建议。但一些3~4级肝毒性患者因肝功能衰竭导致凝血功能较差,不宜进行肝脏穿刺活检[26- 28],提示临床应尽早开展此项检查。
对于大部分患者,肝脏穿刺活检有助于鉴别诊断,特别是与自身免疫性肝炎相鉴别。自身免疫性肝炎的常见组织学特点为聚集成簇的浆细胞、玫瑰花环、穿入现象[29],而免疫治疗相关肝毒性几乎无浆细胞[30- 31]。但免疫治疗相关肝毒性与其他药物性肝炎相比,并无特征性组织学特点,二者均表现为急性肝细胞性肝炎,常见淋巴细胞及单核细胞浸润[32]。有研究者在接受CTLA- 4及CTLA- 4联合PD- 1治疗导致免疫治疗相关肝毒性的患者中发现了特征性纤维蛋白环肉芽肿[5],但目前仅限于个案报道,而PD- 1导致的肝毒性组织学异质性较大,无特征性表现。另外,肝脏穿刺活检可提示临床医生减少不必要的激素使用。De Martin等[33]认为无严重组织学损害的3级及以上肝毒性患者可选择停药观察,不建议使用激素。
但目前研究发现,炎症方式、肝小叶损伤程度、是否有肉芽肿或血管内皮炎症等指标并不能预测皮质类固醇的治疗效果,亦不能预测二线免疫抑制剂的治疗效果,因此肝脏穿刺活检的价值有限。故临床是否选择肝脏穿刺活检及何时选择,需综合考虑患者情况及医疗机构水平。
2.5.2 免疫治疗相关肝毒性的激素治疗
激素治疗是否影响免疫治疗效果目前尚存争议。Horvat等[34]对接受易普利单抗治疗后出现irAEs的黑色素瘤患者进行回顾性分析,发现激素治疗不影响患者的总生存期(overall survival,OS)和治疗失败时间(time to treatment failure,TTF)。而Foje等[35]对接受易普利单抗治疗后发生免疫治疗相关垂体炎的黑色素瘤患者进行研究,将其分为大剂量激素治疗组(中位剂量22.4 mg)和小剂量激素治疗组(中位剂量5.5 mg),发现大剂量激素治疗组的OS及TTF明显差于小剂量激素治疗组。Scott等[36]针对使用纳武利尤单抗治疗的非小细胞肺癌患者的研究也支持上述结论,使用泼尼松>10 mg/d的患者相较于未使用激素的患者治疗反应率更差。可能因激素作为一种免疫抑制剂,破坏了ICIs对机体自身免疫系统的激活,因此讨论激素最小有效剂量具有重要临床意义。
各指南对于激素治疗剂量的建议基本一致:2级0.5~1 mg/kg,3级1~2 mg/kg,4级2 mg/kg。但一项小规模临床研究发现,泼尼松60 mg/d即可治疗irAEs,无需再加量[37]。该研究回顾分析了453例使用单药或联合用药进行免疫治疗的患者,其中18例患者发生了1级以上免疫治疗相关肝毒性,将其分为小剂量激素治疗组(50~60 mg)和大剂量激素治疗组(1 mg/kg),结果发现大剂量激素治疗组相较于小剂量治疗组氨基转移酶恢复正常的时间并未缩短、下降的速度并未加快。另有回顾性研究纳入16例发生3级及以上肝毒性的患者,发现其中6例停药后有效,7例接受小剂量激素[0.5~1 mg/(kg·d)]口服治疗后好转[33]。上述研究提示或许低于指南推荐剂量的激素即可治疗irAEs,但目前临床仍首选指南推荐的剂量,不采用激素治疗或盲目激素减量均过于激进。
关于激素治疗的时机,各指南对于3~4级免疫治疗相关肝毒性的治疗建议基本一致,但对2级免疫治疗相关肝毒性的治疗却存在差异。CSCO[25]、SITC[20]和NCCN[24]建议直接开始激素治疗,而ESMO[22]建议停药观察至肝功能持续异常1~2周再开始激素治疗,ASCO[4]建议肝功能异常且出现症状3~5 d后再开始激素治疗。笔者认为,2级免疫治疗相关肝毒性的激素治疗时机应由临床医生进行全面考虑,如果停药观察对于病情进展影响较大,应积极使用激素控制肝功能水平,而激素治疗的给药途径、使用时长、减量及减停时机均有待进一步讨论和完善。
2.5.3 激素难治性肝炎的治疗选择
临床上,激素治疗无效需采用二线治疗方案的病例较少见。最新一项大型研究发现,5762例接受免疫治疗的癌症患者中,433例(7.5%)发生免疫治疗相关肝毒性,其中67例接受激素治疗;激素逐渐减量后,10例出现肝毒性复发,2例需行MMF治疗[38]。目前二线甚至三线治疗方案尚不明确,多数指南建议加用MMF[20,22,24- 25],ASCO[4]还建议加用硫唑嘌呤,但仅基于少量病例报道和专家建议,无大样本临床研究数据证实。
鉴于免疫治疗相关肝毒性的组织学特点通常表现为淋巴细胞浸润性炎症,许多研究开展了针对T淋巴细胞的治疗方案,如抗胸腺细胞球蛋白(antithymocyte globulin,ATG)、他克莫司等。Chmiel等[39]报道1例接受易普利单抗10 mg/kg治疗的黑色素瘤患者,治疗2个疗程后患者出现4级免疫治疗相关肝毒性,给予甲强龙500 mg,病情好转1周后再次恶化,加用MMF未改善,5 d后加用ATG 1.5 mg/kg,病情很快好转。Ziogas等[27]报道1例黑色素瘤患者接受纳武利尤单抗治疗后病情出现进展,改用易普利单抗3 mg/kg 治疗后出现了4级免疫治疗相关肝毒性,给予甲强龙2 mg/kg,病情未见好转,加用MMF及熊去氧胆酸(ursodeoxycholic acid,UDCA)500 mg(2次/d)仍未改善,最终加用他克莫司1.5 mg(2次/d),治疗2 d后好转。CSCO指南[25]也建议激素难治性肝毒性患者可加用他克莫司。Riveiro-Barciela等[28]报道了血浆置换在肝性脑病患者中的应用,建议发生暴发性肝炎时积极选择。
针对以胆酶(ALP,γ-GT)升高为主的肝毒性患者,相关研究发现UDCA具有积极的治疗效果。Kurokawa等[26]报道1例48岁肺腺癌患者接受帕博利珠单抗治疗后出现以胆酶升高为主的肝功能异常,激素治疗后AST、ALT迅速下降,但20 d后加用UDCA治疗,ALP和γ-GT才出现明显下降。Onishi等[40]的研究也证实了UDCA的作用,1例68岁黑色素瘤患者接受4个疗程的纳武利尤单抗治疗后出现免疫治疗相关肝毒性,激素治疗效果不佳,加用UDCA+苯扎贝特后肝功能指标很快恢复正常。UDCA可促进胆汁分泌、带走毒性胆汁酸、减轻肝细胞损害,因此对于胆酶升高的肝毒性患者加用UDCA是一种治疗选择。
其他激素难治性irAEs患者常加用肿瘤坏死因子抑制剂英夫利昔单抗[41],相关研究也证实了英夫利昔单抗在免疫治疗相关肝毒性中的成功经验。如Cheung等[37]报道1例接受易普利单抗联合纳武利尤单抗治疗的黑色素瘤患者,出现免疫治疗相关肝毒性后,采用激素和MMF治疗,氨基转移酶仍持续升高至4级肝炎,加用英夫利昔单抗后肝功能立刻改善。但目前指南未推荐英夫利昔单抗用于治疗免疫治疗相关肝毒性,因肿瘤坏死因子抑制剂可能抑制肝脏的再生能力[42]。Stroud等[43]研究发现,接受纳武利尤单抗治疗的肺癌患者发生irAEs后,采用IL- 6受体抑制剂托珠单抗4 mg/kg(2次/d)疗效显著。但托珠单抗对肝脏的再生能力也有抑制作用[44],因此应尽量避免使用英夫利昔单抗及托珠单抗,在其他方案均无效的情况下,亦需慎重考虑其应用。
2.5.4 免疫治疗再挑战
基于安全考虑,大部分指南建议3级以上严重肝毒性患者应永久停用免疫治疗,但2019年CSCO指南[25]建议3级肝毒性患者可在肝功能恢复至1级且激素减量至10 mg泼尼松当量时重新启用免疫治疗,仅4级需永久停药。目前关于3~4级严重肝毒性患者免疫治疗再挑战安全性的研究较少。Santini等[45]针对非小细胞肺癌患者的研究发现,进行免疫治疗再挑战的患者大部分出现复发或新发irAEs,症状较轻且可管理,其中60% 为1~2级irAEs,40% 为3~4级irAEs(其中85% 可恢复至1级),仅2例患者死亡。另一项大型回顾性研究纳入2010—2019年8750例黑色素瘤患者,其中102例出现3级及以上免疫治疗相关肝毒性;31例选择免疫治疗再挑战,其中约50%的患者出现irAEs,约13%的患者再次出现2级及以上肝毒性,仅20%的患者需中止治疗[46]。虽然研究发现免疫治疗再挑战组和未再挑战组患者的疾病控制率无差异,但免疫治疗再挑战组患者获得完全/部分缓解的概率更大(64.5% 比44.4%,95% CI:1.0~2.1,P=0.055),分析原因可能与免疫治疗再挑战组患者年龄更小、肝损伤程度更轻有关。
另有研究证实纳武利尤单抗一线治疗+易普利单抗再挑战方案与严重irAEs相关。Riveiro-Barciela等[28]报道1例晚期黑色素瘤老年女性患者,接受纳武利尤单抗治疗后出现2级肝毒性,后改为易普利单抗治疗,患者出现了暴发性肝衰竭和肝性脑病。分析可能原因为一线治疗激活机体的免疫系统,增强二线治疗的免疫反应强度,诱发严重的irAEs[47]。
综上,在无其他治疗方案的情况下,对于年龄较小、肝毒性程度较轻的患者可积极尝试免疫治疗再挑战。在再挑战方案上,应考虑“降阶梯式”选择,若初始方案选择了联合治疗,再挑战方案可考虑单药治疗;若初始方案为CTLA- 4治疗,再挑战方案可考虑采用irAEs发生率较低的PD- 1/PD-L1方案,但需警惕肝毒性的再次出现,甚至更严重的irAEs风险。
3 免疫治疗相关肝毒性的预测
早发现、早诊断免疫治疗相关肝毒性对于其管理非常重要,但目前尚无灵敏度和特异度均较高的预测指标。血液学指标方面,研究发现基线绝对淋巴细胞计数增高、中性粒细胞与淋巴细胞比值增高、绝对嗜酸性粒细胞计数增高均与irAEs的发生相关[48];炎症指标如C反应蛋白基线增高也预示着irAEs风险增高;对T细胞、B细胞亚群的研究发现,T细胞多样性增加亦预示着irAEs的发生概率增加[48];各种细胞因子,如G-CSF、FGF-2、IFN-α2、IL- 12p70、IL- 1a、IL- 1b、IL-RA、IL- 2、IL- 13等均可能与irAEs的发生相关[48],但将其整合为一个综合的指标体系可能更具临床意义。
4 小结
免疫治疗相关肝毒性是一种较为常见的、具有一定致死风险的irAEs。诊断方面,主要为排除性诊断,缺乏灵敏度和特异度高的指标对其发生发展进行有效预测;分级方面,目前仅有针对氨基转移酶及胆红素的分级体系,但分级不够细致,建议纳入更多的实验室指标;管理方面,与其他不良反应的管理相似,以停药及使用标准剂量的激素治疗为主,而激素的最小有效剂量及针对激素无效患者的治疗方案尚需更多临床研究数据支持,尽量避免使用英夫利昔单抗及托珠单抗。对于发生严重免疫治疗相关肝毒性的患者,建议应根据指南推荐意见永久停用免疫治疗。在缺乏优于免疫治疗方案的情况下,对于年龄较小、肝毒性程度较轻的患者,可尝试免疫治疗再挑战并选择“降阶梯式”治疗方案,但需警惕暴发性肝衰竭的发生风险。
未来随着对irAEs发生机制的深入研究及ICIs应用范围的扩大,对于免疫治疗相关肝毒性的诊断及管理也应进一步细化,以提高肿瘤患者使用ICIs的安全性,获得理想的临床结局。
作者贡献:华雨薇负责文章撰写;赵林负责文章修订。
利益冲突:无
