静脉输注利多卡因对腹腔镜疝修补术患儿苏醒期躁动的临床观察
2021-10-12许冬妮王培宗卢桠楠
许冬妮,刘 婷,王培宗,卢桠楠
(1.中山大学孙逸仙纪念医院麻醉科,广东广州510120;2.中山大学肿瘤防治中心麻醉科,广东广州510060)
苏醒期躁动,是儿童全身麻醉苏醒期常见的并发症[1]。躁动可能导致患儿的意外伤害,伤口出血、裂开;增加患儿父母的不满焦虑和投诉。右美托咪定是现在最常用的预防儿童苏醒期躁动的药物,但是也有研究指出右美托咪定可能引起拔管时间和苏醒时间的延长,苏醒期低血压和心动过缓也多见[2]。加速康复外科(enhanced recovery after sur⁃gery,ERAS)理念最早由丹麦的Henrik医生提出[3];ERAS的核心是优化围手术期处理措施,减少围手术期应激反应和并发症,从而加快康复,缩短住院时间、改善患者预后[4]。基于ERAS快速康复理念,有没有更好的药物选择,即能预防儿童全麻苏醒期躁动,又能快速全麻复苏?在传统观念里,利多卡因是经典的局麻药和抗心律失常药物。近10年来,越来越多研究指出,静脉输注利多卡因,除了抗心律失常,还能提高患者术后康复质量。围术期静脉输注利多卡因,能够预防阿片类药物引起的呛咳、喉痉挛等不良事件的发生,缓解异丙酚引起的注射痛[5],能够改善术后镇痛,加速胃肠道功能的恢复[6]。基于ERAS理念,本研究探讨静脉输注利多卡因对腹腔镜疝修补术患儿苏醒期躁动的影响。
1 材料与方法
1.1 一般资料
选择2018年4月至2019年6月在中山大学孙逸仙纪念医院施行择期全身麻醉下行腹腔镜疝修补术的患儿60例,美国麻醉医师协会体格分级(American Society of Anesthesia,,ASA)评级Ⅰ~Ⅱ级,年龄2~4周岁。本研究经医院伦理委员会批准,所有入选的患儿监护人均已签署知情同意书。入选的60例患儿随机分成3组,分别为空白对照组(C组),阳性对照右美托咪定组(D组),利多卡因处理组(L组);每组20例。排除标准:①患儿父母拒绝;②ASA评级>Ⅲ级;③已知可能对研究中使用的药物过敏;④发育迟缓或智力障碍;⑤哮喘或其他呼吸系统疾病⑥合并其他严重系统性疾病,如先心病患儿。所有患儿均在手术前1 d进行访视,并告知手术流程和麻醉方案。
1.2 麻醉方法
所有患儿常规禁食禁水,按照ERAS原则,均未给予术前用药。术中监测心电图、无创血压、脉搏血氧饱和度、呼气末二氧化碳分压和七氟醚浓度。所有患儿手术当日均已在病房开放了静脉通道,由父母陪伴入室。插管前10 min,C组患者输注等容量外观的0.9%NaCl;D组患者输注用生理盐水稀释至同等容量的0.5µg/kg的右美托咪定;L组患者静脉输注用生理盐水稀释至同等容量的1.5 mg/kg的利多卡因。麻醉诱导采用丙泊酚3 mg/kg,芬太尼2µg/kg,顺式阿曲库铵0.2 mg/kg快速诱导。术中维持采用七氟醚复合瑞芬太尼,麻醉深度维持在脑电指数45~55之间,瑞芬太尼术中全程为0.1 mg·kg-1·h-1,记录术中七氟醚吸入浓度(吸入新鲜气流量为1L/min,吸入氧浓度60%)。通气模式采用压力控制,潮气量维持在8~10 mL/kg,呼气末二氧化碳维持在35~45 mmhg。液体管理按照4-2-1原则,给予平衡盐溶液,按照血流动力学监测调整速度。手术结束后,所有患儿均转入麻醉后恢复室(postanesthesia care unit,PACU)复苏。当患儿自主呼吸恢复,有吞咽、呛咳,能听指令睁眼、四肢活动以后,由PACU医生拔出气管导管;拔管后PACU护士记录拔管时间并即刻进行用WATCHA躁动评分。术后镇痛采用自控静脉镇痛泵(patient con⁃trolled intravenous analgesia,PCIA),患儿拔管后即开启,输注速度为2 mL/h,自控剂量为0.5 mL/次,锁定时间15 min;镇痛药物为曲马多13 mg/kg+地塞米松0.5 mg/kg,采用生理盐水稀释至150 mL。
1.3 观察指标
1.3.1 主要观察指标:①WATCHA躁动评分。WATCHA躁动评分有5级,具体为:入睡,0分;安静合作,1分;哭闹,需要安抚,2分;哭闹严重,不能安抚,3分;烦躁不安,肢体乱动,4分[7]。②躁动发生率。WATCHA躁动评分≥3分被认为出现躁动[7]。③药物补救人数。拔管后5 min内不能被言语动作安抚的躁动患儿,给予曲马多1 mg/kg静脉注射,并记录需要药物补救的人数。
1.3.2 次要指标:①记录患儿入室心率(heart rate,HR)HR1、插管后即刻心率HR2、切皮后即刻心率HR3、拔管后即刻心率HR4。②术中平均七氟烷吸入浓度。术中每隔5 min记录一次吸入七氟烷浓度,计算平均值。③术后早期镇痛评分。患儿出PACU前,由不参与试验的恢复室护士对患儿进行FLACC评分,即从表情(face)、肢体动作(legs)、行为学(activity)、哭闹(cry)和安慰性(consolability)5个方面评分,每一个项目0~2分,相加即为总评分,分数越高则认为疼痛程度越严重[8]。④48 h内术后镇痛药物曲马多总量。⑤记录术后不良反应的发生率,包括恶心呕吐、嗜睡等。⑥记录术后24 h累计新发适应不良的发生率,包括无缘由发脾气、噩梦、分离焦虑、睡眠改变等。
1.4 统计学处理
采用SPSS19.0统计软件,检验水准为双侧α=0.05,检验功效1-β>0.8,计算后,每组样本量选择20例。符合正态分布计量资料采用(xˉ±s)表示,各组间采用单因素方差分析;重复测量资料采用重复测量方差分析,当Mauchly’s假设检验不满足球形假设条件,采用Greenhouse-Geisser校正。等级资料采用中位数(上四分位数-下四分位数)表示,各组间采用Kruskal-WallisH检验,并采用Wilcoxon检验两两比较的结果。计数资料采用比值或百分比表示,Pearson Chi-Square分析;当列联表中有理论频数<1时,采用Fisher’s确切概率法分析。检验水平为双侧=0.05;P<α为有统计学意义。方差分析差异有统计学意义时,两两比较采用Bonferro⁃ni法,双侧α’=α/3=0.017,P<α’为差异有统计学意义。
2 结果
2.1 一般临床资料
三组患儿在年龄、体质量、性别构成、手术时间上差异没有统计学意义(P>0.05;表1),具有可比性。

表1 一般情况及手术情况表Table 1 Generalinformation and surgeryinforma⁃tion in three groups (xˉ±s,n=20)
2.2 术中七氟醚平均浓度、拔管时间和恢复室停留时间分析
三组患儿术中平均七氟醚吸入浓度、术后拔管时间和PACU停留时间都存在统计学差异(P<0.05,表2)。采用Bonferroni法校正,进一步两两比较,患儿术中平均七氟醚吸入浓度D组和L组低于C组,L组拔管时间明显少于D组,L组恢复室停留时间明显少于C组和D组,差异有统计学意义(P<0.017;表2)。

表2 七氟醚平均浓度,拔管时间和恢复室停留时间Table 2 Averagesevfluraneconcentration,time of extubation and PACU (xˉ±s,n=20)
2.3 血流动力学分析
HR1在3组间不存在统计学差异(P>0.05;表3),HR2、HR3、HR4 3组间存在统计学差异(P<0.05,表3)。采用Bonferroni法进一步两两比较,D组和L组HR2、HR3和HR4均低于C组,差异有统计学意义(P<0.017)。
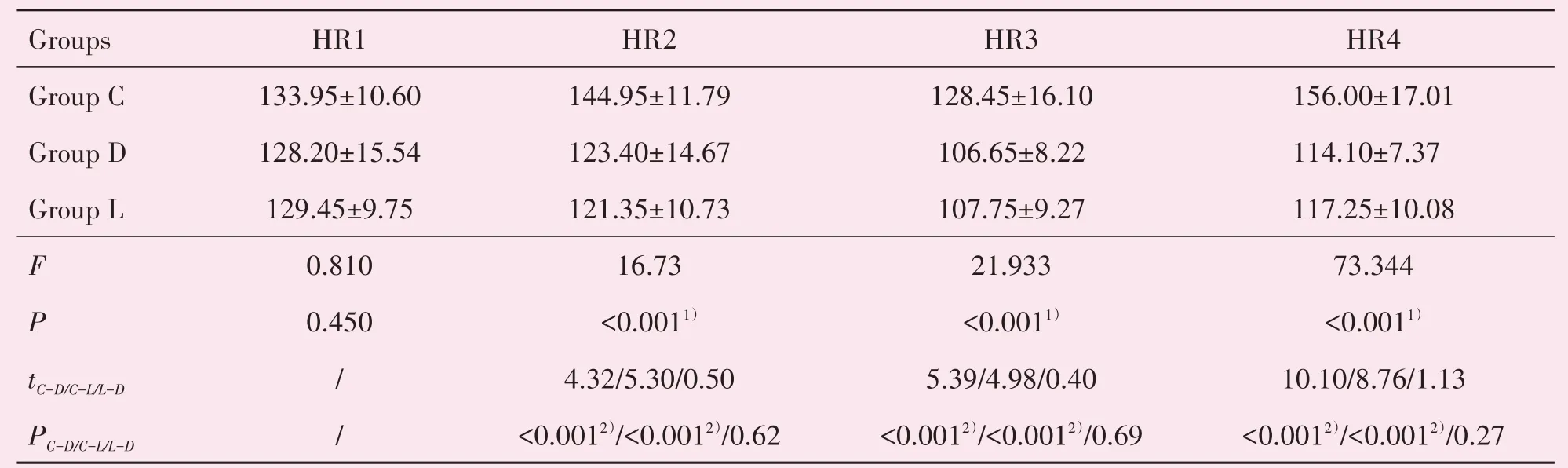
表3 三组患儿心率变化情况表Table 3 TheVariety of Heart Rate in three groups (xˉ±s,n=20,rate/min)
2.4 苏醒期躁动情况分析
三组患儿苏醒期WATCHA躁动评分、躁动发生率、药物补救人次都存在统计学差异(P<0.02,P<0.001,P<0.001,表4)。D组、L组患儿术后WAT⁃CHA躁动评分分别为1.20±1.15和1.45±1.19,均低于C组(2.80±1.15)min;采用Bonferroni校正后,两两对比发现D组和L组患儿术后WATCHA躁动评分差异有统计学意义(P<0.017,表4)。D组、L组患儿躁动发生率分别为15%、20%,均低于C组70%;补救加药人次均为10%,低于C组55%;采用Bon⁃ferroni校正,两两对比发现差异有统计学意义(P<0.017;表4)。
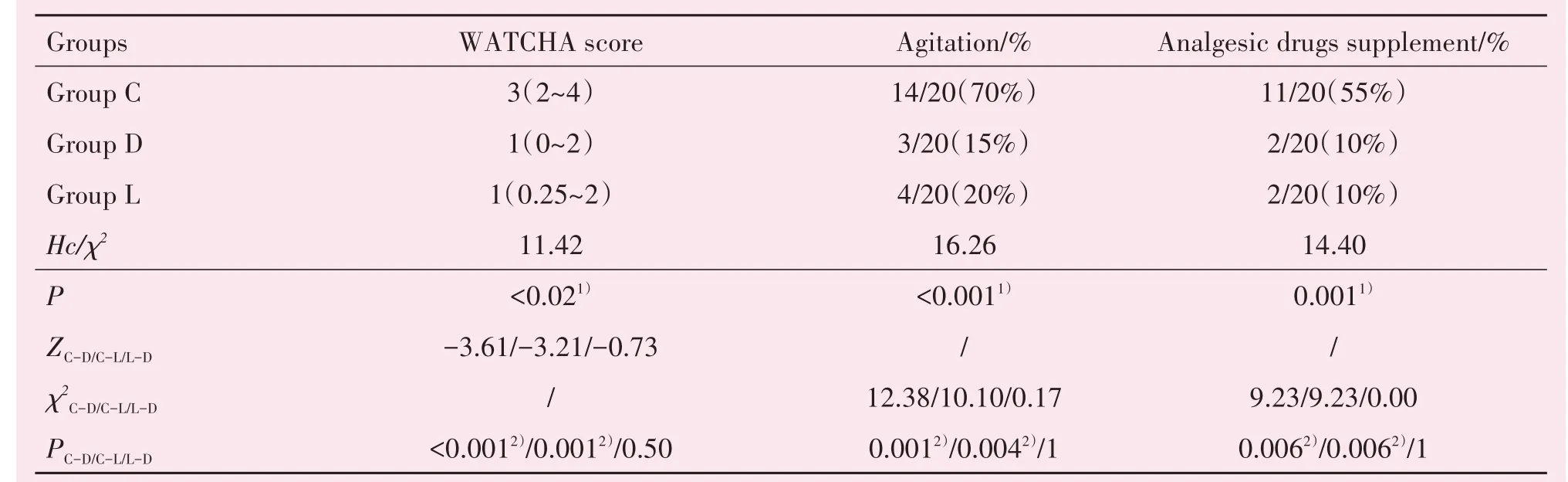
表4 苏醒期躁动情况表Table 4 The comparison of postoperativeagitation in three groups
2.5 术后疼痛情况分析
三组患儿术后早期镇痛FLACC评分没有统计学差异(P>0.05;表5)。48h内曲马多用量存在统计学差异,(P=0.003;表5)。D组、L组患儿48h曲马多用量均低于C组,采用Bonferroni法校正,进一步两两比较,差异有统计学意义(P<0.017;表5)。

表5 三组间FLACC评分及48 h内曲马多总量比较Table 5 The comparison of FLACC score and dosage oftramadolin three groups
2.6 三组患儿术后不良反应和新发适应不良情况比较
三组患儿恶心呕吐、嗜睡等术后不良反应发生率没有统计学差异(P>0.05;表6)。术后24 h累计新发适应不良(包括无缘由发脾气、噩梦、分离焦虑、睡眠改变等)的发生率存在统计学差异,(P=0.002,表6)。D组和L组患儿术后24 h新发适应不良低于C组,采用Bonferroni法校正,进一步两两比较,差异有统计学意义(P<0.017,表6)。

表6 三组患儿术后不良反应和新发适应不良情况比较Table6 The comparison ofside effects and new maladaptive behaviors in three groups (n/N(%))
3 讨 论
躁动是儿童全麻术后很常见的并发症,目前认为,与其发生相关的危险因素有:学龄前儿童、术前明显焦虑、苏醒过快(尤其在不熟悉的环境中)、手术部位及类型(尤其是耳鼻喉、口腔等头面部手术)、围术期低氧血症、吸入麻醉药(七氟醚和地氟醚)、术后疼痛等[9]。虽然儿童的术后躁动大多数持续时间并不长,有自限性,有可能在短时间内自行缓解;然而这仍然是一个必须处理的问题;躁动可能导致患儿各种意外伤害;伤口裂开、出血,气道高危事件的增加;从而需要更多的医护人员,并且术后复苏时间必然延长。对医疗环境来说,躁动的发生还会增加患儿父母的不满焦虑情绪和投诉。目前,七氟醚是儿童最常用的吸入性全身麻醉药。七氟醚没有刺激性气味,诱导苏醒迅速,麻醉效能强,安全性高,对支气管起扩张作用,不易发生气道高风险事件[10],广泛用于儿童全麻的诱导和维持。然而,七氟醚的广泛应用,进一步导致了儿童全身麻醉后,苏醒期躁动的高发[1]。
既往的研究探讨过阿片类药物、非甾体镇痛药和咪达唑仑等减少患儿术后躁动的可行性。然而,阿片类药物的使用会增加术后恶心、呕吐、呼吸抑制、尿滞留和苏醒延迟的风险[11]。非甾体镇痛药,如酮咯酸、对乙酰氨基酚等,并不能很好的缓解儿童术后躁动[12]。咪达唑仑可能会导致明显的苏醒延迟[13]。右美托咪定是近年来最常用的预防儿童术后躁动的药物,也有可能导致拔管时间和苏醒时间的延长,苏醒期低血压和心动过缓也多见[2]。
利多卡因一直是经典的局麻药和抗心律失常的药物。近10年来,有大量的研究指出,围术期使用利多卡因能够减少全麻术中的七氟醚用量,从而改善儿童全麻患者的预后[14]。围术期输注利多卡因能够降低气管插管的心血管反应[15],减少炎症依赖性术后疼痛的强度[16],减少阿片类药物的用量,改善术后镇痛,加速胃肠道功能的恢复[6]。静脉输注利多卡因,其镇痛的机制并不是通过传统认知的阻断钠通道,可能与内源性腺苷系统相关,通过升高血液中花生四烯酸乙醇胺的浓度,降低花生四烯酰甘油的浓度实现[17-18]。
ERAS理念是最近20年来外科学和麻醉学领域最为重要的医学理念与实践革新之一[1];其核心在于采用多模式策略和流程优化,目标是减少围术期并发症、缩短住院时间、改善预后[2]。近年来,井喷的手术增长使得日间手术室也被很多医院提上了日程,日间手术指的是患者在24 h内入院、出院完成的手术或操作(指有计划的手术和操作,不包括门诊手术;少数病情特殊需要延长住院时间的患者,住院最长时间也不应超过48 h)[19]。ERAS的实施是日间手术的安全基础和关键保障,而日间手术的发展,不但能缩短住院天数,降低费用,而且能进一步整合医疗资源,实现医患双赢。
因此,我们选择了将来能够从住院手术转变为日间手术实施的腹腔镜疝修补术为研究对象[20],基于ERAS理念,观察静脉输注利多卡因对腹腔镜疝修补术患儿苏醒期躁动的影响。我们发现,静脉输注利多卡因与右美托咪定类似,都能够明显降低术后躁动的发生,降低术中平均七氟醚吸入浓度和48 h曲马多用量,推测与其镇痛作用有关[6,14-16]。但是,与右美托咪定相比,利多卡因组拔管时间和恢复室停留时间都更短,复苏更快。
幼儿心输出量以增加心率为主,本研究选择了患儿心率为观察指标;3组患儿中都没有需要使用阿托品或多巴胺的心血管不良事件出现,但是L组和D组心率会更稳定,这与Amir的研究结果一致[5]。3组患儿术后早期镇痛FLACC评分没有统计学差异,推测与C组追加的补救药物曲马多有关。3组患儿术后恶心呕吐发生率没有统计学差异,可能是幼儿本身不是恶心呕吐高发人群。D组患儿嗜睡发生率高于其他两组,但差异没有统计学意义,这可能与右美托咪定本身镇静作用相关[2]。虽然大部分儿童的全麻术后躁动持续时间不长,有自限性,但是仍然有部分患儿会在术后24 h出现无缘由发脾气、噩梦、分离焦虑、睡眠改变等新发适应不良的情况。D组和L组患儿术后24 h新发适应不良明显低于C组,说明静脉输注利多卡因或右美托咪定,都可以降低术后新发适应不良的发生率。
综上所述,静脉输注利多卡因能够减少腹腔镜疝切除术患儿术后躁动的发生,减少术中七氟醚的用量,减少术后镇痛药物的用量,降低术后新发适应不良的发生率,并且患儿围术期心率更稳定。与右美托咪定相比,静脉输注利多卡因有更短的拔管时间和恢复室停留时间,复苏更快,可以作为ERAS理念下幼儿日间手术室的备选项。
