小肽对凡纳滨对虾生长、抗氧化能力、非特异性免疫及肠道菌群结构的影响
2021-10-12吴远彩李日美申光荣杨奇慧谭北平迟淑艳
吴远彩,李日美,申光荣,黄 放,杨奇慧,谭北平,迟淑艳
(1.广东海洋大学水产学院,广东 湛江 524088;2.深圳市裕农科技股份有限公司,广东 深圳 518110)
凡纳滨对虾(Litopenaeus vannamei)对盐度和温度的适应范围较广,其虾肉品质好,生长迅速,是我国乃至世界上养殖产量最高的对虾之一[1-2]。小肽(Small peptide)是蛋白质分解时的产物,是由2~ 4 个氨基酸构成的一种高活性肽。研究发现人类组织可完整地利用小肽而直接参与蛋白质合成[3]。小肽与氨基酸的吸收是两个独立的系统,且小肽的吸收比氨基酸快,避免了两者的吸收竞争,进而影响蛋白质的代谢[4]。小肽可与矿物质和金属离子等物质结合,形成小肽螯合物[5-6],推动矿物质和金属离子在机体内的吸收和沉积[7]。此外,小肽还有保护肠道健康和促进肠道发育的功能。饲料中添加适量小肽有利于提高水产动物生长,改善饲料效率,增强抗逆能力,从而提高成活率[8-9]。饲料中添加小肽可有效提升星斑川鲽(Platichthys stellatus)幼鱼的生长性能[10]。适量大豆小肽蛋白替代鱼粉对黄颡鱼(Pelteobagrus fulvidraco)的生长指标、酶活和抗氧化能力无不良影响[11]。添加小肽可有效提升凡纳滨对虾的生长和抗病能力[12-13]。但不同小肽产品,促生长效果可能不尽相同。本研究分析饲料中添加小肽后,凡纳滨对虾幼虾生长性能、抗氧化能力、非特异性免疫、肠道菌群组成,评估小肽在对虾饲料中的应用效果与适宜添加水平,为凡纳滨对虾饲料中小肽应用研究提供理论依据。
1 材料与方法
1.1 试验饲料
小肽购自深圳裕农生物技术有限公司,是酶解豆粕蛋白,分子质量范围见表1。在基础饲料中分别添加0.0%、0.1%、0.2%、0.3%、0.4%和0.5%小肽(分别记为L0、L1、L2、L3、L4 和L5 组),配制成6 种饲料(表2)。全部饲料原料均过孔径180 μm的筛,用模具粒径为1.0 mm 和1.5 mm 的制粒机制成颗粒饲料,阴凉处风干,于-20 ℃冰箱保存待用。
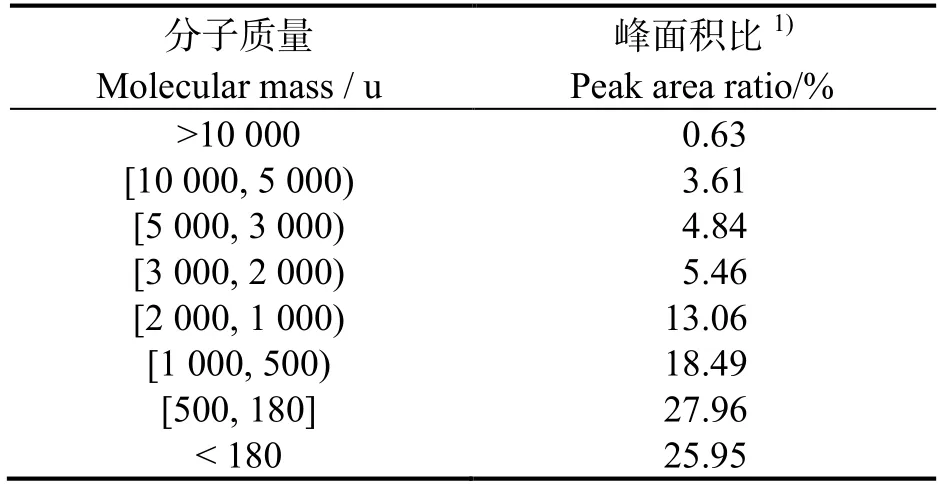
表1 小肽分子质量分布Table 1 Molecular mass of small peptides

表2 基础饲料组成及营养水平(干物质基础)Table 2 Composition and nutrient levels of basal diets(DM basis)
1.2 试验动物与养殖管理
凡纳滨对虾幼虾由广东海兴农集团有限公司提供,购进后暂养30 d,虾苗养殖全程使用购置的商品饲料。挑选体质量为(0.47±0.01)g 的幼虾960 尾,在0.3 m³的玻璃纤维桶中饲养8 周。设6个处理组,4 个重复组。实验前3 周每日按照幼虾初始体质量的8%~ 10%,以3∶2∶2∶3 的比例分别在7:30、12:00、16:30、21:00 投料,隔天换水1/3~ 1/2。后5 周根据虾体大小和水质调整投食量,每天换水1/3~ 2/3。养殖期间pH 为7.8~ 8.2,水温在28.4~ 31.2 ℃,氨氮质量浓度小于0.03 mg·L-1,连续充气,溶解氧大于6.7 mg·L-1,海水盐度26~ 28。
1.3 样品采集
养殖试验结束时,对虾饥饿处理24 h,统计数量和质量。随机取对虾10 尾,围心腔抽血,离心,取上清,保存在-80 ℃,用于血清抗氧化和非特异性免疫的检测;活虾置于冰上剖取全肠,分别于冻存管中,保存在-80 ℃超低温冰箱,用于肠道菌群分析。每个重复组随机取虾5 尾,保存于-20 ℃冰箱,用于全虾体成分分析。
1.4 指标测定
1.4.1生长性能指标 主要为增重率(Weight gain rate,WGR)、饲料系数(Feed conversion rate,FCR)、特定生长率(Special growth rate,SGR)、成活率(Survival rate,SR)、蛋白质效率(Protein efficiency ratio,PER)。
增重率(%)=(mt-m0)/m0,
饲料系数=摄食量干质量/(mt-m0),
特定生长率=(lnmt-lnm0)/t,
成活率(%)=终末数量/ 初始数量,
蛋白质效率=(mt-m0)/ 蛋白质摄入量。
式中,mt为终末均体质量(g);m0为初始均体质量(g);t为试验持续时间(d)。
1.4.2饲料常规及全虾体成分分析 饲料和全虾常规分析参照AOAC(1995)[14]的方法。于105 ℃恒温烘箱中烘干,测定饲料及全虾样品水分含量;粗蛋白质含量用凯氏定氮法测定(KjeltecTM8400,Sweden);用索氏抽提法(石油醚作为提取溶剂)测定粗脂肪含量;粗灰分含量使用550 ℃马弗炉灰化法测定。
1.4.3血清中非特异性免疫指标和抗氧化酶活的测定 血清中溶菌酶 (LSZ)、超氧化物歧化酶(SOD)、总蛋白(TP)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、总抗氧化(T-AOC)、丙二醛(MDA)、酚氧化物酶(PO)、谷胱甘肽过氧化物酶(GSH-Px)活力分别用南京建成生物研究所相应的试剂盒测定,按照试剂盒说明书进行。
1.4.4凡纳滨幼虾肠道菌群的测序分析 肠道微生物菌群结构由苏州金唯智生物科技有限公司进行16S rDNA 测序分析。使用Magen Hipure Soil DNA Kit(Qiagen,Germany)试剂盒提取基因组DNA,用检测合格的PCR 引物扩增原核生物16S rRNA 基因上包括V3 和V4 两个高度可变区,采用包含“CCTACGGRR BGCASCAGKVRVGAAT”序列的上游引物和包含“GGACTACNVGGGTWTCTAATCC”序列的下游引物扩增V3 和V4 区。PCR 产物用琼脂糖凝胶电泳检测。构建 Meta Vx™文库,使用Illumina MiSeq 测序,通过对读数(Reads)拼接过滤、聚类,并进行对虾肠道微生物有效操作分类单元(Operational taxonomic units,OTUs)统计,分析物种多样性及肠道菌群结构,探讨饲料中添加小肽对凡纳滨对虾肠道菌群的影响。
1.5 数据处理
试验数据以平均值±标准差(Mean±SD)表示,数据分析采用SPSS 17.0 软件进行单因素方差分析,用Duncan’s 进行多重比较,存活率数据则先进行反正弦平方根转换再进行统计分析,设α=0.05。
2 结果
2.1 小肽对凡纳滨对虾幼虾生长性能的影响
由表3 可知,与L0 组相比,饲喂不同水平的小肽饲料对凡纳滨对虾幼虾的成活率、特定生长率、蛋白质效率均无显著影响(P> 0.05);L1、L4 和L5 组幼虾增重率显著高于L0 组(P< 0.05);L1 组饲料系数显著低于L0 组(P< 0.05),其余各组与L0 组无显著差异(P> 0.05)。
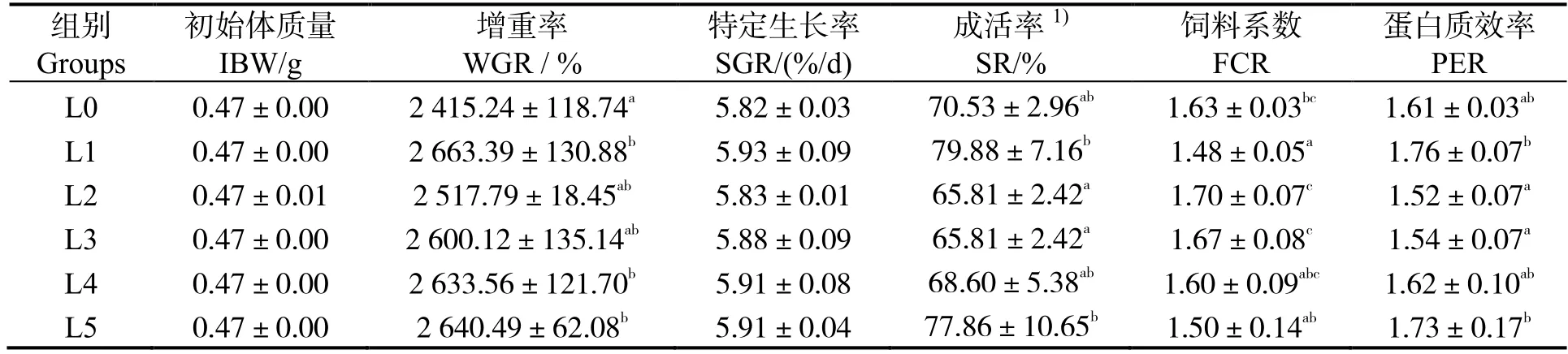
表3 小肽对凡纳滨对虾幼虾生长性能的影响Table 3 Effects of small peptides on growth performance of juvenile Litopenaeus vannamei
2.2 小肽对凡纳滨对虾幼虾体成分的影响
由表4 可知,小肽对凡纳滨对虾幼虾粗脂肪含量、水分含量无显著影响(P> 0.05);小肽组幼虾粗蛋白含量显著高于L0 组(P< 0.05);L3 组与L0 组幼虾粗灰分含量差异无统计学意义(P>0.05),均显著高于其余小肽组(P< 0.05)。

表4 小肽对凡纳滨对虾幼虾体成分的影响Table 4 Effects of small peptides on body composition of juvenile Litopenaeus vannamei %
2.3 小肽对凡纳滨对虾幼虾血清非特异性免疫指标的影响
由表5 可知,小肽组幼虾血清总蛋白(TP)含量、酚氧化物酶(PO)和酸性磷酸酶(ACP)活力显著高于L0 组(P< 0.05);L0 组的碱性磷酸酶(AKP)活力与L5 组无显著差异(P> 0.05),显著低于其余小肽组(P< 0.05)。

表5 小肽对凡纳滨对虾幼虾血清生化指标的影响Table 5 Effects of small peptides on serum biochemical indexes of juvenile Litopenaeus vannamei
2.4 小肽对凡纳滨对虾幼虾血清抗氧化指标的影响
由表6 可知,小肽组幼虾超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活力和总抗氧化(T-AOC)均显著高于L0 组(P< 0.05);小肽组幼虾丙二醛(MDA)含量显著低于L0 组(P< 0.05)。
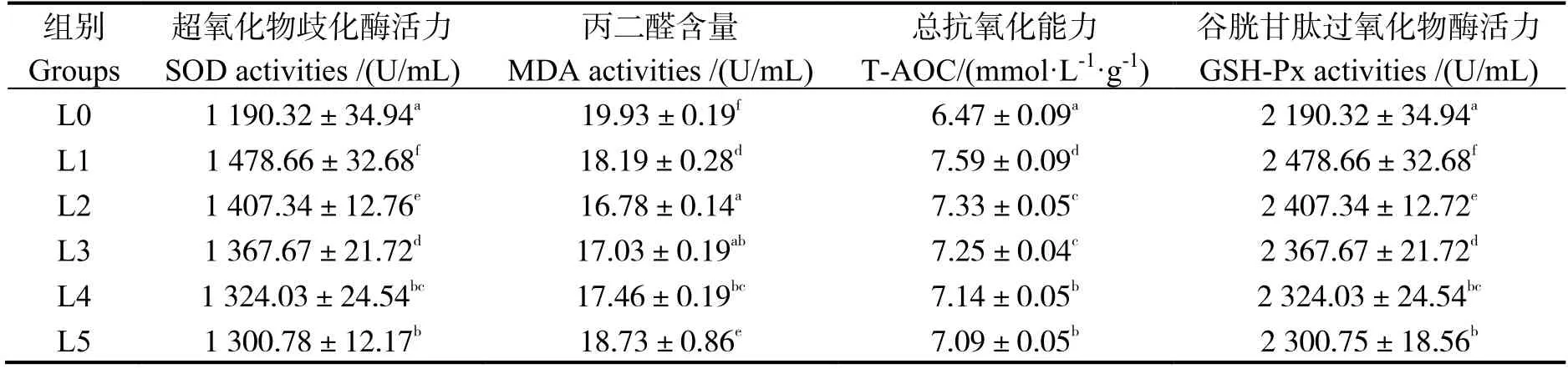
表6 小肽对凡纳滨对虾幼虾血清抗氧化能力的影响Table 6 Effects of small peptides on serum antioxidant activity of juvenile Litopenaeus vannamei
2.5 小肽对凡纳滨对虾肠道微生物OTUs 数的影响
由表7 可知,经过拼接、质量控制后每个样品平均产生153 392 条读数,质量值大于等于30 的碱基数均超过总碱基数的90%,测序结果准确;各样品覆盖指数均在0.998 以上,满足测序质量要求。
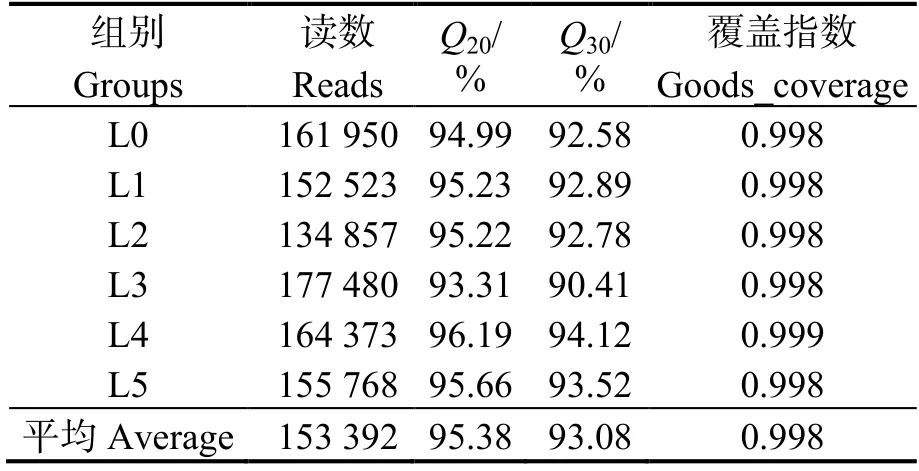
表7 凡纳滨对虾肠道测序序列数据量及测序质量Table 7 Data quantity and sequencing quality of intestinal sequences of Litopenaeus vannamei
由图1 可知,饲料中添加不同水平小肽对凡纳滨对虾全肠OTUs 数目无显著影响(P >0.05)。全肠OTUs 数目最高值出现在L4 组。

图1 小肽对凡纳滨对虾幼虾全肠OTUs 数目的影响Fig.1 Effects of small peptides on the number of OTUs in whole intestine of juvenile Litopenaeus vannamei
2.6 凡纳滨对虾肠道微生物α 多样性指数统计
如表8 可知,凡纳滨对虾全肠Ace、Chao1、Shannon、Simpson 指数均无显著差异(P>0.05)。
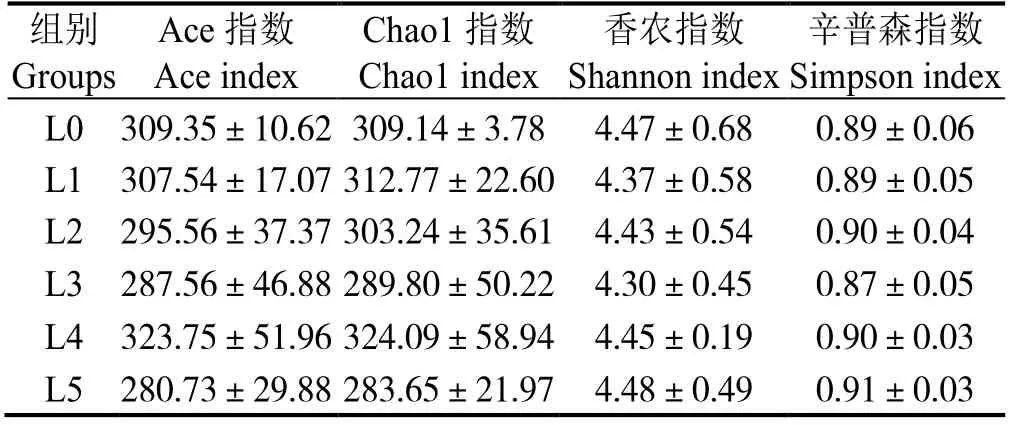
表8 小肽对凡纳滨对虾全肠α 多样性指数的影响Table 8 Effects of small peptides on α diversity index in whole intestine of Litopenaeus vannamei
2.7 凡纳滨对虾幼虾全肠菌群组成
如图2(a)所示,在门水平上,丰度较高的主要有变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、软壁菌门(Tenericutes)和厚壁菌门(Firmicutes)等。L0 组和L2 组的肠道细菌群落组成类似,两个组别的优势菌群的丰度相对一致。各组间相比,L0 组幼虾肠道中变形菌门、厚壁菌门相对丰度最高,L3 组幼虾肠道中拟杆菌门相对丰度最低,软壁菌门丰度最高。
图2(b)表明,在纲水平上,主要优势菌有拟杆菌纲(Bacteroidia)、γ-变形菌纲(Gammaproteobacteria)、柔膜菌纲(Mollicutes)和α-变形菌纲(Alphaproteobacteria)。与L0 组相比,小肽组肠道中α-变形菌纲丰度增加,γ-变形菌纲丰度减少,并在L1 组最低。与其他处理组相比,L3 组肠道拟杆菌纲丰度降低,柔膜菌纲丰度增加。
图2(c)表明,在属水平上,除部分无法鉴别的菌属(Unclassified)外,鲁杰氏菌(Ruegeria)、Motilimonas菌、弧菌 (Vibrio)、Hopperia为优势菌属。

图2 凡纳滨对虾肠道细菌种群门(a)、纲(b)、属(c)水平分布Fig.2 Distribution of bacterial population in gut of Litopenaeus vannamei at taxonomic level of phylum(a),class(b) and genus(c)
由图3 可知,L1 组弧菌丰度显著降低(P<0.05),其余各组间无显著差异。

图3 凡纳滨对虾肠道中弧菌属丰度组间差异Fig.3 Differences between groups in the abundance of Vibrio spp.in gut of Litopenaeus vannamei
3 讨论
3.1 小肽对凡纳滨对虾生长性能的影响
传统的蛋白质消化、吸收理论认为,蛋白质在肠道内,在胰蛋白酶和糜蛋白酶作用下生成游离氨基酸和小肽,小肽在肽酶的作用下被完全水解成游离氨基酸,并以游离氨基酸形式进入血液循环[15]。多种生物活性小肽(磷酸肽、阿片肽、内啡肽、促泌肽等)可在消化过程中释放出来,促进消化道的蠕动,改善消化机能,促进动物生长[16]。本研究中,小肽添加组增重率均高于对照组,且L1 组最大,表明在凡纳滨对虾饲料中添加小肽可提高其生长性能。在星斑川鲽幼鱼(Platichthys stellatus)[10]、牙鲆幼鱼(Paralichthys olivaceus)[17]、双棘原黄姑鱼(Nibea diacanthus)[18]、日本沼虾(Macrobrachium nipponense)[19]研究中也得出类似的结果。
3.2 小肽对凡纳滨对虾体成分的影响
研究表明,在饲料中添加适量小肽对水产动物体内蛋白质的合成有促进作用[11,20],血液循环中的小肽可直接参与组织蛋白质的合成[21]。本研究中,添加小肽组全虾粗蛋白均显著高于对照组,表明饲料中添加小肽可提高凡纳滨对虾的蛋白质合成。此外,各小肽添加组全虾水分和粗脂肪与对照组无显著差异,而各添加小肽组粗灰分均低于对照组,可能是因为酪蛋白磷酸肽 (CPP) 在动物小肠内可与钙结合而阻止磷酸钙沉淀的形成,从而导致全虾粗灰分减少[15]。在星斑川鲽幼鱼[10]的研究中也发现,随着饲料中小肽添加水平的上升,全鱼的粗灰分出现下降趋势,与本研究一致。
3.3 小肽对凡纳滨对虾血清生化与非特异性免疫的影响
血液指标是评价动物机能状态的重要指标之一。血清中TP 除与机体合成蛋白质的能力有关,还与血液的代谢运输,维持渗透压等息息相关[22],是机体非特异性免疫中极其重要的一部分[23]。本研究中,与L0 组相比,小肽组幼虾血清总蛋白含量显著提高,随小肽添加量的增加,总蛋白含量呈先升后降的变化趋势,L3 组最高,这与全虾粗蛋白趋势相似,两者成正相关的关系。说明一定量的小肽提高了凡纳滨对虾体内蛋白质沉积以及对虾的免疫能力。AKP 是溶酶体的重要组成部分,可促进磷酸物质的水解和转运,在对虾机体免疫反应中发挥重要作用[24-25],此外,AKP 与骨骼[26-27]和性腺[28]的发育有关。酸性条件下,ACP 对磷酸单酯进行催化水解,生成无机磷酸,同时也对机体能量平衡和信号转导等有重要作用[29-30]。本研究中,小肽组幼虾血清ACP 活力显著高于L0 组,而血清中AKP活力L0 和L5 组之间没有显著差异,显著低于其余各组,总体呈现先升高后降低的趋势。表明添加一定量的小肽可增强对虾的酸、碱性磷酸酶活力,这反映对虾机体对外源性物质污染防御强度,体液、细胞免疫综合能力的提高。刘文斌等[31]在研究酶解豆粕对异育银鲫(Carassius auratus gibelio)的免疫酶活力时发现,添加适量小肽可有效提高AKP 与ACP 酶的活力,与本研究一致,可能是因为小肽在鱼、虾血清中酸、碱性磷酸酶的调节机制有相似性。
PO 是一种氧化酚类物质的酶,其诱导产生的黑色素及中间代谢产物可杀死入侵虾体的微生物和寄生虫,机体缺乏抗氧化酶会导致机体代谢紊乱和阻碍信号传导,严重时还会导致机体死亡[32-33]。陈永康等[34]用富含小肽的酵母水解物饲料饲喂低温胁迫条件下的凡纳滨对虾,有助于提高其血清中的PO 活力,增强机体的抵抗力。杨奇慧等[35]研究表明,饲料中添加富含小肽的酶解植物蛋白时,凡纳滨对虾血清中PO 的活力随着添加水平的提高呈现先上升后下降的趋势。本研究中,添加小肽可提高凡纳滨对虾血清的PO 活力,增强其抵抗外界侵染的能力,与前人的结果基本一致。
3.4 小肽对凡纳滨对虾抗氧化酶活力的影响
机体内的SOD与GSH-Px形成具有抗氧化能力的保护系统,可抵御氧化物的干扰和损伤[36-37]。SOD 有抗炎、抗病毒及抗氧化等多种功能,是机体内常见的抗氧化酶,主要清除超氧阴离子。GSH-Px可消除机体内过多的过氧化物,使体内自由基保持在低水平,维持生物膜的功能。脂质过氧化时产生的MDA 会导致机体生物膜的结构异变与功能紊乱,MDA 含量一定程度上可反映机体受自由基损害的程度。研究表明,饲料中添加小肽可提高在低温胁迫条件下的小黄鱼(Larimichthys polyactis)的GSH-Px 活力[38],饲料中添加大豆酶解蛋白可显著提高凡纳滨对虾血清中SOD 活力[39],凡纳滨对虾血清MDA 含量在适量添加酵母培养物后下降,抗氧化能力有所提高[40]。本研究中,小肽组SOD、GSH-Px 以及T-AOC 显著升高,MDA 的含量显著降低,其中添加质量分数0.1%小肽的L1 组SOD、GSH-Px 以及T-AOC 最高,表明在凡纳滨对虾饲料中添加小肽,可提高机体抗氧化酶活力,提高自身免疫能力,形成完善的抗氧化系统,减轻过氧化物对机体的损伤。
3.5 小肽对凡纳滨对虾肠道菌群的影响
肠道菌群在动物消化吸收过程中有至关重要作用,其分泌的各种代谢产物还直接或间接影响动物的机体健康[41-43]。在肠道菌群研究中,Ace 指数、Chao1 指数、Shannon 指数、Simpson 指数等α 多样性指数可指示肠道微生物的丰富度[44]。本研究中,4 种α 多样性指数均无显著差异,表明在饲料中添加小肽,对凡纳滨对虾肠道微生物群丰富度无显著影响。可能是因为对虾肠道对微生物系统提供一定的庇护作用,微生物群落的整体丰富度和多样性不易改变[44-45]。
对虾肠道中主要细菌类群在门水平上为变形菌门、厚壁菌门和拟杆菌门[46],在纲水平上为γ-变形菌纲和α-变形菌纲[47]。本研究有类似结果,凡纳滨幼虾肠道菌群结构在门水平上的变形菌门、厚壁菌门、拟杆菌门和纲水平上拟杆菌纲、γ-变形菌纲、α-变形菌纲占主要优势。在属水平上,凡纳滨幼虾肠道主要优势菌为鲁杰氏菌、Motilimonas菌、弧菌和Hopperia菌。弧菌是海洋中的优势菌属,也是海水养殖动物的主要致病菌之一[48]。何远法等[49]研究发现,增加酵母培养物可降低凡纳滨对虾肠道的弧菌数量。本研究有类似结果,L1 组弧菌相对丰度显著降低,表明在饲料中添加质量分数0.1%小肽可降低凡纳滨对虾肠道弧菌数量,可在一定程度上抑制弧菌毒性,降低凡纳滨对虾感染肠炎的风险。
4 结论
本研究表明,饲料中添加质量分数0.1%的小肽可提高凡纳滨对虾的增重率,降低饲料系数,促进凡纳滨对虾生长,提高抗氧化能力和非特异性免疫力,降低弧菌数量,减轻不良菌群对肠道的侵害作用。
